機能障害ミトコンドリアを標的とする新たな創薬開発をめざして
2020-09-28 川崎学園川崎医科大学,山形大学医学部,日本医療研究開発機構
発表者
日野 啓輔(川崎医科大学肝胆膵内科学 教授)
原 裕一(川崎医科大学肝胆膵内科学 講師)
田中 敦(山形大学医学部メディカルサイエンス推進研究所 准教授)
発表のポイント
- ミトコンドリア(注1)は生体内のエネルギーを産生したり、細胞の生死を制御したりする重要な細胞内器官です。このためミトコンドリアの障害はがんや糖尿病などの代謝性疾患、パーキンソン病などの神経変性疾患などの進展に関与します。
- 障害を受けたミトコンドリアを排除する仕組みはこれまでにもいくつか報告されていますが、本研究グループは細胞内の鉄が減少すると障害ミトコンドリアが選択的に排除される仕組みとこれにより肝発がんが抑制されることを初めて発見しました。
- 本研究成果は障害ミトコンドリアの蓄積を防ぎ、ミトコンドリアの機能を保つ手段として、ミトコンドリアを標的とする新たな創薬開発への展開が期待されます。
発表の概要
ミトコンドリアは生体内のエネルギーを産生したり、細胞の生死を制御したりする重要な細胞内器官であるため、障害を受けた個々のミトコンドリアをオートファジー(注2)により分解、排除する(マイトファジー(注3))ことで細胞内器官としての機能を維持しようとします。したがって、マイトファジーの誘導により生体の恒常性を保つことは、肝発がん、代謝性疾患等の治療戦略として期待されます。一方、近年鉄キレート剤(注4)によるマイトファジーの誘導が報告されましたが、その機序については不明のままでした。
今回、川崎医科大学肝胆膵内科学の原裕一講師と日野啓輔教授、名古屋大学大学院医学系研究科生体反応病理学の簗取いずみ助教、山形大学医学部メディカルサイエンス推進研究所の田中敦准教授ならびにサウスカロライナ大学のLemasters教授らの研究グループは、細胞内の鉄が欠乏するとどのようにしてマイトファジーが誘導されるのかその分子機序を明らかにし、マイトファジーの誘導により肝発がんが抑制されることを見出しました。
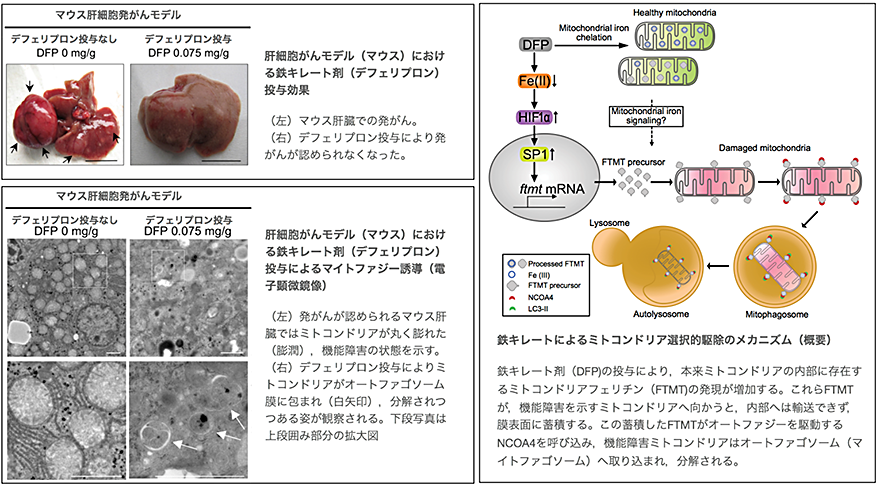
具体的には臨床で用いられている鉄キレート剤(ディフェリプロン)の投与により、障害されたミトコンドリアの選択的排除とそれによる酸化ストレスと肝発がんの抑制を確認しました(図左上、左下)。マイトファジーが誘導される際にはミトコンドリア内で鉄を蓄えると考えられているミトコンドリアフェリチン(FTMT)(注5)が、障害を受けたミトコンドリアの外膜に蓄積し、細胞質に存在するオートファジーレセプターであるNCOA4と相互作用することで障害ミトコンドリア選択的なマイトファジーが引き起こされることを初めて明らかにしました(図左)。これらの効果はマウスの肝発がんを抑制することを確認しました。FTMTの発現を人工的に抑制すると、マイトファジーの誘導や肝発がん抑制効果が失われることも確認しました。マイトファジーの分子機構を明らかにできたことは障害ミトコンドリアの蓄積を防ぎ、ミトコンドリアの機能を保つ治療標的分子の同定を可能にし、将来的にはミトコンドリア障害が病態形成に関わる疾患(代謝性疾患、神経変性疾患、がんなど)の創薬に繋がる可能性があると思われます。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の肝炎等克服実用化研究事業(肝炎等克服緊急対策研究事業)(代表:日野啓輔、18fk0210016)、科学研究費補助金(課題番号:26293179、16K09384、26870067、16K19047、23870008)の助成を受けて行われました。
発表内容
研究の背景
代謝性疾患、神経変性疾患、がんなどの疾患や加齢において、ミトコンドリアの機能障害が認められています。機能が低下したミトコンドリアは、酸化ストレスの発生源となり、細胞環境の増悪因子と考えられています。ヒトのミトコンドリア機能の完全性(品質)を維持する機構として、細胞内分解系のひとつであるオートファジーによる「障害ミトコンドリアの選択的排除(マイトファジー)」が存在し、マイトファジーの障害は上記疾患の発症・進展機構として注目されています。これまでに報告されてきたマイトファジーの誘導方法の多くは、ミトコンドリア自体の機能損傷を引き起こすため、臨床応用には不向きでした。一方、医薬品として使用されている鉄キレート剤によるマイトファジーの誘導は報告されていましたが、その分子機構は明らかではありませんでした。そこで研究グループでは鉄キレート剤による細胞内の鉄欠乏がどのようにマイトファジーを誘導し、これにより発がんが抑えられるか否かを検討しました。
研究の内容
本研究グループは、鉄キレート剤(ディフェリプロン)の投与により、マウス肝臓組織および肝がん由来培養細胞においてマイトファジーが誘導される際、ミトコンドリアフェリチン(FTMT)の発現が増強することを発見しました。このFTMTの発現誘導には、鉄キレート剤による転写因子HIF1αの増加とそれに引き続いて転写因子SP1の発現誘導が必須であることを見いだしました。発現誘導されたFTMTは膜電位の低下・消失した障害ミトコンドリアの外膜に蓄積し、細胞質に存在するオートファジーレセプターであるNCOA4と相互作用することで障害ミトコンドリア選択的なマイトファジーが引き起こされることを明らかにしました(図右)。FTMTとNCOA4の相互作用についてはそれぞれのタンパクが特異的に結合する部位についても同定しました。マイトファジーが誘導されることで活性酸素種(ROS)(注6)の産生は抑制され、肝細胞がんの発生が有意に抑制されました。さらに、FTMTの発現を人工的に抑制すると鉄キレート剤投与にもかかわらずROS産生抑制や肝発がん抑制効果が見られなくなることも確認しました。これまでにも鉄キレート剤による肝がん進展抑制についての報告はありましたが、本研究の成果は単に鉄キレート剤による酸化ストレスの軽減だけでなく、マイトファジーの誘導が障害ミトコンドリアの蓄積を抑制し肝発がん、進展抑制に有用であることを示唆するものだと考えられます。
今後の展開
本研究において、鉄欠乏によるマイトファジーの誘導ならびに肝発がん抑制にはミトコンドリアフェリチン(FTMT)の誘導が不可欠であることが明らかになりました。一方、FTMTの細胞増殖抑制効果やFTMTを強制的に発現させたマウスでの腫瘍増大抑制が報告されています。以上より、FTMTの発現を促進しうる化合物の検索はマイトファジーを誘導し、障害ミトコンドリアの蓄積を排除しうる薬剤の開発につながり、さらにはがんに対する新たな治療戦略になりうると考えられます。
C型肝炎ウイルス(HCV)の排除は直接作用型抗ウイルス剤により容易となりましたが、今なおHCV排除後の肝発がんは臨床的に重要な問題です。HCV排除後も肝組織において形態学的に異常なミトコンドリアが残存しているとの報告もあるため、障害ミトコンドリアの排除を促進するマイトファジーの誘導は新たな治療手段となりうるのではないかと期待されます。
発表雑誌
- 雑誌名
- EMBO Reports
- 論文タイトル
- Iron loss triggers mitophagy through induction of mitochondrial ferritin.
- 著者
- Yuichi Hara, Izumi Yanatori, Atsushi Tanaka*, Fumio Kishi, John J Lemasters, Sohji Nishina, Kyo Sasaki, Keisuke Hino*.
*:責任著者 - DOI番号
- 10.15252/embr.202050202
用語解説
- (注1)ミトコンドリア
- ヒトなどの真核生物の細胞のなかで細胞のエネルギーを作り出す小器官で、細胞内にはたくさんのミトコンドリアが存在します。
- (注2)オートファジー
- 細胞内の構成成分を分解する仕組みのひとつ。大隅良典博士が発見し、2016年にノーベル賞(生理学・医学)を受賞した。
- (注3)マイトファジー
- ミトコンドリアを選択的に分解するオートファジー。パーキンソン病など多くの疾患でマイトファジーの機能低下・障害が認められる。膜で隔離された障害ミトコンドリアはリソソームと融合して消化される。
- (注4)鉄キレート剤
- 化学的な構造で鉄と結合する薬剤。血漿中の過剰鉄の排除などを目的に投与する。
- (注5)ミトコンドリアフェリチン(FTMT)
- ミトコンドリアに存在する金属結合性タンパク質。ミトコンドリアフェリチンはタンパク質前駆体であり、ミトコンドリアに取り込まれて成熟タンパク質となり、フェロオキシダーゼ(2価鉄を3価鉄に酸化する)活性をもつ。
- (注6)活性酸素種
- 酸素分子がより反応性の高い化合物に変化したものの総称。酸化ストレスを引き起こす。
お問い合わせ先
研究について
川崎医科大学肝胆膵内科学
教授 日野 啓輔(ヒノ ケイスケ)
山形大学医学部メディカルサイエンス推進研究所
准教授 田中 敦(タナカ アツシ)
広報について
川崎医科大学庶務課
課長 浅沼 淳(アサヌマ ジュン)
山形大学医学部総務課庶務担当(秘書室)
今野 律子(コンノ リツコ)、遠田 詩帆(エンタ シホ)
AMED事業について
国立研究開発法人日本医療研究開発機構(AMED)
疾患基礎研究事業部 疾患基礎研究課