2020-10-13 理化学研究所
理化学研究所(理研)生命機能科学研究センター成長シグナル研究チーム(研究当時)の山田貴佑記テクニカルスタッフ、廣中謙一客員研究員、西村隆史チームリーダー、発生幾何研究チームの森下喜弘チームリーダーらの研究チームは、ハエでは成長期から成熟期への移行に伴って、飢餓ストレスに対する代謝応答が変化することを明らかにしました。
本研究成果は、栄養や温度といった環境変化に対する生理応答を生活史戦略の立場で理解するものであり、さまざまな生物のエネルギー代謝[1]の調節原理の解明や、発育ステージの移行に伴う代謝変化の理解に貢献すると期待できます。
生物は、一般的に飢餓になると貯蔵している栄養源を消費して生存しますが、個体が生まれてから死ぬまでの生活史[2]の中で、常にこうした消費戦略が採用されているのかは、分かっていませんでした。
今回、研究チームは、数理モデル解析によって、ハエでは成長期から成熟期への移行に伴い、貯蔵栄養の「消費」から「節約」に飢餓応答を切り替えることが、将来の生存や繁殖に関する適応度[3]を最大にする最適な戦略であることを明らかにしました。実際に、モデル生物であるキイロショウジョウバエ[4]を用いて、同様の最適戦略が採用されていることを発見しました。この「代謝リモデリング」は、成熟期に入ると増加するステロイドホルモン[5]の作用によって誘導されていることが分かりました。また、成熟期への移行に伴い、飢餓に応じて個体の運動や摂食行動も低下することから、将来の生存と繁殖を優先する体系的なエネルギー節約モードに切り替えていることが明らかになりしました。
本研究は、科学雑誌『Nature Metabolism』オンライン版(10月12日付:日本時間10月13日)に掲載されます。
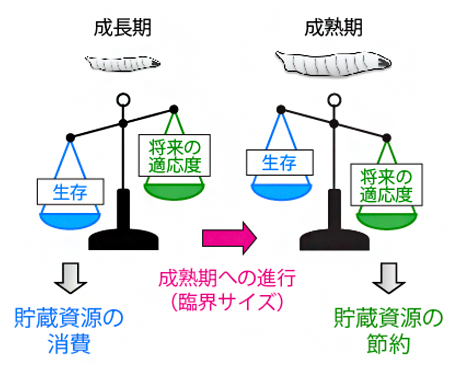
生活史戦略としての最適な飢餓応答
背景
ヒトを含め多細胞生物は、さまざまな発育ステージを経て性成熟した成体になります。それらのうち成長期から成熟期への移行には、ステロイドホルモンが重要な役割を果たします。ステロイドホルモンには、ヒトでは思春期を引き起こす性ホルモン、両生類では変態[6]を引き起こす甲状腺ホルモン、昆虫では変態を引き起こすエクジステロイド[7]などが挙げられます。これらのホルモンの分泌量は、幼体が「臨界サイズ」と呼ばれる特定の大きさに達したときに増加します。ヒトでは、ある程度の体重に達することや、貯蔵脂肪の蓄積が、思春期を誘導する引き金になるとされています。
臨界サイズに達してから実際に成長が停止するまでの期間は、ヒトでは思春期に当たり、他の動物では最終成長期(成熟期)などと呼ばれます。ショウジョウバエを含めた一部の昆虫では、栄養の摂取と個体成長に最適化された幼虫は、蛹期の変態を経ることで、飛翔能力と生殖機能を備えた成虫へと劇的に姿形が変化します(図1)。餌を食べて成長した幼虫は、3齢幼虫で臨界サイズに到達して成熟期に入ると、栄養状態とは関係なく、一定時間後に蛹になります。つまり、成熟期の開始時期を決める臨界サイズは、最終的な体サイズを決める重要な要因になっているといえます注1)。
通常、生物は栄養を摂取しエネルギーを産生することで生命活動を行います。同時に、余剰に摂取した栄養分は、貯蔵糖や貯蔵脂肪という形で貯蓄します。飢餓に遭遇すると、これらの貯蓄している栄養分を消費して、エネルギーを産生することで生存できます。同様に、ショウジョウバエの蛹は外部から栄養を摂取しないため、幼虫期に摂取して貯蓄した栄養分を計画的に用いて、変態を行う必要があります(図1)。よって、蛹になる前の幼虫が飢餓に遭遇すると、貯蔵栄養を消費して生存を優先するか、将来のために節約するか、という二つの相反する状態にあります。しかし、生活史の観点から、飢餓に対する最適な生理応答は何か、明らかになっていませんでした。
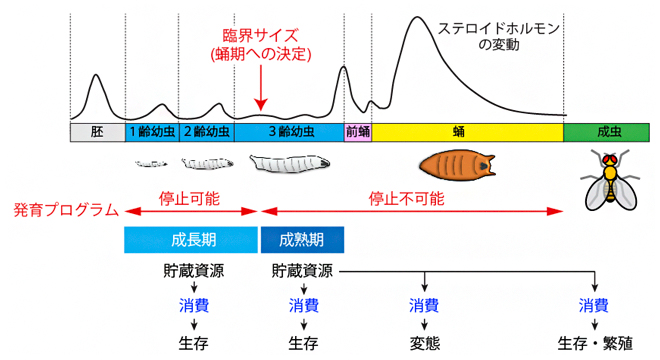
図1 ショウジョウバエの生活史と幼虫期に蓄えた貯蔵資源の使い道
ショウジョウバエの生活史は、胚、幼虫、蛹、成虫の4段階に区分される。幼虫期は臨界サイズを境に、成長期と成熟期に分けられる。ステロイドホルモンは、胚発生、脱皮、蛹化、変態など、一連の発育ステージの進行を誘導する。ステロイドホルモンの変動は、Riddiford, 1993を参考に模写した。
注1)2019年11月25日プレスリリース「サイズ進化の法則を発見」
研究手法と成果
研究チームはまず、最適制御理論[8]を用いて、確率的な飢餓に対する生理応答を予測する代謝数理モデルを作成しました。このモデルにおいて、臨界サイズに到達する前のハエの幼虫は、生存のみを目的としています。これに対して臨界サイズ通過後の幼虫は、生存に加えて蛹期や成虫期のために貯蔵資源を増やすことも目的としています。その結果、臨界サイズを通過する前は、飢餓に応じて貯蔵資源を消費することが最適な生存戦略であると予測されました。これは、多くの生物で観察される飢餓応答と一致しています。一方、臨界サイズを通過した後の幼虫では、貯蔵資源の消費から節約に切り替える飢餓応答が、将来の適応度を最大にする最適な戦略であると予測されました(図2A)。
この貯蔵資源を節約する戦略が最適である前提には、幼虫期に蓄えた貯蔵資源が多ければ多いほど、成虫の適応度は上昇するという条件が必要です。そこで、貯蔵資源の量と成虫の適応度の関係を、モデル生物のキイロショウジョウバエを用いて、実験的に検証しました。幼虫期の栄養条件を人為的に操作したところ、幼虫期に貯蓄される栄養資源は、蛹期の変態を経て羽化した成虫の飢餓耐性にも寄与することが分かりました(図2B)。よって、数理モデルで得られた「代謝リモデリング」が、実験下の幼虫においても最適な戦略である可能性が示されました。
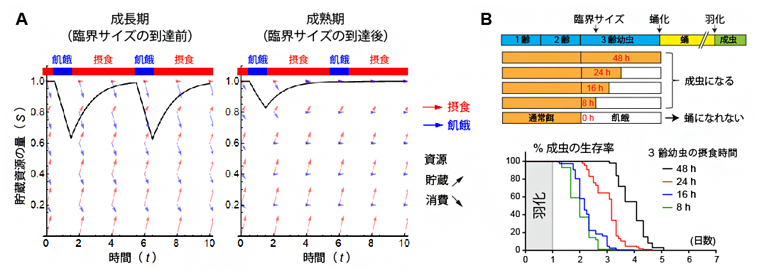
図2 数理モデルによる飢餓に対する代謝応答の予測
A)最適な飢餓応答の数理モデル。成長期では、飢餓になると摂食により貯蓄した資源を消費する。成熟期では、飢餓になっても貯蔵資源の消費を節約する。黒線は、貯蔵資源の量変化を示すシミュレーション結果。
B)幼虫の摂食時間と羽化後の成虫の飢餓耐性の関係。臨界サイズ通過後の幼虫の摂食時間が長いほど、羽化後の飢餓耐性期間が長い。
次に、飢餓応答が変化する貯蔵資源を探索するために、質量分析装置[9]を用いて網羅的にキイロショウジョウバエの代謝物の量変化を調べました。その結果、臨界サイズを通過しても、栄養状態にかかわらず量が変化しない代謝物を五つ突き止めました。そのうち三つは、非必須アミノ酸のチロシンなど、蛹化[10]に伴う外皮の硬化に関わる代謝物でした。残りの二つは、体液中を循環する血糖のトレハロース[11]とその前駆物質であるトレハロース-6リン酸でした(図3A)。
トレハロースは、加水分解されると2分子のグルコースになり、グルコースの供給源として機能します注2)。臨界サイズを通過する前の幼虫では、トレハロースを欠損すると、飢餓耐性が著しく低下するため注3)、飢餓でもトレハロースを消費しないことは一見矛盾した現象に思えます。しかし、トレハロースは蛹期の変態にも必須であるため注4)、臨界サイズを通過した後の幼虫は、将来のために、飢餓になってもトレハロースの消費を抑制する意義が大きいといえます。この結果は、数理モデルで予測される貯蔵資源を節約する戦略と一致します。
臨界サイズを通過する前の幼虫では、飢餓になると脂肪体[12]と呼ばれる組織に貯蔵されていた多糖グリコーゲンは速やかに分解され、血糖値の維持に機能します注5)。それに対して、臨界サイズを通過した後の幼虫において、トレハロースと同様に、高分子量の貯蔵栄養源も、飢餓応答の変化が起きているかどうかを調べました。各組織に貯蔵されているグリコーゲンと貯蔵脂肪(中性脂肪)を調べた結果、脂肪体のグリコーゲンと中性脂肪の分解が抑制されていることが明らかになりました(図3B)。一方、筋肉に貯蔵されているグリコーゲンや中腸に貯蔵されている中性脂肪は、臨界サイズを通過した後でも、通過する前と同様に飢餓に応じて分解されました。よって、体液中のトレハロースに加えて、貯蔵資源の節約は脂肪体に特異的であることが分かりました。
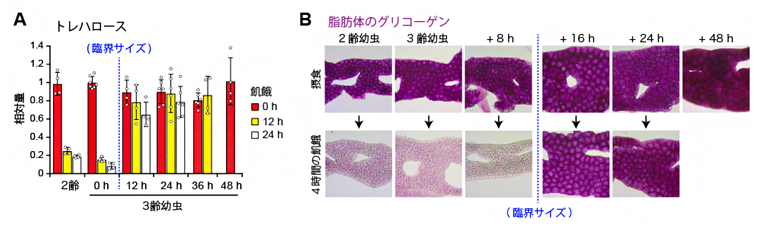
図3 飢餓に伴うトレハロースとグリコーゲンの量変化
A)体液中のトレハロース量の変化。臨界サイズを通過すると、飢餓になってもトレハロースの減少が抑制された。
B)脂肪体に貯蓄されたグリコーゲン量(紫)の変化。臨界サイズを通過すると、飢餓になってもグリコーゲンは消費されなくなる。時間経過は図2Bを参照。
さらに、トレハロースやグリコーゲンの消費が抑制される仕組みを調べました。その結果、臨界サイズを通過すると上昇するステロイドホルモンの作用で、トレハロースやグリコーゲンを分解する酵素の機能が抑制されていることが分かりました。研究チームは以前の研究で、蛹期になるとステロイドホルモンがトレハロース分解酵素の発現を誘導して、計画的なエネルギー供給を可能にしていることを明らかにしました注4)。よって、栄養環境が変動しても、臨界サイズを通過した後で機能するステロイドホルモンが、トレハロースの節約(蛹になる前の幼虫)と計画的な消費(蛹期)の両方を適切に指令することで、成虫までの確実な発育進行を可能にしていると考えられます。
ここまでの結果から、臨界サイズを通過した後では、ステロイドホルモンの作用で貯蔵栄養が節約されることが分かりました。では、貯蔵栄養の消費が抑制された状況で、幼虫はどのようにして飢餓でも生存を可能にしているのでしょうか。この問いに答えるため、臨界サイズを通過する前と後で、代謝活動を比較しました。その結果、臨界サイズを通過した後の幼虫では、代謝活動が低下していることが分かりました。また、臨界サイズを通過する前の幼虫は、飢餓になると運動量が上昇する個体がいるのに対して、通過後は運動量や摂食量が低下しました(図4A)。このことから、臨界サイズを通過した後の幼虫は、飢餓になると個体全体としてのエネルギー消費を抑制することで、必要な栄養資源を節約している、つまり、将来の生存と繁殖を優先する体系的なエネルギー節約モードに切り替えていると考えられます(図4B)。
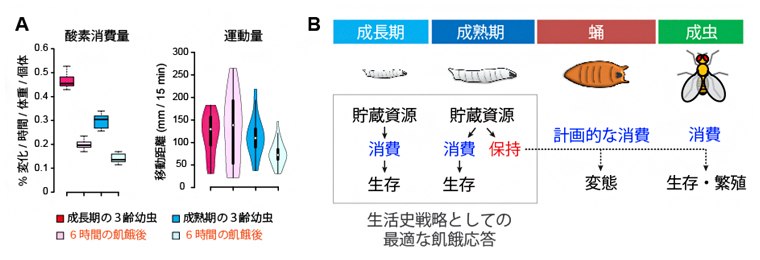
図4 消費エネルギーの節約
A)成長期と臨界サイズを通過した成熟期の酸素消費量と運動量。成長期と比べて、成熟期では摂食状態に関わらず、酸素消費量が低下した。成熟期では、飢餓になると運動量が低下した。
B)生活史戦略として最適な幼虫の飢餓応答モデル図。成熟期になると貯蔵資源の消費は節約され、保持された資源は、蛹期の変態や成虫期の生存や繁殖に使われる。
注2)2020年4月7日プレスリリース「器官サイズの左右差を抑制する仕組み」
注3)2016年8月24日CDBニュース「ショウジョウバエが低血糖になると?」
注4)2020年7月15日プレスリリース「発育ステージの移行に必要なエネルギー供給の仕組み」
注5)2018年3月16日CDBニュース「脂肪体のグリコーゲンは飢餓に対する最後の砦」
今後の期待
最適生活史モデルは、主に生態学の分野で使われており、投資に対して得られる利潤の価値を最大にする最適な戦略を予測する手法です。将来に向けた栄養資源の貯蓄は、思春期や妊娠前期、冬眠の低温順応期など、哺乳類を含め、さまざまな生物で観察される生命現象です。体外や体内の環境変化に対する代謝応答を予測する最適生活史モデルと実験的検証を組み合わせた本研究のアプローチは、多細胞生物の発育ステージの移行や代謝恒常性の理解に貢献できると考えられます。
補足説明
1.エネルギー代謝
生命活動に必要なエネルギー物質であるATPは、細胞内で常に産生と消費が同時に進行している。細胞内において、栄養素であるグルコース(ブドウ糖)などの物質を酸化してエネルギーが作り出される。このエネルギーの立場から見た物質の変換や利用をエネルギー代謝という。
2.生活史
生物が生まれて成長し、繁殖して死ぬまでの、一生にわたる全生活過程。ハエのような完全変態昆虫の場合、幼虫と成虫の生活様式は大きく異なっており、また脱皮や蛹期などにより生涯が区切られている。
3.適応度
生物の形質を一つの適応戦略と見なす最適生活史モデルでは、まず目的関数(何が最適かを決める物差し)を定める必要がある。これは一般的には、ダーウィンの自然選択説に基づいて、「その形質を持つ個体が生涯に残す子孫の数」とされ、適応度や繁殖成功度と呼ばれる。適応度に含まれる主な要素は、生存率と繁殖率である。
4.キイロショウジョウバエ
ハエ目ショウジョウバエ科の昆虫で、さまざまな研究分野でモデル生物として用いられている。体長2~3mm前後の大きさで、飼育が容易であり、遺伝学的な解析に優れた性質を持つ。
5.ステロイドホルモン
コレステロールから生合成され、化学構造的にステロイド核を持つホルモンの総称。一般に、細胞膜を通過して、細胞内で核内受容体に結合し、遺伝子の発現を制御する。
6.変態
動物がその発育過程において形態を著しく変化させること。変態とともに生活様式を変えることも多く、チョウに変態するイモムシや、カエルに変態するオタマジャクシなどはその典型である。
7.エクジステロイド
昆虫における主要なステロイドホルモンの総称で、エクダイソン(Ecdysone)はその中の一種である。前胸腺と呼ばれる内分泌器官で産生され、個体全体の成長や脱皮・変態の誘導をつかさどる。エクジステロイドは、核内受容体に結合し、一連の転写因子群の発現を制御することで機能を発揮する。
8.最適制御理論
時間変化する制御系において、目的関数を最小化(最大化)する制御を求める理論。機械の制御を目的とした工学分野で発達した理論だが、生物学においても最適生活史モデルの構築などにおいて応用される。
9.質量分析装置
試料に含まれる分子をイオン化し、その質量を測定する装置。微量な物質の定量が行える。
10.蛹化
ハエの場合、幼虫の外皮が硬化して前蛹になる。この過程を前蛹化(囲蛹殻形成)という。この硬化した外皮の内側で、真の蛹になる過程を蛹化と呼ぶ。この蛹化の過程で、成虫原基を中心に形態変化が行われ、成虫の姿が折り畳まれたような姿が形成される。昆虫によっては蛹室や繭を作り、その中で蛹化する。
11.トレハロース
グルコースが1,1-グリコシド結合してできた二糖。分解酵素により加水分解されると2分子のグルコースになる。多くの昆虫では、体液中の主要な糖である。ヒトは自身で合成できないが、グルコースに分解して消化吸収することはできる。
12.脂肪体
哺乳類の肝臓と脂肪組織に類似する昆虫の器官。中性脂肪や貯蔵糖を蓄積し、全身性の代謝機能を果たしているだけでなく、個体成長や免疫系を調節する内分泌器官でもある。
研究チーム
理化学研究所 生命機能科学研究センター
成長シグナル研究チーム(研究当時)
チームリーダー 西村 隆史(にしむら たかし)
(現 生命機能科学研究センター 形態形成シグナル研究チーム 上級研究員)
テクニカルスタッフ 山田 貴佑記(やまだ たかゆき)
客員研究員 廣中 謙一(ひろなか けんいち)
(現 東京大学 大学院理学系研究科 特任助教)
パートタイマー 羽原 興子(はばら おきこ)
発生幾何研究チーム
チームリーダー 森下 喜弘(もりした よしひろ)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究B「栄養環境の変化に対する適応戦略と成長・代謝制御機構の解析(研究代表者:西村隆史)」、同挑戦的研究(萌芽)「最適制御理論に基づく環境依存的な成長と代謝の調節機構に関するeco-devo研究(研究代表者:西村隆史)」による支援を受けて行われました。
原論文情報
Takayuki Yamada, Ken-Ichi Hironaka, Okiko Habara, Yoshihiro Morishita, Takashi Nishimura, “A developmental checkpoint directs metabolic remodeling as a strategy against starvation in Drosophila”, Nature Metabolism, 10.1038/s42255-020-00293-4
発表者
理化学研究所
生命機能科学研究センター 成長シグナル研究チーム(研究当時)
テクニカルスタッフ 山田 貴佑記(やまだ たかゆき)
客員研究員 廣中 謙一(ひろなか けんいち)
(現 東京大学 大学院理学系研究科 特任助教)
チームリーダー 西村 隆史(にしむら たかし)
(現 生命機能科学研究センター 形態形成シグナル研究チーム 上級研究員)
発生幾何研究チーム
チームリーダー 森下 喜弘(もりした よしひろ)
報道担当
理化学研究所 広報室 報道担当


