iPS/ES細胞を用いたハイスループットスクリーニングにより、中條・西村症候群の病態を改善する効果が期待できる化合物を見出すことに成功
2020-10-15 京都大学iPS細胞研究所
ポイント
- 中條-西村症候群(Nakajo-Nishimura syndrome: NNS)注1)は、慢性炎症と脂肪・筋萎縮を特徴とする遺伝性疾患で、未だ有効な特異的治療法がない。
- 以前作製に成功したiPS/ES細胞由来のNNS疾患モデルを用い、ハイスループットスクリーニング注2)(HTS)による網羅的な治療薬候補の探索を試みた。
- HTSによって見出されたヒストン脱アセチル化酵素注3)(HDAC)阻害剤CUDC-907は、NNSの患者さんで過剰に産生されるケモカイン注4)のMCP-1及びIP-10を効果的に抑制した。
1. 要旨
加瀨直也大学院生(京都大学CiRA臨床応用研究部門、大学院医学研究科)、齋藤 潤 准教授(京都大学CiRA同部門)らの研究グループは、iPS/ES細胞を用いたHTSにより、NNSの病態を改善する効果的な化合物の特定に成功しました。
この研究成果は、2020年月日に米国科学誌「STEM CELLS Translational Medicine」に掲載されました。
2. 研究の背景
NNSは、幼少期から発熱や発疹を繰り返す自己炎症性疾患注5)の一種であり、脂肪や筋肉の萎縮も併発する難病です。現行の治療は、発熱や発疹を抑えるためにステロイドが用いられていますが、これは脂肪や筋肉の萎縮には効果がなく、副作用も重篤であるため、有効な治療薬が望まれています。
研究グループは、以前にNNSの発症メカニズムの解明と有効な治療法開発のため、iPS/ES細胞を用いたNNS疾患モデルの作製に成功しました。(CiRAニュース 2018年5月4日)
今回、研究グループは既存の化合物の中からNNSの治療薬候補となる化合物を探索するため、網羅的に化合物を評価するHTSを、iPS/ES細胞由来のNNS疾患モデルにより行いました。
3. 研究結果
NNS患者さん由来iPS細胞によるNNS疾患モデルを用いて、5,821化合物をHTSにより評価しました。NNSの患者さんで過剰に産生されるMCP-1及びIP-10を効果的に抑制した化合物を”ヒット化合物” 注6)とし、さらにES細胞由来の疾患モデルを用いた再現性の確認や、細胞毒性が高い化合物を取り除くことにより、最終的に3種のHDAC阻害剤を”ヒット化合物”として特定することに成功しました。
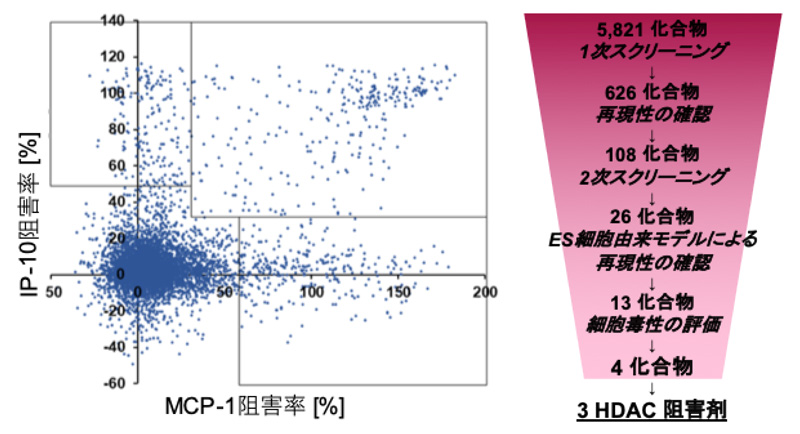
図1 HTSの結果
(左)1次スクリーニングの結果。四角の中が”ヒット化合物”
(右)スクリーニングの結果の概略図
(2)HDAC阻害剤CUDC-907は、過剰なMCP-1とIP-10の産生を効果的に抑制
研究グループは、スクリーニングにより得られた3つのHDAC阻害剤の中で、最も阻害効果の高いCUDC-907の効果を詳細に検討しました。患者さん由来iPS細胞によるNNS疾患モデル及び患者さん由来線維芽細胞に対しCUDC-907を処理したところ、患者さん由来の過剰なMCP-1及びIP-10の産生が効率的に抑制され、その産生量は健常レベルもしくはそれ以下にまで達しました。
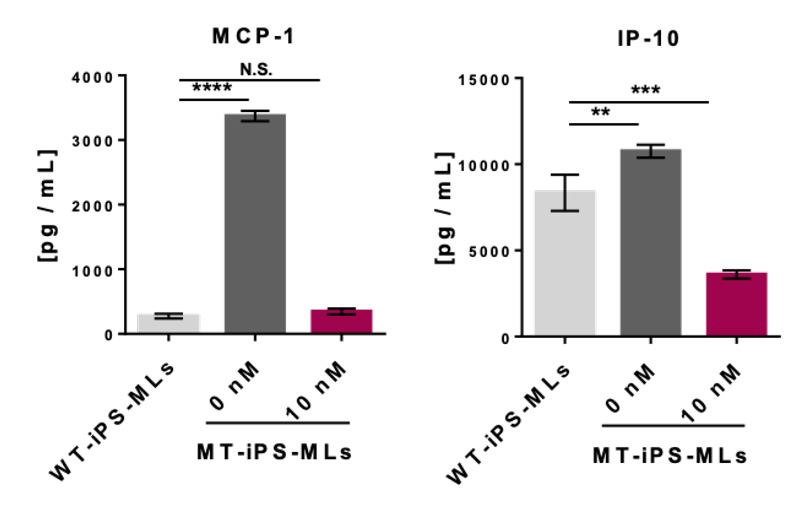
図2 iPS細胞由来疾患モデルに対するCUDC-907の阻害効果
健常細胞による産生量(グラフ内の左)に対し、疾患モデルによる過剰なMCP-1およびIP-10の産生量(グラフ内の中央)は、CUDC-907の処理によりその産生量が健常レベルもしくはそれ以下にまで達した。(グラフ内の右) (左)MCP-1の産生量 (右)IP-10の産生量
(3) HDAC阻害剤CUDC-907の細胞毒性
研究グループは、CUDC-907による副作用の可能性を確認するため、その細胞毒性を詳細に評価しました。CUDC-907を短期間(24時間)処理した細胞は、その細胞毒性はほとんど確認されませんでした。しかしながら、長期間(15日間)処理した細胞はその増殖が顕著に抑制されました。以上のことから、患者さんへの長期的なCUDC-907の投与は、副作用を生じる可能性が示唆されました。
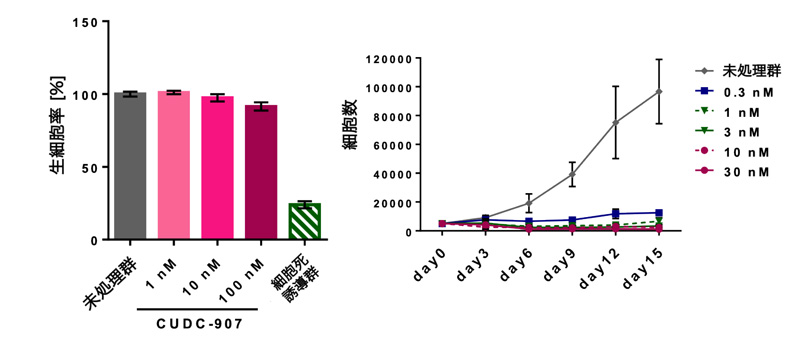
図3 CUDC-907処理による細胞毒性の評価
(左)CUDC-907を短期間(24時間)処理した後の細胞生存率。界面活性剤により細胞死を誘導すると生細胞率は顕著に低下するが(“細胞死誘導群”)、CUDC-907の処理では低下が見られなかった。
(右)CUDC-907を長期間(15日間)処理した時の細胞数の変動。未処理群の細胞は経日的に増殖するが、CUDC-907を処理した細胞はその増殖が抑制された。
(4) HDAC阻害剤CUDC-907は、MCP-1及びIP-10の転写後段階を阻害
最後に研究グループは、CUDC-907 がMCP-1及びIP-10の産生過程のうちどのポイントを阻害するのかを検討しました。疾患モデルにおけるMCP-1及びIP-10のmRNA発現量は、CUDC-907によりむしろ増加しましたが、翻訳されたタンパク質量は減少していました。以上のことから、CUDC-907が作用する段階は、少なくとも転写後であると明らかになりました。
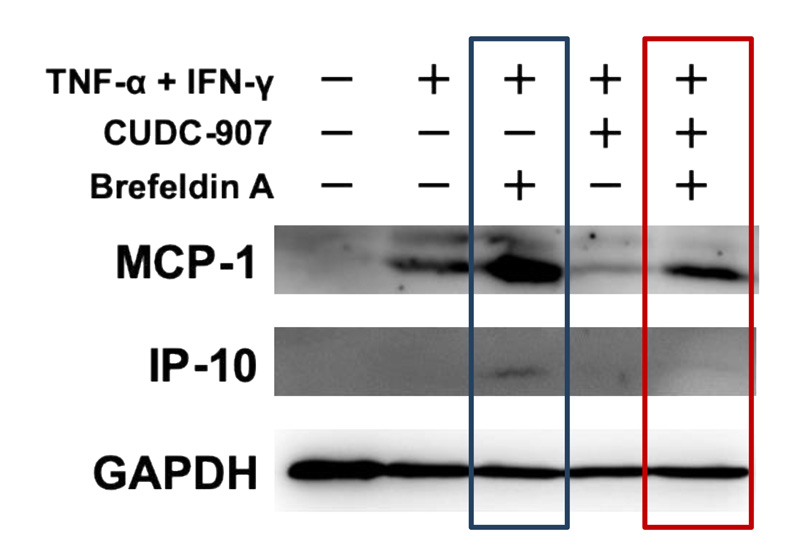
図4 CUDC-907による 細胞内MCP-1及びIP-10の減少
疾患モデルにおける細胞内のMCP-1とIP-10の量(図中の青四角)は、CUDC-907の処理により減少した。(図中の赤四角)
4. まとめ
本研究では、NNS患者さん由来iPS細胞によるNNS疾患モデルを用いHTSを行うことで、NNSの病態を効果的に改善する化合物を特定することができました。CUDC-907をNNS疾患モデルに処理すると、過剰なケモカインMCP-1及びIP-10の産生が健常レベルかそれ以下にまで抑制されました。また、CUDC-907の短期間の処理は細胞毒性を示しませんでしたが、長期間の処理は細胞の増殖を抑制し、副作用を生じる可能性が示唆されました。さらに、CUDC-907がMCP-1及びIP-10を阻害するポイントは、少なくとも転写後の段階であることが明らかとなりました。
CUDC-907は、本研究より副作用が生じる可能性が示唆されたため、直接治療薬として用いることは難しいと考えられますが、今後その阻害メカニズムが詳細に解明されることで、NNSに対する新たな治療戦略を見出すことが期待されます。また本研究では、自己炎症性疾患に対する治療薬候補の探索に、iPS/ES細胞を用いたHTSが有効な方法であると証明されたため、他の自己炎症性疾患への応用が期待されます。
5. 論文名と著者
- 論文名
Pluripotent Stem Cell-based Screening Identifies CUDC-907 as an Effective Compound for Restoring the in Vitro Phenotype of Nakajo-Nishimura Syndrome - ジャーナル名
STEM CELLS Translational Medicine - 著者
Naoya Kase1*, Madoka Terashima1, Akira Ohta2, Akira Niwa1, Fumiko Honda-Ozaki1,3, Yuri Kawasaki1, Tatsutoshi Nakahata2, Nobuo Kanazawa4 and Megumu K. Saito1**
* 筆頭著者
** 責任著者 - 著者の所属機関
- 京都大学 iPS細胞研究所 臨床応用研究部門
- 京都大学 iPS細胞研究所 基盤技術研究部門
- 東京医科歯科大学大学院 発生発達病態学分野
- 和歌山県立医科大学 医学部 皮膚科学講座
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 日本医療研究開発機構
- 和歌山県立医科大学
7. 用語説明
慢性反復性の炎症と進行性のやせ・消耗を特徴とする、特異な自己炎症疾患の一種であり、常染色体劣性遺伝性である。1939年の中條、1950年の西村らの報告以来、「凍瘡を合併する骨骨膜症」などの病名で、和歌山・泉南を中心とした関西と関東・東北から、これまでに30例ほどの報告がある。注2) ハイスループットスクリーニング(HTS)
大量の化合物を、ロボットなどの自動化技術により網羅的且つ効率的に評価する方法。注3) ヒストン脱アセチル化酵素(HDAC)
遺伝子発現の制御に必要な、ヒストンのアセチル化状態を脱アセチル化する酵素。この酵素の働きにより、様々な遺伝子の発現が制御を受け、細胞増殖やアポトーシスをはじめとする様々な細胞プロセスに影響を及ぼす。注4) ケモカイン
白血球の遊走を引き起こし、炎症の惹起に関与するタンパク質。
注5) 自己炎症性疾患
免疫系の以上により、周期的な発熱などの炎症症状が自然と生じる疾患。
注6) ヒット化合物
スクリーニングにおいて評価された化合物のうち、期待される効果を示した化合物。