骨粗鬆症やリウマチなど骨破壊性疾患の新たな治療法開発に期待
2020-12-08 東京大学,日本医療研究開発機構
発表者
塚崎雅之(東京大学大学院医学系研究科 病因・病理学専攻 免疫学講座 特任助教)
高柳広(東京大学大学院医学系研究科 病因・病理学専攻 免疫学講座 教授)
発表のポイント
- 破骨細胞(注1)は、古い骨を吸収することで骨の新陳代謝を担う重要な細胞ですが、その過剰な活性化は骨粗鬆症や関節リウマチ、歯周病、がん骨転移など、様々な疾患に伴う骨破壊の原因となります。今回我々は世界で初めて、破骨細胞が形成される仕組みを1細胞レベルで解き明かすことに成功しました。
- 破骨細胞の形成過程をシングルセル解析(注2)によって調べることで、ひとつひとつの細胞の全遺伝子発現情報を取得し、機械学習アルゴリズム(注3)により破骨細胞の分化経路と、それに伴う生物学的イベント及び分子プロファイルの挙動を予測しました。本予測が正しいことを、複数の遺伝子改変マウスを作成することにより証明しました。
- 本研究により、破骨細胞がつくられる仕組みの詳細がこれまでにない解像度で明らかになり、破骨細胞を抑制する薬剤を開発する上で重要となる新たな分子標的が同定されました。本成果は、破骨細胞が関与する様々な疾患の原因解明に資するのみならず、骨の破壊を防ぎ修復を促す新しい治療法の確立につながると期待されます。
発表概要
骨は私たちの身体を支え、運動を可能にするだけでなく、カルシウムなどミネラルの貯蔵庫としての役割、血液細胞を育てる造血器官としての役割など、多彩な機能を宿しており、脊椎動物の高度な生命制御システムを特徴付ける臓器です。骨の恒常性は、破骨細胞による骨の破壊と骨芽細胞(注4)による骨の形成の厳密なバランスにより維持されており、破骨細胞が古くなった骨を壊すことで常に新陳代謝を繰り返しています。生まれつき破骨細胞を欠損した人や、破骨細胞が正常に働かない人は、重篤な「大理石骨病」を発症し、古い骨が蓄積することで骨が脆くなり、その生命予後は極めて悪いことが知られています。破骨細胞は健康な骨を保つためになくてはならない重要な細胞ですが、一方で、破骨細胞が過剰に活性化してしまうと、骨粗鬆症、関節リウマチ、歯周病、がん骨転移といった様々な疾患に伴う病的骨破壊の原因になります。破骨細胞が関与する様々な疾患の病態を理解し、新しい治療法の開発を目指す上で、破骨細胞がつくられる仕組みの全容解明が喫緊の課題となりますが、その詳細なメカニズムに関しては未だ不明な点が多く残されていました。
東京大学大学院医学系研究科病因・病理学専攻免疫学分野の塚崎雅之特任助教と高柳広教授らの研究グループは、個々の細胞の遺伝子発現を網羅的に解析できる「シングルセル解析技術」を用いて破骨細胞の分化経路を詳細に解析し、コンピューターによる予測とマウス遺伝学による証明を組み合わせることで、破骨細胞がつくられる分子メカニズムの全容を1細胞レベルで明らかにしました。本研究成果は、骨代謝システムの基本原理の理解を深めると同時に、骨破壊性疾患の原因解明や治療法開発につながることが期待されます。
本研究は、日本学術振興会科学研究費補助金(15H05703、18H02919、19H03485、18K19438、19K18943、18J00744、18F18095)や、国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「生体組織の適応・修復機構の時空間的解析による生命現象の理解と医療技術シーズの創出」研究開発領域における研究開発課題「組織修復型免疫細胞の解明とその制御による疾患治療の開発」(研究開発代表者:高柳広)、免疫アレルギー疾患実用化研究事業「免疫疾患領域」病態解明研究(基礎的研究)における研究開発課題「関節リウマチの病原性間葉系細胞サブセットを標的とした骨破壊治療法の開発」(研究開発代表者:高柳広)などの支援を受けて行われました。
発表内容
研究の背景
骨は、破骨細胞による骨吸収と、骨芽細胞による骨形成によって生涯に亘り新陳代謝されることで恒常性が維持されています。骨は運動器の一部として働く一方で、免疫細胞の分化増殖の場となる一次リンパ組織としても機能する臓器であり、破骨細胞がつくられる仕組みの解明は、様々な骨疾患や免疫疾患の病態解明を目指す上で極めて重要な研究課題です。破骨細胞は血球系の細胞であり、その分化はRANKL(注5)というタンパク質によって誘導されます。1990年代後半に、骨髄細胞をRANKLで刺激することで破骨細胞を試験管内で誘導する培養系が確立され、破骨細胞生物学は格段の進歩を遂げました。この培養系に対してマイクロアレイやRNA-seqなどのトランスクリプトーム解析(注6)をおこない、破骨細胞の形成前と形成後の培養系に存在する細胞集団の遺伝子発現を比較することで、破骨細胞の分化や機能発現に重要な多くの遺伝子が発見されました。しかしながら、この培養系は雑多な集団を含んでおり、ごく一部の細胞しか破骨細胞へと分化できないことが知られていました(図1a)。従来のトランスクリプトーム解析方法では、培養系に含まれる全細胞の遺伝子発現の平均が検出されるため、破骨細胞形成前後の培養系に存在する細胞集団の遺伝子発現を比較しても、破骨細胞において非常に特異的に高発現する遺伝子以外は同定することが困難であり、転写調節因子のような発現レベルの低い遺伝子に関しては、重要な遺伝子であっても見逃されている可能性が考えられました。また、培養系に含まれる不均一な細胞集団の正体や、破骨細胞の詳細な分化経路とそれに伴う遺伝子発現変動の全容は不明でした。そこで私たちは、破骨細胞の分化経路を1細胞レベルで解析することで、破骨細胞の形成メカニズムを包括的に、詳細に解明することをめざして研究を始めました。
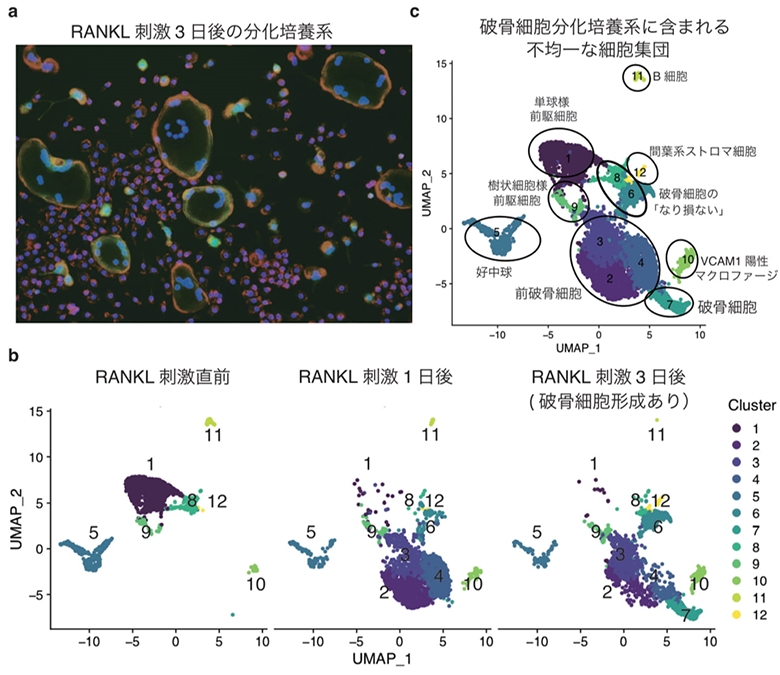
図1 シングルセル解析が明らかにした破骨細胞分化培養系に含まれる細胞の不均一性a.RANKL刺激3日後の破骨細胞分化培養系の様子。緑色はカテプシンK遺伝子の発現、赤色はアクチン(細胞骨格分子)、青色は細胞核を示す。緑色に光る多核の巨細胞が破骨細胞であるが、培養系に存在するほとんどの細胞は破骨細胞に分化していない。b.破骨細胞分化培養系の異なる3つのタイムポイントに対するシングルセル解析。3つのタイムポイントを合わせると、破骨細胞分化培養系に存在する細胞集団は合計12個のクラスターに分類された。c.破骨細胞分化培養系に含まれる不均一な細胞集団の実態。破骨細胞の分化培養系には、様々な段階の破骨細胞前駆細胞や、破骨細胞になり損なった集団、好中球や間葉系ストロマ細胞、B細胞といった破骨細胞への分化能を持たない集団など、多様な細胞種が混在していることが明らかとなった。
研究成果の概要
私たちはまず、破骨細胞の分化培養系に対してシングルセル解析をおこなう手法を開発しました。培養皿に強固に接着する破骨細胞やその前駆細胞を回収するために、コラーゲンでコートされた培養皿の上で骨髄細胞を培養し、RANKL刺激の直前、RANKL刺激1日後、RANKL刺激3日後(破骨細胞が生じるタイムポイント)の3つの異なるタイムポイントから合計7228個の細胞を単離し、シングルセルRNA-seq解析によりひとつひとつの細胞の全遺伝子発現情報を取得しました(図1b)。クラスタリング解析(注7)の結果、3つのタイムポイントには合計12種類のクラスター(細胞集団)が存在しており、破骨細胞の分化培養系には成熟した破骨細胞のほか、様々な段階の破骨細胞前駆細胞や、破骨細胞になり損なった集団、好中球や間葉系ストロマ細胞、B細胞など破骨細胞への分化能を持たない集団など、多様な細胞種が混在していることが明らかになりました(図1c)。
次に、得られた1細胞ごとの全遺伝子発現データを用いて、機械学習アルゴリズムによる細胞分化経路の予測をおこないました(図2a)。その結果、破骨細胞の分化経路として、Cluster 1(単球様前駆細胞)からCluster 9、3、2、4を経由してCluster 7(破骨細胞)へと分化してゆく多段階的なプロセスが予測されました。意外なことに、Cluster 1(単球様前駆細胞)の次のステージであるCluster 9は、免疫細胞の一種である「樹状細胞」と良く似た遺伝子発現パターンを有しており、破骨細胞はその分化過程で一過性に、樹状細胞関連遺伝子(細胞表面マーカーであるCD11cや、抗原提示に関わる遺伝子群など)を発現する可能性が示唆されました。これまで、樹状細胞の古典的な細胞表面マーカーであるCD11cを発現する細胞の一部が、試験管内で破骨細胞への分化能を有するという報告がある一方で、成熟した樹状細胞を欠損するようなマウスでも破骨細胞の数が減少しないことが報告されており、破骨細胞分化における樹状細胞の役割に関しては統一した見解が得られていませんでした。そこで私たちは、破骨細胞分化に必須の分子であるRANK(RANKLの受容体)を、Cluster 9(樹状細胞様前駆細胞)で特異的に除去したマウスを作成しました。当該マウスでは、破骨細胞の数が減少し骨量が顕著に増加することが明らかとなり、コンピューターにより予測された破骨細胞分化経路の生物学的妥当性が生体レベルで示されました(図2b)。また、破骨細胞前駆細胞が分化過程で一過的にCD11cを発現するという本知見により、過去の報告の矛盾(生体から回収したCD11c陽性細胞の一部が破骨細胞分化能を有する一方で、成熟した樹状細胞を欠損するマウスでも破骨細胞の数は減少しない)が解消される可能性が示されました。
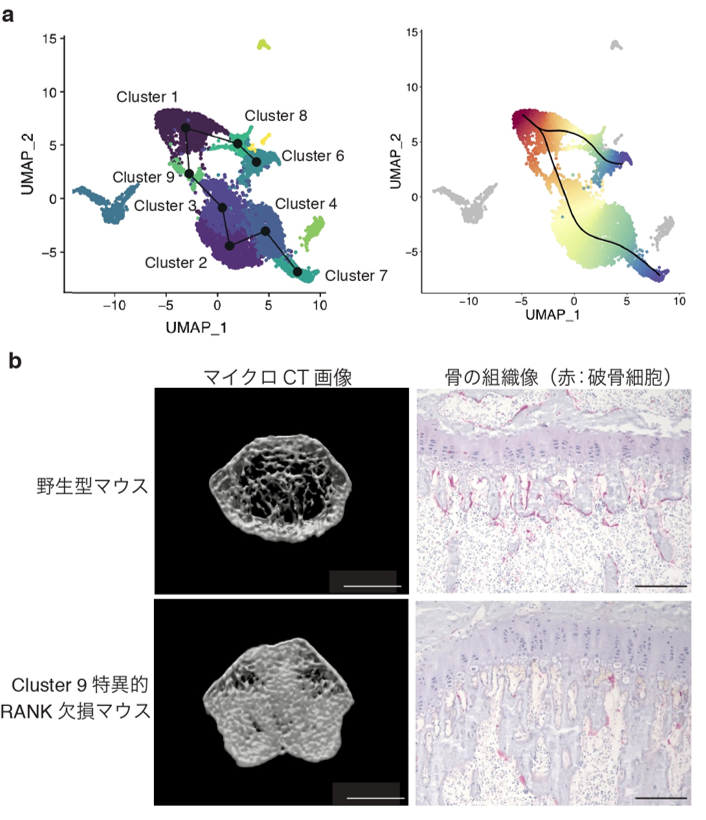
図2 破骨細胞分化における段階的な細胞運命決定経路a.シングルセル解析データと機械学習アルゴリズムによる、細胞分化経路の予測。Cluster 1からCluster 9、3、2、4を経由してCluster 7(成熟破骨細胞)へと分化して行く経路と、Cluster 8を経由してCluster 6へと分化し、破骨細胞になり損なうパターンの、2つの分化経路の存在が示唆された。b.破骨細胞分化に必須の分子であるRANKを、Cluster 9(樹状細胞様前駆細胞)で特異的に除去したマウスでは、破骨細胞の数が減少し骨量が増加した。
次に私たちは、破骨細胞の分化経路が進むことに伴い発現が顕著に変化する転写因子・転写調節因子を探索し、破骨細胞分化のマスター転写因子であるNfatc1と同じ発現変動パターンを示す因子として、Cited2を同定しました(図3a)。Cited2は造血幹細胞の恒常性維持や肝臓における糖新生に関わる転写調節因子ですが、破骨細胞における機能は未知でした。そこで私たちは、破骨細胞におけるCited2の機能を探索するために、破骨細胞前駆細胞で特異的にCited2を欠損するマウスを作成しました。当該マウスでは、試験管内および生体内において破骨細胞の数が減少しており、Cited2は破骨細胞分化において重要な役割をもつ可能性が示されました(図3b、c)。Cited2欠損細胞の遺伝子発現解析により、Cited2は破骨細胞の最終分化に必要な「細胞周期の停止」を促すことで、破骨細胞分化を制御することが示唆されました。実際に、破骨細胞前駆細胞特異的Cited2欠損マウス由来の骨髄細胞を用いた破骨細胞分化培養系では、細胞周期の停止した前破骨細胞の頻度が顕著に減少することが明らかとなりました(図3d)。本研究により、破骨細胞の運命決定を司る多段階的な分化プロセスの詳細が1細胞レベルで解明され、各ステージ間の進行が遺伝子レベルで厳密に制御されていることが明らかになりました(図3e)。
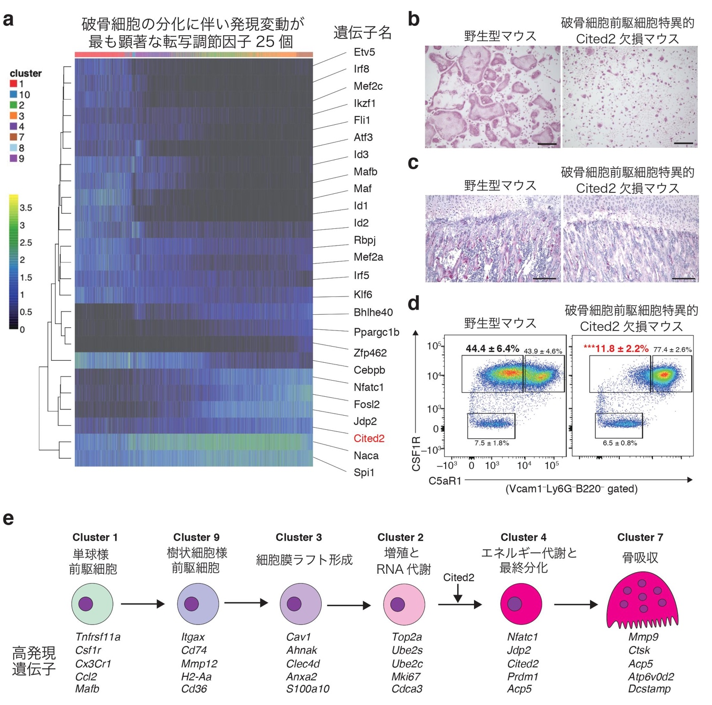
図3 破骨細胞の最終分化に必要な転写調節因子Cited2の同定a.破骨細胞の分化経路に伴い、発現変動が顕著に変化する転写因子・転写調節因子のリスト。破骨細胞分化のマスター転写因子であるNfatc1と同じ発現変動パターンを示す因子としてCited2を同定した。b、c.破骨細胞前駆細胞特異的Cited2欠損マウスは、試験管内bおよび生体内cにおいて破骨細胞の数が減少した。d.RANKL刺激後2日目の培養系に存在する細胞集団。破骨細胞前駆細胞特異的Cited2欠損マウスでは、野生型マウスと比較して、細胞周期の停止した前破骨細胞(CSF1R陽性C5aR1陰性の集団)の頻度が顕著に減少した。e.本研究により1細胞レベルで明らかとなった破骨細胞運命決定経路。破骨細胞は多段階的な分化プロセスにより形成され、各ステージの進行は遺伝子レベルで厳密に制御されている。
研究成果の意義
本成果において、破骨細胞の詳細な分化経路と、それに伴う遺伝子発現変動の全容が1細胞レベルで明らかになりました。また、細胞周期の停止を促すことで、破骨細胞の最終分化を制御する転写調節因子Cited2を同定しました。Cited2の発現レベルは破骨細胞においてそれほど高くなく、培養系に混在する好中球など他の細胞でも発現が認められるため、これまでのトランスクリプトーム解析技術では同定が困難な因子であったと考えられます。本研究により得られた破骨細胞分化経路のシングルセル解析データは、未知の破骨細胞制御因子を同定する上で重要なリソースとなり、骨恒常性を司る基本原理の解明や、破骨細胞を標的とした新たな骨疾患治療法の開発に大きく貢献すると期待されます。
発表雑誌
- 雑誌名
- Nature Metabolism
- 論文タイトル
- Stepwise cell fate decision pathways during osteoclastogenesis at single-cell resolution
- 著者
- Masayuki Tsukasaki, Nam Cong-Nhat Huynh, Kazuo Okamoto, Ryunosuke Muro, Asuka Terashima, Yoshitaka Kurikawa, Noriko Komatsu, Warunee Pluemsakunthai, Takeshi Nitta, Takaya Abe, Hiroshi Kiyonari, Tadashi Okamura, Mashito Sakai, Toshiya Matsukawa, Michihiro Matsumoto, Yasuhiro Kobayashi, Josef M. Penninger and Hiroshi Takayanagi
- DOI番号
- 10.1038/s42255-020-00318-y
- アブストラクトURL
- https://www.nature.com/articles/s42255-020-00318-y
用語解説
- (注1)破骨細胞
- 単球/マクロファージ系前駆細胞由来の多核巨細胞であり、生体において骨吸収を担う唯一の細胞。骨表面に強固に接着し、カテプシンKやマトリックスメタロプロテアーゼなどのタンパク分解酵素と、酸を放出することで骨基質を分解する。
- (注2)シングルセル解析
- ひとつの細胞に含まれるメッセンジャーRNAから逆転写反応によりcDNAを作成し、増幅したあとに次世代シークエンサーにより読み取ることで、ひとつの細胞における全遺伝子の発現量を定量的に解析する手法。
- (注3)機械学習アルゴリズム
- 人工知能技術の一つで、大量のデータをもとに事柄のグループ分けなどの作業をコンピューター上でおこなう方法。本研究では、シングルセル解析から得られた7228個の細胞ひとつひとつの全遺伝子発現データをもとに、細胞がどのように変化したかを予測するアルゴリズムを用いて、破骨細胞の分化経路とそれに伴う生物学的イベント及び分子プロファイルの挙動を予測した。
- (注4)骨芽細胞
- 骨の形成を担う間葉系の細胞。骨基質表面でI型コラーゲンなどの骨基質タンパク質からなる類骨を形成し、基質小胞とアルカリフォスフォターゼを分泌することで類骨の石灰化を促すことで骨を形成する。
- (注5)RANKL
- Receptor activator of NF-kB ligandの略で、破骨細胞の分化を誘導するタンパク質であり、生体内における破骨細胞形成に必須の役割を持つ。骨組織においては、骨芽細胞や骨細胞(骨に埋没した骨芽細胞の最終分化形態)がRANKLを産生することで、破骨細胞の形成を支持する。
- (注6)マイクロアレイやRNA-seqなどのトランスクリプトーム解析
- シングルセル解析(注2)とは異なり、細胞集団における全遺伝子の発現量を定量的に解析する手法。ひとつひとつの細胞における遺伝子発現レベルは解析できず、遺伝子発現量は解析に用いた全細胞の平均値として検出される。
- (注7)クラスタリング解析
- シングルセル解析(注2)により得られた1細胞ごとの遺伝子発現データの特徴を保持したまま、高次元から2次元への次元削減を行うことにより、同じ特徴を持つ細胞集団をクラスターとして平面上に可視化する解析方法。
お問い合わせ先
東京大学大学院医学系研究科 病因・病理学専攻 免疫学講座
教授 高柳広(たかやなぎひろし)
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
シーズ開発・研究基盤事業部 革新的先端研究開発課
疾患基礎研究事業部 疾患基礎研究課
免疫アレルギー疾患実用化研究事業