2020-12-09 東京大学
冨樫 和也(研究当時:生物科学専攻 助教)
辻 真人(生物科学専攻 助教)
竹内 俊佑(生物科学専攻 博士課程3年)
中浜 諒太(生物科学専攻 博士課程1年)
榎本 和生(生物科学専攻 教授/ニューロインテリジェンス国際研究機構 副機構長・主任研究者)
発表のポイント
- アデノ随伴ウイルス(AAV)ベクター(注1) を用いて、マウス嗅覚回路の単一ニューロン(注2) を効率よく可視化できる手法を新たに開発した。
- マウス嗅覚回路の発達過程を可視化して詳細な解析を行い、従来は出生後に起きるとされていた樹状突起(注3) の再編が、すでに胎児期から起きていることを明らかにした。
- 今回確立した脳内単一ニューロン標識法を利用することにより、マウス脳神経回路の発達過程を詳細に可視化し定量的に解析するが可能となり、その分子細胞メカニズムを生体脳レベルで解明することが可能となった。
発表概要
我々ヒトの含めた動物の脳神経回路は、胎児期に大まかな回路構造が作られますが、この初期回路は機能的に未熟な状態にあり、細かい情報処理がうまく出来ません。その後、脳神経回路の自発的な活動や外部からの感覚入力に基づいてネットワークが再編されることにより、機能的な情報処理回路へと成熟すると考えられています。哺乳類の嗅覚回路も例外ではなく、発達過程において神経回路の再編を経て、細かい嗅覚情報を適切に処理できる機能的な回路へと成熟すると考えられています。しかし、生体脳内において嗅覚回路再編を簡便に可視化する技術がなかったために、限られた数の固定標本データに基づいて嗅覚回路の再編モデルが提唱されていました。
東京大学大学院理学系研究科の冨樫和也助教(研究当時)、辻真人助教、竹内俊佑大学院生、中浜涼太大学院生、榎本和生教授らは、アデノ随伴ウイルス(AAV)ベクターを用いて、生体マウス嗅覚神経回路の単一ニューロンを高効率かつ高解像度で解析するための標識手法を開発しました。さらにこの手法を用いて、マウス嗅覚回路を構成するニューロンの発達過程を定量的に解析した結果、従来は出生後に起きるとされていた神経回路再編が、すでに胎児期に起きていることを明らかにしました。本研究により確立されたAAVベクターによる単一ニューロン標識法は、複雑な哺乳類の脳神経回路の発達や機能の仕組みを生体脳レベルで理解するために大きく貢献することが期待されます。
発表内容
我々ヒト脳の構造基盤は、1000 億個のニューロンが軸索と樹状突起という2つの構造的・機能的に異なる神経突起を介して構築するネットワークです。ヒト脳の神経ネットワークは胎児期後期から始まる発生過程において大まかなネットワークが構築されますが、この初期ネットワークは、情報処理の能力や効率が不十分であり、情報処理機能が未熟な状態です。その後、脳神経回路の自発的な活動や外部からの感覚入力に基づいてネットワークが再編されることにより、機能的な情報処理回路へと成熟すると考えられています。この発達期の脳神経回路再編は、主として新生児期に起きると考えられていますが、脳神経回路の再編過程を新生児脳内で可視化する技術が限られているために、実際にどのようなステップを経て再編が起きるのかという点については理解が遅れていました。
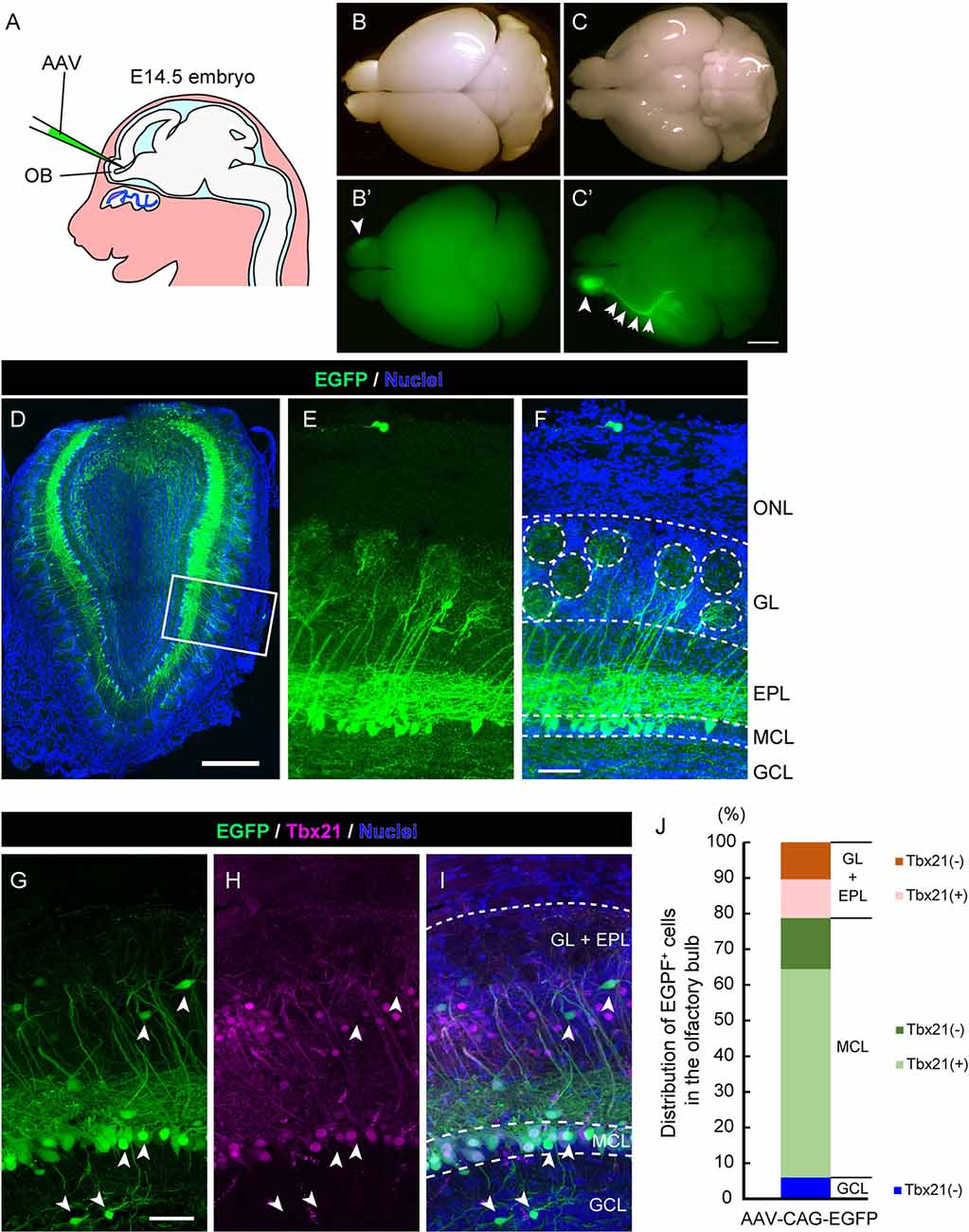
東京大学大学院理学系研究科の冨樫和也助教、辻真人助教、榎本和生教授らの研究グループは、アデノ随伴ウイルス(AAV)ベクターを用いて、マウス生体脳内の単一ニューロンを高効率かつ微細構造に至るまで可視化できる技術を開発しました。AAVベクターは、増殖・非増殖細胞いずれにも感染可能であり、ニューロンにも効率よく感染して長期間の遺伝子発現誘導が可能であることから、近年では脳神経回路の標識や操作に使われています。研究グループは、異なる種類のAAVベクターを複数検討し、さらにマウス胎児脳内への注入方法や注入時期について精査した結果、特定の発生時期のマウス胎児脳にAAVベクターを注入すると、マウス嗅覚二次ニューロンである僧房細胞(注4)を高効率に標識できることを発見しました(図1)。さらに、Creリコンビナーゼ(注5)による発現制御システムと組み合わせることにより、単一のマウス僧房細胞を高効率に可視化できる技術を開発しました(図2)。
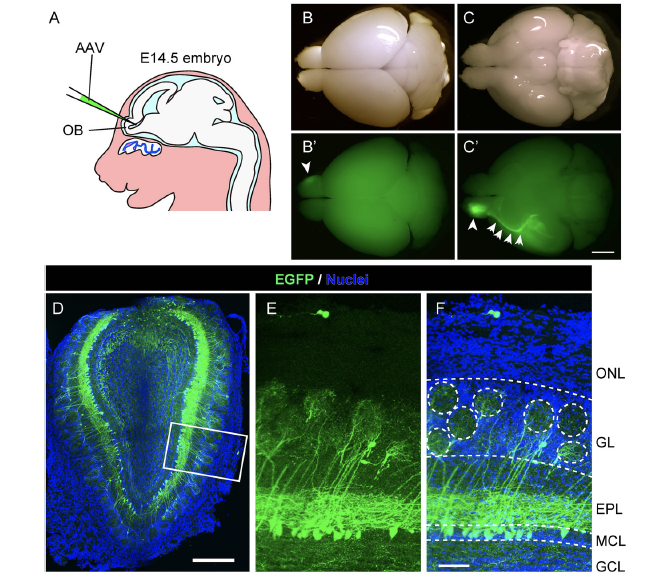
図1:アデノ随伴ウイルス(AAV)ベクターによるマウス嗅覚二次ニューロンの可視化
GFP遺伝子を組み込んだAAVベクターを胎児期のマウスの脳室に注入することにより(A)、マウス嗅覚二次ニューロンが簡便かつ高効率に標識できることが分かった。ウイルス注入したマウス脳を観察すると、嗅覚に次ニューロンの細胞体と軸索経路に特異的なGFPシグナルが観察され(B、C)、脳切片を作って詳しく観察すると、GFPにより標識されているニューロンのうちの80%以上が、臭球(GL)へと樹状突起を伸ばしている嗅覚二次ニューロンであることがわかる(D-F)。
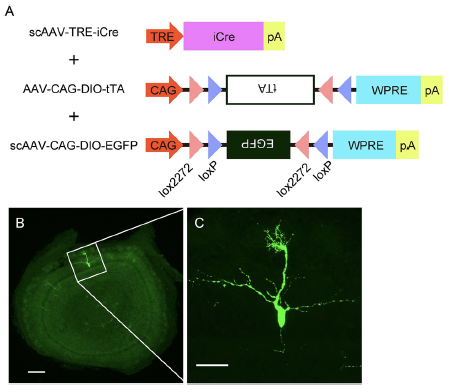
図2:マウス嗅覚回路の単一ニューロン可視化
AAVベクターとCreリコンビナーゼを組み合わせることにより、マウス嗅覚回路の二次ニューロン(僧房細胞)1個のみを高効率で可視化できるようになった。
よく研究されているマウス視覚神経回路では、出生後に始まる視覚入力により神経回路の再編が促進されることが示されています。従来、マウス嗅覚回路も、視覚回路と同様に、出生後に始まる嗅覚入力により神経回路の再編がトリガーされると信じられていました。今回研究グループが開発した可視化手法を用いて、マウス嗅覚回路の僧房細胞の樹状突起再編を定量的に解析したところ、胎児期においてすでに50%以上の僧房細胞が樹状突起の再編を完了していることが明らかになりました。従って、嗅覚回路は、視覚回路とは異なるメカニズムにより再編が制御されている可能性が示唆されました(図3)。
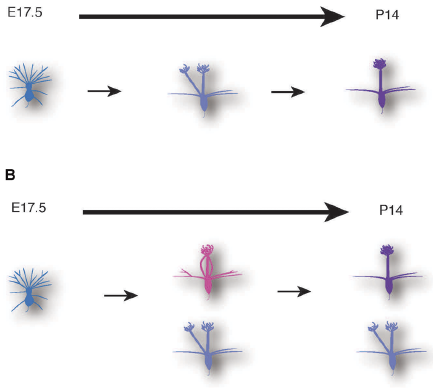
図3:今回の研究から明らかになった僧房細胞(マウス嗅覚二次ニューロン)の樹状突起再編
従来のモデルでは、僧房細胞は胎児期に複数の樹状突起を形成するが、発生後の1週間で樹状突起の刈り込みが進行し、最終的に一本の樹状突起のみを使って神経回路を作ると考えられていた(上図)。今回の研究から、樹状突起の刈り込みは、すでに胎児期から始まっており、5半分以上の僧房細胞は胎児期に樹状突起再編を完了していることがわかった。さらに、成獣の脳にも複数の樹状突起を持つ僧房細胞が10%程度は存在することを発見した。
本研究において、マウス嗅覚ニューロンの高効率かつ高解像度の標識手法が確立されたことから、今後ライブイメージング法などを用いて、樹状突起再編のさらに詳細な仕組みが解明されることが期待されます。今回開発されたAAVベクター発現法を用いることにより、脳内の単一ニューロンにおいて特定遺伝子のノックダウン・ノックアウトや光遺伝学ツールを簡便に発現させることが可能となり、ニューロンや神経回路の機能解析にも広く応用可能であると考えられます。
発表雑誌
- 雑誌名
Frontiers in Cellular Neuroscience論文タイトル
Adeno-associated virus-mediated single cell labeling of mitral cells in the mouse olfactory bulb: Insights into the developmental dynamics of dendrite remodeling.著者
Kazuya Togashi, Masato Tsuji, Shunsuke Takeuchi, Ryota Nakahama, Hiroyuki Koizumi & Kazuo Emoto*DOI番号
10.3389/fncel.2020.572256アブストURL
 Frontiers | Adeno-Associated Virus-Mediated Single-Cell Labeling of Mitral Cells in the Mouse Olfactory Bulb: Insights into the Developmental Dynamics of Dendrite RemodelingNeurons typically remodel axons/dendrites for functional refinement of neural circuits in the developing brain. Mitral c...
Frontiers | Adeno-Associated Virus-Mediated Single-Cell Labeling of Mitral Cells in the Mouse Olfactory Bulb: Insights into the Developmental Dynamics of Dendrite RemodelingNeurons typically remodel axons/dendrites for functional refinement of neural circuits in the developing brain. Mitral c...
用語解説
注1 アデノ随伴ウイルスベクター
パルボウイルス科の一本鎖DNAウイルスであり、非病原性であることから、それに由来するAAVベクターは安全性が高い遺伝子操作ツールとして認識されている。さらにAAVベクターは増殖・非増殖細胞いずれにも感染可能であり、分化後ニューロンにも効率よく感染して長期間の遺伝子発現誘導が可能であることから、近年では脳神経回路の標識や操作に使われることが多い。
注2 ニューロン
脳神経ネットワークを構成する細胞をニューロンと呼ぶ。ヒト脳では1000億個、マウス脳で1億個、ショウジョウバエで10万個のニューロンが存在すると考えられている。
注3 樹状突起
ニューロンは、構造的・機能的に異なる軸索と樹状突起という2つの神経突起を介してネットワークを作る。樹状突起は、主として他のニューロンや受容器から情報を入力するための突起である。
注4 僧房細胞
哺乳類の嗅覚神経回路の中で、嗅覚受容ニューロンからの情報を受けとる二次ニューロンの一種であり、受け取った情報を高次脳へとリレーする役目を持つ。
注5 Creリコンビナーゼ
染色体上の特定の塩基配列(loxP配列と呼ばれる)を認識して、切断・組み換えする酵素。ニューロンや脳組織に時期特定な遺伝子発現もしくは遺伝子ノックアウトを行うときに用いられる。