2020-12-24 理化学研究所,九州大学
理化学研究所(理研)開拓研究本部袖岡有機合成化学研究室の平井剛専任研究員(研究当時。現 客員研究員、九州大学大学院薬学研究院教授)、加藤麻理依研修生(研究当時)、袖岡幹子主任研究員、理研環境資源科学研究センター技術基盤部門分子構造解析ユニットの越野広雪ユニットリーダーらの共同研究グループは、細胞の機能に深く関与するスフィンゴ糖脂質[1]の一種ガングリオシド[2]GM3[2]のアナログ(類似化合物)の開発に成功しました。開発したアナログは、GM3と物性・構造がほぼ同じでありながら、生体内の酵素に分解されない性質を持ち、さらにGM3よりも高い生物活性を示しました。
本研究成果は、糖鎖(複合糖質)の機能解明や中分子創薬研究に貢献すると期待できます。
糖鎖は、生体内で酵素の働きにより分解・再構築(代謝)されることから、機能が変化しやすく、それが糖鎖機能を解明する際の障壁となっていました。
今回、共同研究グループは、GM3のグリコシド結合[3]の酸素原子(O)を炭素原子(C)に置き換え、さらにフッ素原子(F)を一つ配置したCHF連結型(R体とS体[4]の異性体が存在)を含む4種のアナログを有機合成し、がん細胞増殖効果に関する生物活性を比較しました。その結果、CHF連結型アナログが高い活性を示し、特にS体アナログはGM3の約1.6倍の活性を持つことが分かりました。さらに、S体アナログはGM3の活性配座[5]の一つに制御されており、分解耐性との相乗効果により生物活性が増強されていることを確認しました。
本研究は、科学雑誌『JACS Au』の掲載に先立ち、オンライン版(12月24日付:日本時間12月24日)に掲載されます。
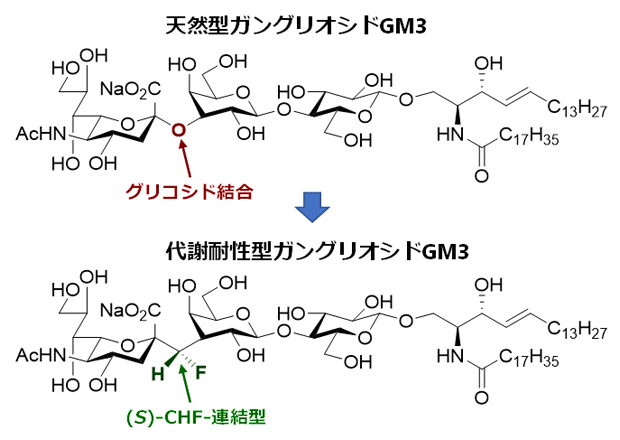
開発したガングリオシドGM3の(S)-CHF連結型アナログの構造式
背景
スフィンゴ糖脂質の一種であるガングリオシドは、細胞の分化・増殖、細胞間ネットワークなどに関わっている重要な膜構成要素です。その一種であるGM3は、上皮成長因子受容体(EGFR)に結合してその自己リン酸化を抑制し、細胞増殖を負に制御していることが知られています。近年GM3は、マイクロドメインと呼ばれる細胞膜上の微小な領域でさまざまなシグナル分子と集合体を形成し、細胞内外での情報伝達に深く関与していることも示唆されています。このことから、GM3のマイクロドメインにおける機能の解明が期待されており、それにはGM3の結合タンパク質の同定・解析が鍵を握ると考えられます。
しかし、生体内にはGM3の末端シアル酸[6]を切断するシアリダーゼという酵素が存在し、その働きによって分解されたGM3は機能の異なる別の糖脂質(ラクトシルセラミド)に変換されてしまいます。そこで、シアリダーゼに分解されないシアリダーゼ耐性型のGM3アナログ(類似化合物)が開発できれば、生物活性を維持できる分子ツールとなり、GM3の機能解析やマイクロドメインの実態解明に利用できると期待されていました。
目的のアナログを創製する方法の一つは、シアリダーゼが切断するグルコシド結合の酸素原子(O)を別の原子(X)に置き換えることです(図1)。ここでアナログは、生体内では「ホンモノのGM3と同じ振る舞い」をしつつ、シアリダーゼには分解されない”GM3もどき”である必要があります。これまでは、主にXを硫黄原子(S)としたアナログが研究されてきましたが、原子サイズがOと異なるため、元のGM3構造とはやや異なるものになってしまうという問題点がありました。一方、Xを炭素原子(C)にすれば、構造は似通うものの、合成が容易ではありません。また、Oが持つ性質を単純なメチレン(CH2)基で再現するのは、電子的な性質を考慮すると不可能だと想定されます。
このことから、Xとして適切なものを決めるには、合成難易度の高いC連結型アナログを数種類調製し、その機能を比較する必要があり、これまでほとんど実験的な知見が蓄積されていませんでした。
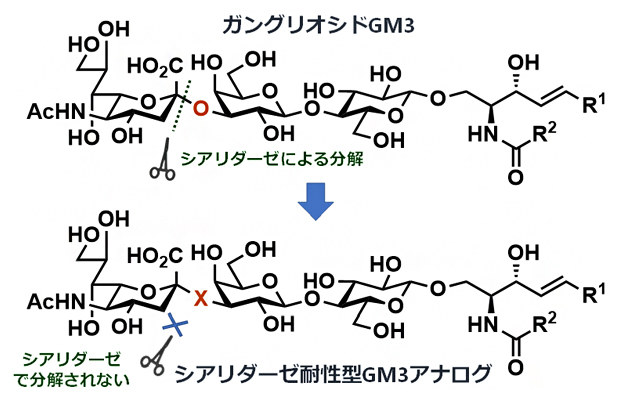
図1 シアリダーゼに分解されないGM3アナログの設計
生体内でガングリオシドGM3の末端シアル酸は、酵素シアリダーゼによって切断される。グルコシド結合の酸素原子(O)を別の他の原子(X)で置換することで、シアリダーゼによって切断されないシアリダーゼ耐性型のGM3アナログを設計する必要がある。
研究手法と成果
共同研究グループは、GM3が正しく機能するには、GM3の酸性度とグリコシド結合で制御される立体配座[5]が重要であるという仮説を立てました。この仮説を唯一満たせるアナログとして、生体内で分解されるGM3のグリコシド結合のOをCに置き換え、さらにフッ素原子(F)を一つ配置したCHF連結型アナログを設計しました。
仮説が正しければ、CHF連結型アナログは、酸性度が異なるCH2連結型アナログや立体配座が異なるCF2連結型アナログよりも、GM3本来の生物活性を強く示すはずです。また、シアル酸のグリコシド結合では、二つの安定な立体配座があるといわれています。CHF連結型アナログには、CHF基の立体化学による異性体(R体とS体)が存在し、それらはそれぞれシアル酸のグリコシド結合のどちらか一方の安定配座と同じ配座を持つと想定できます。もしその配座のいずれかが活性配座であれば、どちらか一方がより生物活性が高いことになります。
そこで、4種のC連結型アナログを全て有機合成で調製し、生物活性評価と立体配座解析によって、CHF連結型アナログの有用性を検証することにしました。そして、合成手法の最適化を繰り返し、最終的にGM3のC連結型アナログを4種合成することに成功しました(図2)。
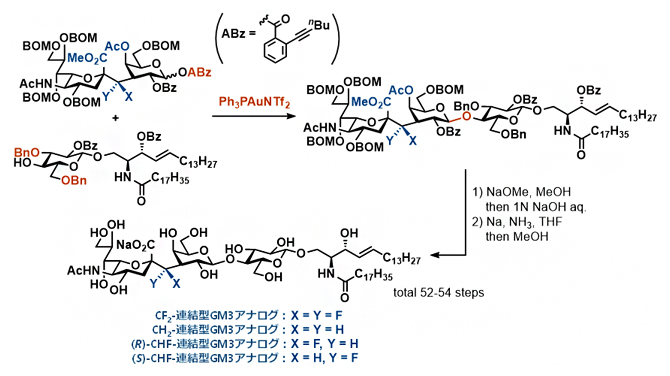
図2 4種の炭素連結型GM3アナログの合成
CH2連結型アナログ、CF2連結型アナログ、R体CHF連結型アナログ、S体CHF連結型アナログの4種の炭素連結型GM3アナログを、合計52?54工程で合成することに成功した。
GM3は、マウス由来のがん細胞であるHad-1細胞の増殖を促進しますが、合成した4種のC連結型アナログも、天然型GM3と同様に増殖促進効果を示しました。アナログには代謝耐性があるため、本来は全てのアナログが天然型よりも活性が高いと想定していましたが、CH2連結型アナログやCF2連結型アナログは天然型と同等の活性しか示しませんでした。これは、(元のグリコシド結合の)連結部が適切でないため、GM3としての活性が低下している可能性が考えられます。一方、CHF連結型アナログは仮説通り、GM3よりも高い増殖促進活性を示し、中でもS体のCHF連結型アナログがGM3の増殖促進活性よりも約1.6倍も高い活性を持つことが分かりました。
さらに、核磁気共鳴(NMR)法[7]と計算化学による立体配座解析の結果、S体のCHF連結型アナログは想定されるGM3の活性配座の一つに制御されており、分解耐性との相乗効果により、より良いアナログとなっていることを突き止めました。
今後の期待
今回開発した、GM3のバッタモン(偽物)は、生体内でも分解されないだけでなく、GM3の活性配座を制御できる”高機能型GM3もどき”になっていることが新たに分かりました。
今後、糖質アナログ開発を進める上で、「CHF基を利用する」という手法を普及させるには、さまざまな糖鎖、複合糖質で同様の研究を進め、実施例を増やしていく必要があります。分解されない糖質アナログが生体でどのような機能を発揮するのかを検証することで、中分子創薬の新たな様式となると期待できます。
補足説明
1.スフィンゴ糖脂質
脂質の一種であるセラミドを基本構造に持つ脂質群(スフィンゴ脂質)のうち、糖修飾されたものを指す。主に細胞外膜に存在し、さまざまなタンパク質およびコレステロールと相互作用することで、細胞機能に関与していることが知られている。
2.ガングリオシド、GM3
スフィンゴ糖脂質のうち、糖鎖部位にシアル酸を持つものをガングリオシドと呼ぶ。GM3は、シアル酸-ガラクトース-グルコース-セラミドの構造を持つ最も単純なガングリオシドの一つである。細胞の増殖・分化・運動性に重要であり、がん・糖尿病・視覚機能などとの関連が示唆されている。
3.グリコシド結合
通常、糖は環内にある酸素原子(O)の隣に水酸基(-OH)を持ち、別の糖のそれ以外の水酸基と脱水縮合して、糖と糖の間が酸素原子を介して連結される。この酸素を介した糖の結合をグリコシド結合と呼び、図1に示すように、シアリダーゼのような加水分解酵素はこの酸素原子の左側の結合を切断する。
4.R体とS体
炭素原子に四つ異なる置換基が結合している場合は、互いに重なり合わない二つの異性体(右手と左手の関係と呼ばれる)が存在する。R体とS体は、これらの異性体を、(カーン・インゴルド・プレローグ順位則に従って)区別する際に用いられる表記法である。
5.活性配座、立体配座
分子は、元素が化学結合でつながって構成されている。同じ分子でも、結合は回転できるため、異なる形(立体配座)を複数持つことが可能である。
グリコシド結合の場合、二つの糖の立体的な反発と、酸素原子の電子的影響で、一つないし二つの安定な立体配座を持つと考えられる。このうち、生物活性を示す際に重要な配座を、本稿では活性配座と表記している。
6.シアル酸
グルコースやガラクトースなどのC6H12O6の分子式を持つ糖とは異なり、シアル酸は炭素9個からなる酸性部位(カルボン酸)を持つ糖である。シアル酸を持つ糖鎖は、通常の糖鎖と異なる性質を持つため、その機能が独特である場合が多い。
7.核磁気共鳴(NMR)法
分子構造を決定する手法の一つであり、元素のつながりや位置関係を予測することが可能な方法である。本研究で合成した分子の構造確認、および配座解析に利用している。NMRはNuclear Magnetic Resonanceの略。
共同研究グループ
理化学研究所
開拓研究本部 袖岡有機合成化学研究室
専任研究員(研究当時) 平井 剛(ひらい ごう)
(現 客員研究員、九州大学 大学院薬学研究院 教授、理研環境資源科学研究センター 触媒・融合研究グループ 客員研究員)
研修生(研究当時) 加藤 麻理依(かとう まりえ)
研修生(研究当時) 西澤 絵里(にしざわ えり)
研修生(研究当時) 太田 英介(おおた えいすけ)
研修生(研究当時) 渡邉 亨(わたなべ とおる)
訪問研究員(研究当時) 田村 結城(たむら ゆうき)
研修生(研究当時) 岡田 光晶(おかだ みつあき)
主任研究員 袖岡 幹子(そでおか みきこ)
(理研環境資源科学研究センター 触媒・融合研究グループ グループディレクター)
環境資源科学研究センター
触媒・融合研究グループ
テクニカルスタッフⅠ 大沼 可奈(おおぬま かな)
技術基盤部門分子構造解析ユニット
ユニットリーダー 越野 広雪(こしの ひろゆき)
創発物性科学研究センター 物質評価支援チーム
チームリーダー 橋爪 大輔(はしづめ だいすけ)
宮城県立がんセンター 研究所がん薬物療法研究部
共同研究員 宮城 妙子(みやぎ たえこ)
研究支援
本研究は、日本医療研究開発機構(AMED)革新的先端研究開発支援事業AMED-PRIME「糖脂質の代謝と分子相互作用を解明する分子ツール創製」、同AMED-CREST「生物活性代謝物と標的タンパク質同定のための基盤技術の創出」、日本学術振興会(JSPS)新学術領域研究(研究領域提案型)「反応集積化が導く中分子戦略:高次生物機能分子の創製(領域代表者:深瀬 浩一)」内の「代謝安定型糖鎖を基盤とする高次生物機能中分子複合糖質アナログ創製(研究代表者:平井 剛)」による支援を受けて行われました。
原論文情報
Hirai, Go; Kato, Marie; Koshino, Hiroyuki; Nishizawa, Eri; Oonuma, Kana; Ota, Eisuke; Watanabe, Toru; Hashizume, Daisuke; Tamura, Yuki; Okada, Mitsuaki; Miyagi, Taeko; Sodeoka, Mikiko, “Ganglioside GM3 Analogues Containing Monofluoromethylene-linked Sialoside: Synthesis, Stereochemical Effects, Conformational Behavior, and Biological Activities”, JACS Au, 10.1021/jacsau.0c00058
発表者
理化学研究所
開拓研究本部 袖岡有機合成化学研究室
専任研究員(研究当時) 平井 剛(ひらい ごう)
(現 客員研究員、九州大学 大学院薬学研究院 教授、理研 環境資源科学研究センター 触媒・融合研究グループ 客員研究員)
主任研究員 袖岡 幹子(そでおか みきこ)
(環境資源科学研究センター 触媒・融合研究グループ グループディレクター)
環境資源科学研究センター 技術基盤部門 分子構造解析ユニット
ユニットリーダー 越野 広雪(こしの ひろゆき)
報道担当
理化学研究所 広報室 報道担当