ミトコンドリアを標的とした新たな治療戦略を提唱
2021-02-12 学習院大学,東京薬科大学,日本医療研究開発機構
発表者
武田啓佑(学習院大学 理学部 生命分子科学研究所 客員所員/東京薬科大学 生命科学部 分子生化学研究室 博士研究員)
三ツ堀樹大(東京薬科大学 生命科学部 分子生化学研究室 大学院生)
長島駿(東京薬科大学 生命科学部 分子生化学研究室 助教)
伊藤直樹(学習院大学 理学部 生命分子科学研究所 客員所員/東京薬科大学 生命科学部 分子生化学研究室 大学院生)
椎葉一心(学習院大学 理学部 生命科学科 分子生化学研究室 助教/東京薬科大学 生命科学部 分子生化学研究室 大学院生)
稲留涼子(学習院大学 理学部 生命科学科 分子生化学研究室 博士研究員)
柳茂(学習院大学 理学部 生命科学科 分子生化学研究室 教授/東京薬科大学 名誉教授)
発表のポイント
- ミトコンドリア機能異常がアルツハイマー病の病態を悪化させるメカニズムの一端を解明しました。
- ミトコンドリアの機能を調節する酵素MITOL(Mitochondria Ubiquitin Ligase)が高い毒性を持つアミロイドβオリゴマーの産生を抑制することを見出しました。
- アルツハイマー病においてミトコンドリアを標的とする新たな治療戦略の開発が期待されます。
発表の概要
認知症の中で最も患者数が多いアルツハイマー病は、記憶や思考能力が徐々に失われ、最終的には日常的な行動にも支障を来たす恐ろしい病気です。現在においても、アルツハイマー病の発症メカニズムの詳細は明らかにされておらず、有効な治療戦略は確立されていません。アルツハイマー病ではアミロイドβ(Aβ)と呼ばれるタンパク質の異常な凝集が引き金となって神経細胞死が誘導されると考えられています。しかしながら、脳内でAβ凝集がどのように制御されるかについては未だよく理解されていませんでした。今回、東京薬科大学生命科学部の武田啓佑研究員と学習院大学理学部の柳茂教授らのグループは、アルツハイマー病においてAβ凝集がミトコンドリアを介して制御されることを明らかにしました。
本研究では、アルツハイマー病モデルマウスを用いて、ミトコンドリア機能の低下により、毒性の高いAβオリゴマーが蓄積し、アルツハイマー病態が悪化することを明らかにしました。さらに、ミトコンドリア機能の低下によってAβオリゴマーが産生されるメカニズムとして、脳に沈着するAβ線維の変容が重要な役割を果たすことを示しました。これまでAβ線維は、線維自身がAβ凝集の足場となることが知られていましたが、今回、ミトコンドリアの機能が低下した脳内において、Aβ線維はAβ凝集、特にAβオリゴマーの形成を強く誘導することが明らかとなりました。
本研究の成果は、ミトコンドリア機能がアルツハイマー病の新しい治療ターゲットになることを示唆しています。また、ミトコンドリア機能は老化とともに低下することが知られており、ミトコンドリア機能を活性化する薬剤はアルツハイマー病の発症を予防することが期待されます。
本研究成果は、英国オンライン科学雑誌「Communications Biology」に掲載されます。
本研究は日本医療研究開発機構(AMED)「老化メカニズムの解明・制御プロジェクト」、文部科学省科学研究費補助金および私立大学戦略的研究基盤形成支援事業の支援を受けて行われました。
発表内容
研究の背景と経緯
超高齢社会を迎えた現代では、認知症をはじめとする老化関連疾患が大きな社会問題となっています。認知症の中でも患者数が多いアルツハイマー病は、進行性の神経変性によって認知機能が徐々に失われ、日常生活に支障が生じてしまう病気です。アルツハイマー病では、アミロイドβ(Aβ)タンパク質が異常に産生されており、Aβの凝集・蓄積が引き金となって神経細胞死が誘導されると考えられています。近年では、脳に沈着するAβ線維ではなく、数~数十個のAβで形成されたAβオリゴマーと呼ばれる凝集体が最も強い細胞毒性を持つと報告されており、アルツハイマー病態においてAβオリゴマーの重要性が指摘されています。しかしながら、脳内におけるAβ凝集の制御メカニズムは解明されておらず、どのようにAβオリゴマーが産生されるのかは不明でした。
ミトコンドリアは細胞内のエネルギー産生のみならず、細胞死制御や代謝調節にも関わっており、細胞内で重要な役割を担っています。アルツハイマー病では、ミトコンドリアが傷害を受け、機能不全に陥っていることが知られています。また近年では、ミトコンドリアの機能を正常に保つことが認知機能などの病態の改善につながると示唆されており、ミトコンドリアはアルツハイマー病が発症しないように働いていると考えられています。しかしながら、どのようにミトコンドリアがアルツハイマー病の病態を制御しているかについては不明でした。アルツハイマー病におけるミトコンドリアが果たす役割の解明は、アルツハイマー病治療薬の開発につながると期待できます。
研究の内容
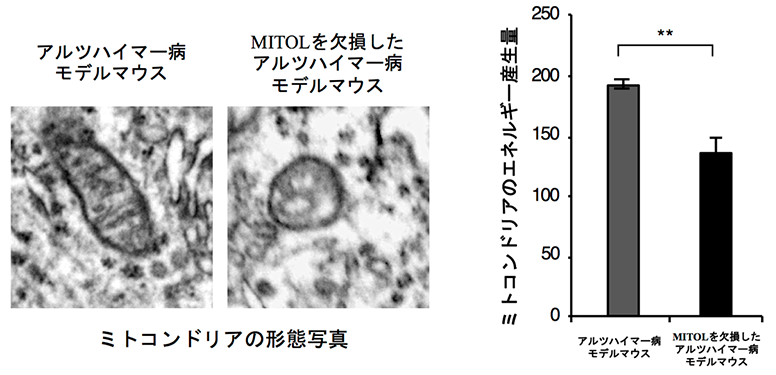
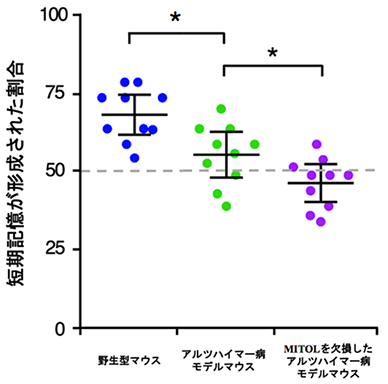
本研究グループはこれまでにミトコンドリア外膜に局在する酵素であるMitochondria Ubiquitin Ligase(MITOL)を同定し、この酵素がミトコンドリア機能を調節して恒常性維持に重要な役割を果たす制御因子であることを明らかにしてきました。近年、アルツハイマー病患者と健常者を対象として、アルツハイマー病の原因遺伝子を探る大規模なスクリーニングの結果、アルツハイマー病患者でMITOLの発現が顕著に低下していることが見出されました。実際に、本研究グループで15ヶ月齢を過ぎた高齢のアルツハイマー病モデルマウスでMITOLの発現を確認したところ、その発現が低下していました。そこで本研究グループは、神経特異的にMITOLを欠損させたアルツハイマー病モデルマウスを作製し、MITOLの低下によってミトコンドリア恒常性が正常に保てなくなった時にアルツハイマー病態がどのように変化するのかを調べました。その結果、MITOLを欠損したアルツハイマー病モデルマウスでは通常のアルツハイマー病モデルマウスと比べて、ミトコンドリアの形態や内膜構造に顕著な異常やミトコンドリアのエネルギー産生の低下が見られ、ミトコンドリアの機能が低下していることがわかりました(図1)。さらに、MITOLを欠損したアルツハイマー病モデルマウスでは、短期記憶が低下し、著しい認知機能の悪化(図2)も認められました。このことはアルツハイマー病でのMITOLの減少が、病態の悪化につながることを示唆しています。
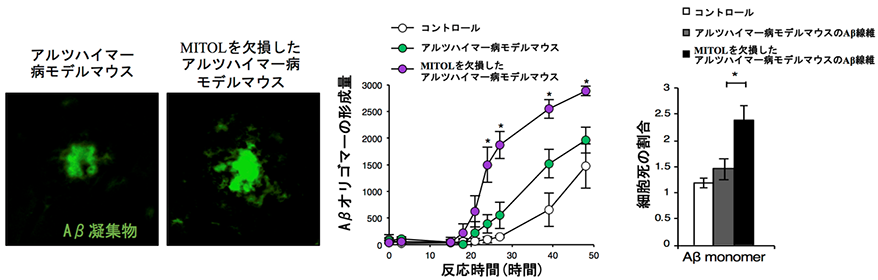
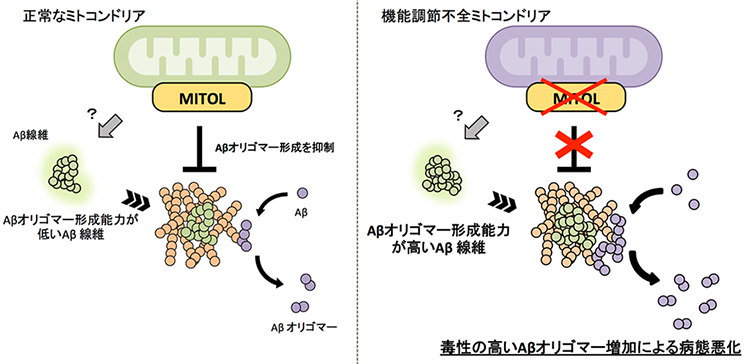
さらに本研究グループは、MITOLの減少によってなぜ病態が悪化してしまうのか原因を探りました。アルツハイマー病の発症原因として考えられているAβに着目して解析を進めたところ、特徴的な毒性の高いAβオリゴマーの過剰な蓄積が認められました。Aβオリゴマーは脳内に沈着するAβ線維の上でAβ同士が凝集することで産生されると報告されています。そこでマウスからAβ線維を単離して、Aβ同士の凝集を測定したところ、MITOLを欠損したアルツハイマー病モデルマウスに沈着したAβ線維はAβ同士を急速に凝集させ、Aβオリゴマー形成を誘導する性質を持つことがわかりました。さらにこの性質によって毒性の高いAβオリゴマーが産生され、神経細胞死を誘導することも明らかになりました(図3)。
今回の結果から、ミトコンドリア機能の調節機構が破綻すると非常に毒性の高いAβオリゴマーの産生を誘導し、アルツハイマー病の病態を悪化させる一端になる可能性が示唆されました(図4)。つまり、正常な機能を維持しているミトコンドリアは、毒性を持つAβオリゴマーの産生を抑制し、Aβによる傷害から神経細胞を保護していると考えられます。
今後の展望
今回の研究成果は、ミトコンドリアの機能調節酵素MITOLによるミトコンドリアの機能維持が細胞毒性の高いAβ凝集の産生を抑制していることを示唆しました。ミトコンドリアの機能を正常に調節することによってアルツハイマー病の病態増悪を抑制していると考えられます。現在、アルツハイマー病の有力な治療戦略としてAβをターゲットとした創薬研究が進められていますが、治療薬の開発は難航しています。本研究グループが発見したミトコンドリアによるAβ凝集制御機構は、ミトコンドリア機能維持を介したAβ凝集の抑制という新たな視点での治療戦略につながると期待できます。さらにミトコンドリア機能は老化によっても低下することがわかっており、ミトコンドリア機能を維持することでアルツハイマー病の予防戦略への応用が期待できます。
発表雑誌
- 著者
- Keisuke Takeda, Aoi Uda, Mikihiro Mitsubori, Shun Nagashima, Hiroko Iwasaki, Naoki Ito, Isshin Shiiba, Satoshi Ishido, Masaaki Matsuoka, Ryoko Inatome, and Shigeru Yanagi
- 武田啓佑、宇田葵、三ツ堀樹大、長島駿、岩崎浩子、伊藤直樹、椎葉一心、石戸聡、松岡正明、稲留涼子、柳茂
- 論文タイトル
- Mitochondrial ubiquitin ligase alleviates Alzheimer’s disease pathology via blocking the toxic amyloid-β oligomer generation
- ミトコンドリアユビキチンリガーゼが毒性の高いアミロイドβオリゴマーの生成を抑制してアルツハイマー病の病態を緩和する
- 雑誌名
- Communications Biology
- 掲載日
- 日本時間 2021年2月12日(金)19時00分
- DOI
- 10.1038/s42003-021-01720-2
- 論文URL
- https://www.nature.com/articles/s42003-021-01720-2
用語解説
- 1)アルツハイマー病
- 認知症の最も患者数が多い疾患。認知機能の低下や生活機能障害が主症状である。高齢化に伴い世界中で患者数が増加している。
- 2)Aβ(アミロイドベータ)
- 脳内で産生されるタンパク質の一種。アルツハイマー病患者脳で多く産生されており、アルツハイマー病発症の主要原因の1つである。
- 3)MITOL(Mitochondria Ubiquitin Ligase)
- ミトコンドリア外膜上に局在するユビキチン化酵素の一つ。ミトコンドリア上のシグナル伝達制御を介してミトコンドリア機能を正常に調節する。
お問い合わせ先
研究に関すること
学習院大学 理学部 生命科学科 分子生化学研究室
教授 柳茂(やなぎしげる)
取材に関すること
学習院大学 学⻑室 広報センター(担当︓湯元)
東京薬科大学 総務部 広報課
AMEDの事業に関すること
日本医療研究開発機構(AMED)
疾患基礎研究事業部 疾患基礎研究課 老化メカニズムの解明・制御プロジェクト