Ant1変異マウスの解析から新しい治療法の開発への道筋
2018-06-11 理化学研究所,日本医療研究開発機構
理化学研究所(理研)脳神経科学研究センター精神疾患動態研究チームの加藤忠史チームリーダーらの共同研究チーム※は、双極性障害(躁うつ病)[1]の病態において、ミトコンドリア[2]機能障害がセロトニン[3]神経の活動変化を引き起こすことを発見しました。
本研究成果は、双極性障害の新しい診断法・治療法の開発に貢献すると期待できます。
双極性障害は、躁状態・うつ状態を繰り返す精神疾患です。発症メカニズムは解明されていませんが、治療薬の作用機序からセロトニン神経伝達の変化の可能性が示されてきました。一方、加藤チームリーダーらは双極性障害患者の脳の測定などから、ミトコンドリア機能障害が双極性障害発症に関与する可能性を示してきましたが、セロトニン神経伝達の変化との関係は不明でした。
今回、共同研究チームは、双極性障害患者集団の中に、ミトコンドリア病[4]の原因遺伝子(ANT1)に変異を持つ患者を見いだしました。脳だけにこの遺伝子の変異を持つマウスを作製・解析した結果、セロトニン神経細胞の活動が亢進していることを発見しました。これによって、双極性障害において、ミトコンドリア機能障害とセロトニン神経伝達の変化という、二つの病態経路をつなぐメカニズムを初めて解明しました。
本研究は、米国の科学雑誌『Molecular Psychiatry』オンライン版(6月11日付け:日本時間6月11日)に掲載されます。
※共同研究チーム
- 理化学研究所 脳神経科学研究センター
- 精神疾患動態研究チーム
- 研究員(研究当時) 加藤 智朗(かとう ともあき)(現 京都大学 iPS細胞研究所)
- 専門職研究員 窪田 美恵(くぼた みえ)
- テクニカルスタッフ 藤森 典子(ふじもり のりこ)
- 研究員(研究当時) 福家 聡(ふけ さとし)(現 田辺三菱製薬株式会社)
- チームリーダー 加藤 忠史(かとう ただふみ)
- 行動遺伝学研究チーム
- 研究員(研究当時) 増田 明(ますだ あきら)(現 同志社大学 助教)
- チームリーダー 糸原 重美(いとはら しげよし)
- 日本医科大学 医学部
- 教授 鈴木 秀典(すずき ひでのり)
- 准教授 齋藤 文仁 (さいとう ふみひと)
※研究支援
本研究は、AMEDゲノム医療実現推進プラットフォーム事業「精神疾患のゲノム医療実現に向けた統合的研究」(代表者:加藤 忠史)による支援を受けて行われました。
背景
双極性障害は、躁状態・うつ状態を繰り返す精神疾患です。脳内のセロトニン神経伝達を調節する薬が治療に有効なことから、セロトニン神経伝達の変化が発症に関与していると考えられています。
一方、加藤チームリーダーらは、MRI装置[5]を用いた双極性障害患者の脳の生化学的測定や死後脳の分析から、ミトコンドリア機能障害がその病態に関与することを示してきました注1)。しかし、ミトコンドリア機能障害とセロトニン神経伝達の変化の関係は不明でした。
研究手法と成果
共同研究チームは、まれな遺伝病であるミトコンドリア病では、双極性障害を伴いやすいことに着目しました。そこで、双極性障害患者の集団において、ミトコンドリア病の原因となる遺伝子(ANT1 [6])の変異を持つ患者を探したところ、304名のうち2名が、健常者ではほとんどみられない、ANT1の機能を失う変異を持っていることが分かりました。
そこで、脳のみでAnt1遺伝子の機能が失われるマウス(Ant1変異マウス)を作製し、解析しました。その結果、このマウスの脳では、ミトコンドリアがカルシウムイオン(Ca2+)を保持しにくくなるという機能変化を示しました。次に、Ant1変異マウスの行動を解析しました。8秒待たないと報酬(甘い水)がもらえない状況にすると、普通のマウスは待たなくなってしまいますが、変異マウスは8秒後の報酬でも待ち続けるという変化がみられ、遅延報酬割引[7](将来得られる報酬は、今すぐ得られる報酬よりも低く見積もられること)という心理機能が働きにくくなっていることが分かりました。このような変化はセロトニン神経の活動を活性化させたマウスでも観察されていることから、Ant1変異マウスにおいてセロトニン機能が変化していることが疑われました。
さらに、Ant1変異マウスの脳内で、ミトコンドリアDNA[8]由来のタンパク質が減少している領域を探索しました。その結果、縫線核(ほうせんかく)[9]というセロトニン神経細胞がまとまって存在する部位で、加齢するにつれてミトコンドリアDNA由来のタンパク質が減少していることを見いだしました。さらに、このマウスで脳内のセロトニン代謝を調べたところ、セロトニンの代謝が亢進していることが分かりました。さらに、このマウスの縫線核のセロトニン神経細胞の性質を電気生理学的に調べたところ、神経細胞が活動しやすくなっていることが分かりました(図1)。
以上のことは、双極性障害のリスクとなるミトコンドリア関連遺伝子変異があると、ミトコンドリア機能障害が起きやすい脳部位にあるセロトニン神経細胞内のカルシウムイオンの制御に変調を来し、セロトニン神経細胞が活動しやすくなった結果、セロトニンが過剰に分泌されることが、双極性障害の病態に関与している可能性を示しています。
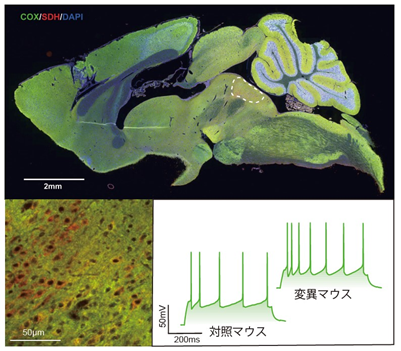
図1 Ant1変異マウスの脳切片の染色像とセロトニン神経細胞の活動
- 上段)
- Ant1変異マウス脳の矢状断(前後軸)切片の染色像。緑色はミトコンドリアDNA由来タンパク質(COX、チトクロームC酸化酵素)、赤色は核DNA由来タンパク質(SDH、コハク酸デヒドロゲナーゼ)を示している。青色は、細胞核(DAPI色素で染色)である。白い点線で囲んだ部分が、セロトニン神経のマーカー遺伝子であるセロトニン合成酵素遺伝子TPH2(トリプトファンヒドロキシラーゼ2)が発現している部位として同定した「縫線核(ほうせんかく)」。
- 下段:左)
- 縫線核の拡大画像。一つの神経細胞内で、ミトコンドリアDNA由来タンパク質であるCOX(緑色)が、核DNA由来タンパク質SDH(赤色)に比べて相対的に少ないと、細胞が赤く見える。縫線核には赤く見える細胞が多く存在するのが分かる。
- 下段:右)
- 同じ時間での電気的活動が、対照マウスの神経細胞では5回、Ant1変異マウスでは7回あった。これは、セロトニン神経細胞の活動が、変異マウスでは亢進していることを示している。
今後の期待
iPS細胞(人工多能性幹細胞)[10]の研究では、双極性障害患者由来の細胞から分化した神経細胞は、ミトコンドリア機能の変化に伴って、過剰に活動しやすくなっていることが報告されています注2)。
今回の成果は、具体的に双極性障害患者の脳内のどの神経細胞が過活動になっているのかについて、手がかりを与えるものであり、双極性障害の新しい診断法・治療法の開発にも貢献すると期待できます。
- 注2)
- Mertens et al, Differential responses to lithium in hyperexcitable neurons from patients with bipolar disorder. Nature 2015
論文情報
- タイトル
- Ant1 mutant mice bridge the mitochondrial and serotonergic dysfunctions in bipolar disorder
- 著者名
- Tomoaki M. Kato, Mie Kubota-Sakashita, Noriko Fujimori-Tonou, Fumihito Saitow, Satoshi Fuke, Akira Masuda, Shigeyoshi Itohara, Hidenori Suzuki, Tadafumi Kato
- 雑誌
- Molecular Psychiatry
- DOI
- 10.1038/s41380-018-0074-9
補足説明
- [1] 双極性障害(躁うつ病)
- およそ100人に1人弱が罹患する、主要な精神疾患の一つ。躁状態・うつ状態を繰り返す。リチウムなどの治療が再発予防に有効だが、副作用のため中断し、再発を繰り返す患者も少なくない。躁状態について本人や周囲が知識不足のために治療が遅れることもあり、また社会的に病気の理解が進んでおらず、苦しんでいる患者も多い。
- [2] ミトコンドリア
- 細胞の中にあるエネルギー代謝に関わる細胞内小器官。細胞死や細胞内のカルシウムイオン濃度の調節など、生命にとって極めて重要な役割を果たしており、その機能が障害されると細胞や個体にさまざまな影響を及ぼす。
- [3] セロトニン
- 神経伝達物質の一つ。抗うつ薬はセロトニンの神経伝達を促進し、躁状態に有効な抗精神病薬はセロトニンの神経伝達を遮断することなどから、双極性障害ではセロトニンの神経伝達が関与していると推測されている。
- [4] ミトコンドリア病
- 細胞内小器官であるミトコンドリアが原因となる病気。ミトコンドリアDNAの変異、あるいは核ゲノムの遺伝子変異により二次的にミトコンドリアDNAに変異が生じるために発症する遺伝病。脳と筋の症状が強く表れることから、ミトコンドリア脳筋症とも呼ばれる。
- [5] MRI装置
- MRIはMagnetic Resonance Imagingの略。磁場中における水素原子の核スピンの共鳴現象により、人体などの断面撮像を行う装置。脳や血管などの画像診断に広く使われるが、画像に用いる水素原子だけでなく、他の原子(リンなど)の生化学的な分析にも用いることができる。
- [6] ANT1
- アデニンヌクレオチドトランスロカーゼ1。ミトコンドリア内外でADP(アデノシン二リン酸)とATP(アデノシン三リン酸)を交換する機能を持つタンパク質を作る遺伝子で、核ゲノムにコードされている。このためANT1の変異によるミトコンドリア病は、母系遺伝ではなく、常染色体優性遺伝をする。ANT1タンパク質は、ミトコンドリア内から、カルシウムイオンを含めたさまざまな物質をミトコンドリア外に出す、ミトコンドリア膜透過性遷移孔という分子複合体にも関わっている。
- [7] 遅延報酬割引
- 英語ではDelay discountingという。「1年後に1万円もらうのと今X円もらうのと、どちらが良いですか?」と質問された場合、Xが9,990円なら、今9,990円もらう方を取るであろう。一方、Xが3,000円なら、1年後に1万円もらう方を取るであろう。3,000円と9,990円の間のどこかに、1年後の1万円と甲乙つけがたい金額が存在する。仮にそれが8,800円とすると、1年後の1万円は今の8,800円と等価、ということになる。このとき、「1年後の報酬の価値は12%割り引かれている」ということになる。これが遅延報酬割引と呼ばれる心理機能である。
今回のマウスにおける測定で検討しているのは、もっと短い時間についてである。普通のマウスは、8秒待たないと報酬(甘い水)がもらえない状況にすると、待つことをやめてしまうが、変異マウスは8秒後の報酬でも待ち続けるという変化がみられた。通常は、8秒後に得られる甘い水の価値は割り引かれて減ってしまうが、変異マウスでは、8秒後の報酬の価値が割り引かれていないと解釈される。なお、即時に得られる甘い水に対する嗜好性には差がなかったことから、甘い水の価値そのものが上がったわけではない。 - [8] ミトコンドリアDNA
- 遺伝子のほとんどは細胞の核内の染色体のDNA(核ゲノム)にあり、両親から受け継ぐ。しかし、細胞内小器官(細胞内の微小構造)の一つであるミトコンドリアは、ミトコンドリアDNAと呼ばれる独自のDNAを持ち、ミトコンドリアで働くタンパク質を作る遺伝子の一部は、このミトコンドリアDNAに記されている。これは、太古の昔に細胞の中に細菌が共生したことの名残と考えられている。このミトコンドリアDNAは、核の染色体DNAと異なり、すべて母親から受け継ぐ。一つの細胞に多数のミトコンドリアDNA分子が存在するが、その一部に異常があると、ミトコンドリア病が引き起こされる。
- [9] 縫線核(ほうせんかく)
- 脳幹に存在し、セロトニン含有細胞が多く存在する、小さな神経核。今回の報告は、正確には背側縫線核(英語ではDorsal Raphe)についての知見である。今回の研究で、縫線核においては、野生型のマウスでも、老齢になるとミトコンドリアDNA由来タンパク質(COX)が減少していることが見いだされた。そのメカニズムはまだ不明であり、今後の研究課題である。
- [10] iPS細胞(人工多能性幹細胞)
- 脊椎動物の初期胚が持つ、全ての種類の体細胞へ分化する能力を多能性という。多能性を持ち、試験管内で培養して無限に増やすことができる細胞を多能性幹細胞という。iPS細胞は、成人の皮膚細胞などの体細胞・組織から採取した細胞にOct3、Sox2、Klf4遺伝子などを導入して初期化し多能性を持たせ、人工的に作製した多能性幹細胞である。
お問い合わせ先
発表者
理化学研究所 脳神経科学研究センター 精神疾患動態研究チーム
チームリーダー 加藤 忠史(かとう ただふみ)
機関窓口
理化学研究所 広報室 報道担当
事業に関する問い合わせ窓口
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部バイオバンク課