2021-06-08 理化学研究所
理化学研究所(理研)環境資源科学研究センターバイオ高分子研究チームの小田原真樹研究員、土屋康佑客員研究員、沼田圭司チームリーダーらの研究チームは、ナノサイズのカプセルであるポリイオンコンプレックス型ベシクル(PICsome)[1]に内包したCas9リボヌクレオタンパク質[2]を用いて、植物カルス[3]のゲノム編集[4]技術を開発しました。
カルスは多くの植物で誘導でき、かつ植物体への再生が可能なことから、本技術は実用植物における汎用性が高く安全なゲノム編集技術として期待できます。
植物細胞にCas9リボヌクレオタンパク質を直接送達するゲノム編集は、より安全性の高いゲノム編集技術として注目されています。しかし、導入にはエレクトロポレーション法[5]やPEG(ポリエチレングリコール)法[6]を利用するため、適用できる植物種が限られていました。
今回、研究チームは、表面を細胞透過性ペプチド(CPP)[7]で修飾したPICsome(CPP-PICsome)内にタンパク質を内包させ、タンパク質の活性を維持したまま植物カルスの細胞内へ効率的に取り込ませることに成功しました。また本送達法を応用し、Cas9リボヌクレオタンパク質を植物内へ取り込ませることによって植物カルスのゲノムを編集する技術を開発しました。
本研究は、科学雑誌『ACS Applied Nano Materials』オンライン版(6月3日付)に掲載されました。
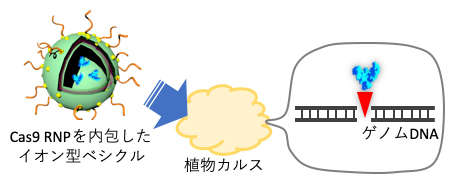
ナノカプセルに内包したCas9 RNPを植物カルス細胞内へ送達し、ゲノム編集を行う
背景
近年、ゲノム編集技術の発展によりさまざまな生物においてゲノム編集が可能になっており、特にCas9/CRISPRシステムは基礎から応用まで幅広く用いられています。Cas9/CRISPRによるゲノム編集は、多くの生物でCas9遺伝子を導入することによって行われています。しかし、Cas9リボヌクレオタンパク質を細胞内に直接送達すれば、オフターゲット[8]が少なくなり、また外来遺伝子を導入しなくても済むことから、より安全なゲノム編集技術となります。
Cas9リボヌクレオタンパク質を植物細胞内に直接的に送達する方法としてはエレクトロポレーション法とPEG(ポリエチレングリコール)法が知られていますが、いずれも細胞壁を取り除いた細胞(プロトプラスト)を用います。プロトプラストから植物体の再生が可能な植物は限られているため、より多くの植物に用いることのできる汎用性の高い送達法が必要です。植物カルスは、多くの植物のさまざまな組織から誘導可能な未分化細胞であり、またその一部から植物体を再生できることから、汎用性の高いゲノム編集を行うための材料として適切であると考えられます。
研究手法と成果
研究チームは、タンパク質やCas9リボヌクレオタンパク質を植物細胞内に送達するための担体として、半透過性膜で構成され、さまざまな生体高分子を内包できるポリイオンコンプレックス型ベシクル(PICsome)というナノサイズのカプセルに着目しました。まず、アミノ酸を骨格とするポリマーを混ぜ合わせることでPICsomeを作製すると同時に、このPICsomeに蛍光タンパク質のCitrineタンパク質を内包させることに成功しました(図1)。

図1 代表的なPICsomeの電子顕微鏡像(左)と切片の電子顕微鏡像
PICsomeはおおよそ200 ナノメートル(nm、1nmは10億分の1メートル)の球状であり、切片化により内部の空洞が確認できる。
細胞内への送達効率を上げるために、PICsomeの表面に細胞透過性ペプチド(CPP)を付加したCPP-PICsomeを作製しました。Citrineタンパク質を内包させたCPP-PICsomeをモデル植物のシロイヌナズナのカルスに導入したところ、細胞内への効率的なCitrineタンパク質の取り込みが共焦点レーザー顕微鏡[9]により確認できました(図2)。また、CPP-PICsomeで処理した細胞は90%以上の高い生存率を示したことから、この手法の細胞毒性の低さも明らかになりました。
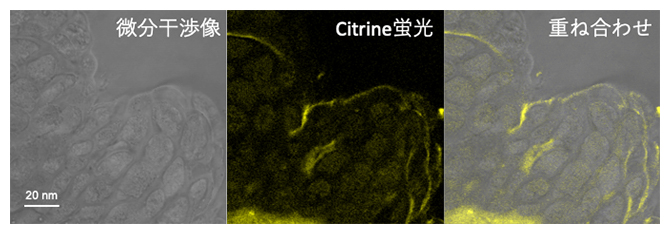
図2 CPP-PICsomeに内包したCitrineタンパク質の細胞内局在
共焦点レーザー顕微鏡像。CPP-PICsomeを担体としてCitrineタンパク質(蛍光タンパク質)を内包させ、シロイヌナズナのカルス細胞に導入したところ、Citrineタンパク質が細胞内に効率的に取り込まれたことが分かった。
続いて、蛍光色素で標識したCas9リボヌクレオタンパク質をCPP-PICsomeに内包させ、カルスに導入しました。共焦点レーザー顕微鏡による観察の結果、CPP-PICsomeによって導入したCas9リボヌクレオタンパク質がカルス細胞内に効率良く取り込まれることが分かりました(図3)。
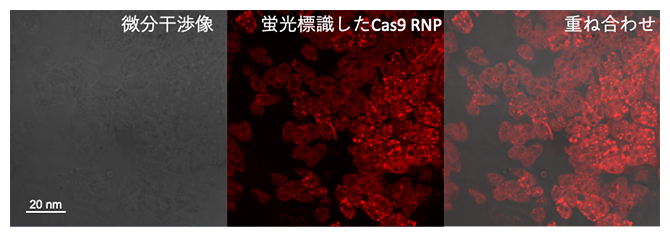
図3 CPP-PICsomeに内包したCas9 リボヌククレオタンパク質(RNP)の細胞内局在
共焦点レーザー顕微鏡像。CPP-PICsomeを担体としてCas9RNPを内包させ、シロイヌナズナのカルスに導入したところ、Cas9RNPが細胞内に効率的に取り込まれたことが分かった。
CPP-PICsomeによってCas9リボヌクレオタンパク質を導入したカルスのゲノム編集を解析するため、標的配列であるPDS3遺伝子のディープシークエンシング解析[10]を行いました。その結果、Cas9リボヌクレオタンパク質を導入したカルスのPDS3遺伝子において、ゲノム編集による典型的な変異が観察されました(図4)。

図4 Cas9リボヌクレオタンパク質を導入したカルスに見られたゲノム編集
野生型のPDS3遺伝子配列と比較し、Cas9リボヌクレオタンパク質を導入したカルスからは、DNA切断導入部位に欠失(1塩基欠失)あるいは挿入を伴う欠失(14塩基欠失/4塩基挿入)が見られた。
今後の期待
本研究では、ポリイオンコンプレックス型ベシクルに細胞透過性ペプチドを組み合わせることにより、内包させた蛍光タンパク質をその活性を維持したまま植物カルスの細胞内へ効率的に送達することに成功しました。さらに、Cas9リボヌクレオタンパク質をポリイオンコンプレックス型ベシクルに内包させることにより、カルスのゲノム編集を行う技術を開発しました。
ポリイオンコンプレックス型ベシクルを利用したタンパク質の細胞内への送達は、ポリイオンコンプレックス膜の半透過性を利用した生理学的研究への応用が期待できます。また、この技術を利用したCas9リボヌクレオタンパク質によるゲノム編集は、汎用性の高い安全なゲノム編集技術としてさまざまな実用植物の品種改良に貢献すると期待できます。
補足説明
1.ポリイオンコンプレックス型ベシクル(PICsome)
プラスに荷電したポリマーとマイナスに荷電したポリマーを水溶液で混合することにより、ポリマーが静電相互作用により集合して形成されるベシクル(小胞)。
2.Cas9リボヌクレオタンパク質
Cas9/CRISPRシステムのCas9タンパク質とガイドRNAの複合体。
3.カルス
植物のさまざまな組織から誘導できる未分化細胞の塊。植物の傷口に形成されたり、植物ホルモンを加えることにより誘導できる。
4.ゲノム編集
核酸分解酵素(ヌクレアーゼ)を利用してゲノム上の標的部位を改変する技術。
5.エレクトロポレーション法
細胞に短パルスの電流をかけて穿孔し、そこから核酸やタンパク質を導入する方法。
6.PEG(ポリエチレングリコール)法
細胞壁を除去してプロトプラスト化した細胞にPEGを作用させて、核酸やタンパク質を導入する方法。
7.細胞透過性ペプチド(CPP)
細胞膜を透過して細胞内へ移行できるペプチドの総称。10~100個ほどのアミノ酸からなる。CPPは、Cell-Penetrating Peptideの略。
8.オフターゲット
標的部位以外のゲノム配列を改変してしまうこと。
9.共焦点レーザー顕微鏡
高解像度の蛍光画像を取得できる顕微鏡の一種。光軸方向と二次元走査型の情報を組み合わせることで、立体イメージも構築できる。
10.ディープシークエンシング解析
次世代シークエンシング法により、ゲノムやゲノム上の特定の箇所の塩基配列を数千や数万の重複度で読む方法。
研究チーム
理化学研究所 環境資源科学研究センター バイオ高分子研究チーム
チームリーダー 沼田 圭司(ぬまた けいじ)
(京都大学大学院 工学系研究科 教授)
研究員 小田原 真樹(おだはら まさき)
特別研究員(研究当時) 渡邊 健太(わたなべ けんた)
特別研究員(研究当時) 河崎 陸(かわさき りく)
客員研究員 土屋 康佑(つちや こうすけ)
(京都大学大学院 工学系研究科 特定准教授)
テクニカルスタッフ(研究当時) 立石 彩香(たていし あやか)
客員研究員 児玉 豊(こだま ゆたか)
(宇都宮大学 バイオサイエンス教育研究センター 教授)
研究支援
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業 総括実施型研究ERATO「沼田オルガネラ反応クラスタープロジェクト(研究総括:沼田圭司)」による支援を受けて行われました。
原論文情報
Masaki Odahara, Kenta Watanabe, Riku Kawasaki, Kousuke Tsuchiya, Ayaka Tateishi, Yoko Motoda, Takanori Kigawa, Yutaka Kodama and Keiji Numata, “Nanoscale Polyion Complex Vesicles for Delivery of Cargo Proteins and Cas9 Ribonucleoprotein Complexes to Plant Cells”, ACS Applied Nano Materials, 10.1021/acsanm.1c00695
発表者
理化学研究所
環境資源科学研究センター バイオ高分子研究チーム
研究員 小田原 真樹(おだはら まさき)
客員研究員 土屋 康佑(つちや こうすけ)
チームリーダー 沼田 圭司(ぬまた けいじ)
報道担当
理化学研究所 広報室 報道担当