軟骨再生医療やiPS細胞を用いた創薬研究への応用に期待
2021-08-10 岡山大学,日本医療研究開発機構
胚形成過程の側板中胚葉注1より生み出される肢芽間葉系細胞注2は、四肢(両手・両足)の原基である肢芽を構成する細胞群です。肢芽間葉系細胞は、四肢骨格を構成する多くの細胞種(軟骨細胞、骨芽細胞、腱・靭帯細胞、真皮線維芽細胞など)への分化能力を有しています。そのため肢芽間葉系細胞は、四肢骨格形成メカニズムを理解するうえで重要なだけでなく、ヒト多能性幹細胞注3(ヒトES細胞やヒトiPS細胞)を利用した運動器の再生医療研究・ヒト疾患モデリング研究に重要な細胞種です。しかしながら、ヒト多能性幹細胞から側板中胚葉を誘導する手法に関しては報告されていましたが、側板中胚葉から肢芽間葉系細胞を誘導する技術、それを拡大培養する技術に関しては確立されていませんでした。
今回、岡山大学学術研究院医歯薬学域(医学系)宝田剛志教授、山田大祐助教、髙尾知佳助教、尾﨑敏文教授、中田英二講師らの研究グループは、東京大学大学院工学系研究科 中村正裕特任助教、京都大学ウイルス・再生医科学研究所/iPS細胞研究所 戸口田淳也教授、吉富啓之准教授(現医学研究科准教授)、川井俊介特定拠点助教、東京大学大学院医学系研究科 北條宏徳准教授、岡山理科大学フロンティア理工学研究所 岩井良輔講師らとの共同研究により、ヒト多能性幹細胞から肢芽間葉系細胞を誘導・拡大培養する技術を開発し、肢芽間葉系細胞の軟骨細胞分化能を事前に評価するための表面抗原の同定に成功しました。開発した技術を利用することで、四肢骨格形成異常をきたすII型コラーゲン異常症注4患者由来iPS細胞より肢芽間葉系細胞を誘導し、培養皿上で患者疾患病態を再現させ、疾患モデリング/創薬スクリーニング方法の開発にも成功しました。さらに、iPS細胞由来肢芽間葉系細胞と、細胞自己凝集化誘導技術(Cell self-Aggregation Technology,CAT)を組み合わせることで、均一な大きさを有する硝子軟骨注5組織塊の大量作製法を開発し、同組織塊が膝関節軟骨の再生能を有していることを示しました。以上の成果から、ヒト多能性幹細胞由来の肢芽間葉系細胞を用いることで、ヒト四肢の骨格形成メカニズムの解明や各種骨格系疾患の病態解明が進むだけでなく、軟骨再生医療や骨格系統疾患患者由来iPS細胞を用いた創薬応用の進展が期待されます。
本研究成果は、2021年8月10日、国際科学誌「Nature Biomedical Engineering」のResearch Articleとして掲載されました。
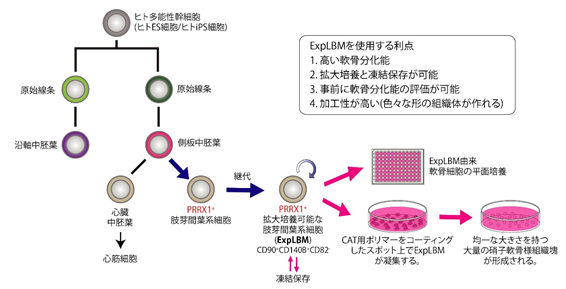
研究の概略図
発表内容
背景
現在、ES細胞やiPS細胞などのヒト多能性幹細胞から特定の細胞に分化誘導させる試みが数多くなされていますが、目的細胞(=最終分化細胞)への分化誘導効率の低さと不安定性が問題視されています。私たちは、この問題点を解決する一つの方法として、目的細胞がヒト多能性幹細胞から生み出される分化過程を理解し、その過程における中間段階の細胞群(=前駆細胞)を、目的細胞への分化能力を維持した状態で拡大培養する技術を開発することが重要であると考えています。一方、運動器であるヒトの四肢(両手・両足)は、膝関節軟骨の損傷、骨欠損、腱靭帯損傷などを対象とした再生医療分野や、骨系統遺伝性疾患患者由来iPS細胞を利用した創薬応用において重要な研究対象です。四肢は、胚形成過程に一時的に出現する肢芽(limb bud)より発生しますが、肢芽の構成要素である肢芽間葉系細胞(Limb bud mesenchymal cells, LBM)は、側板中胚葉に由来し、四肢骨格を構成する多くの細胞種(軟骨細胞、骨芽細胞、腱・靭帯細胞、真皮線維芽細胞など)への分化能力を有しています。そこで私たちは、ヒト多能性幹細胞からLBMを誘導することで、ヒトの骨格形成メカニズムの解明だけでなく、運動器の再生医療や、iPS細胞を利用した疾患モデリング研究への応用が可能になると考えました。
研究手法・成果
LBMでは、Paired related homeobox1(PRRX1)注6タンパク質が特異的に発現していることに注目し、PRRX1遺伝子がオンになっている細胞を可視化出来るヒトiPS細胞(=PRRX1レポーターiPS細胞)を樹立しました。PRRX1レポーターiPS細胞を側板中胚葉へと誘導した後(参考文献)、様々な添加物の組み合わせを検討することで、95%以上の細胞がPRRX1陽性LBMになる分化誘導条件を見出すことに成功しました(図1)。
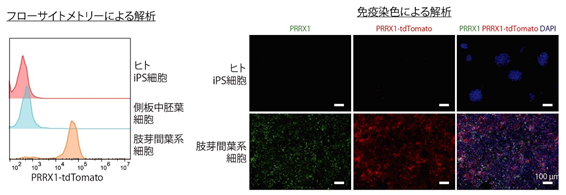
図1.ヒト多能性幹細胞からPRRX1陽性肢芽間葉系細胞を誘導する技術の開発ヒトiPS細胞に遺伝子改変を行うことで、PRRX1陽性細胞を蛍光タンパク質であるtdTomatoの発現で可視化させる細胞株(=PRRX1レポーターiPS細胞)を樹立した。同レポーター細胞を使用することで、側板中胚葉からPRRX1陽性肢芽間葉系細胞を誘導する事に成功した。
次に、PRRX1の発現レベルが高く維持された状態でLBMの継続拡大培養を可能にする技術を開発し、安定的に増殖する細胞をExpandable LBM(ExpLBM)と名付けました。ExpLBMは、極めて高い軟骨細胞分化能および硝子軟骨組織形成能を有し、ExpLBM由来軟骨組織体は、免疫不全ラット注7の軟骨欠損部位に生着し、ヒト由来の軟骨組織として再生することが確認されました(図2)。
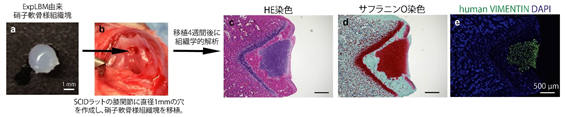
図2.ExpLBM由来軟骨組織帯の硝子軟骨再性能の評価ExpLBM由来硝子軟骨様組織塊(a)をSCIDラットの膝関節軟骨欠損部位(b)に移植し、4週間後に組織切片を作製してHE染色(c)、サフラニンO染色(d)、human VIMENTINの免疫染色(e)を行った。サフラニンO染色陽性(赤色、d)の箇所において、ヒト由来細胞(緑色、e)の生着が確認された。
ExpLBMの持つ軟骨細胞分化誘導能は、ExpLBMの継続培養時におけるPRRX1発現量と正に相関することを発見しました。そこで、PRRX1の発現量と相関性を示す表面抗原を網羅的に探索することで、ExpLBMの軟骨分化能を規定するCD抗原注8(CD90陽性CD140B陽性CD82陰性)を同定し、ExpLBMの軟骨分化能を前向きに品質管理する方法論を開発しました(図3)。
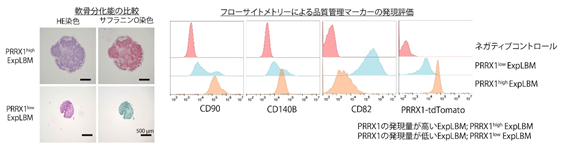
図3.表面抗原の検出によるExpLBMの品質管理方法の開発PRRX1の発現量が低下したExpLBM(PRRX1lowExpLBM)は、サフラニンO陽性な硝子軟骨様組織塊を形成する事が出来ない。またPRRX1lowExpLBMは、CD90とCD140Bの発現減少及びCD82の発現増加が観察された。
ExpLBMを大量培養できる利点を生かして、次にExpLBMを利用した疾患モデリング/創薬スクリーニング方法の開発を目指しました。II型コラーゲン異常症は、四肢の骨格形成異常をきたす骨系統遺伝性疾患の一つで、軟骨基質を形成するII型コラーゲンをコードするCOL2A1遺伝子の変異が原因とされています。COL2A1変異を有するⅡ型コラーゲン異常症患者より作製されたiPS細胞からExpLBMを樹立、拡大培養、目印分子(CD90,CD140B,CD82)により品質管理後、細胞ストックを作製しました。患者由来ExpLBMでは健常人由来の場合と比べて、軟骨細胞分化能が著しく抑制されていることや、軟骨組織体の電子顕微鏡による観察では細胞内小胞体の配向が乱れているなど、患者病態が培養皿上で再現されていることを確認しました。そこで、平面培養下で形成されるノジュール(軟骨分化の指標のひとつ)を画像解析ソフトにより一括に数値化できるシステムを構築することで、患者由来ExpLBMの軟骨分化能に与える化合物の影響を簡易的に大量に検査することが可能なシステム(ハイスループットスクリーニングシステム)を開発しました。このシステムにおいて、多種多様な化合物を評価したところ、患者由来ExpLBMでの分化能を改善する化合物をいくつか発見することができました(図4)。
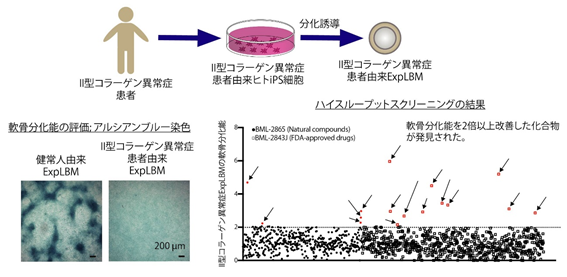
図4.II型コラーゲン異常症患者由来ExpLBMを用いた治療薬候補の探索II型コラーゲン異常症患者由来ヒトiPS細胞からExpLBMを誘導し、軟骨分化能を改善する化合物を探索するためにハイスループットスクリーニングを行った。コンドロイチン硫酸などの酸性粘液多糖類に富んだ部位を染めるアルシアンブルー染色を評価方法として用いた結果、患者由来細胞の軟骨分化能を2倍以上改善する化合物が発見された。
共同研究者である岩井らが開発した自己凝集化誘導技術(Cell self-Aggregation Technology,CAT)を使用することで、ExpLBMを利用した軟骨組織体の形状制御の可能性を検討しました。CAT用ポリマーを塗布した培養皿に細胞を播種すると、1時間以内に細胞はCATを塗布した表面にのみ接着してシート状の単層構造を形成しますが、一晩足らずの培養の間に細胞間結合を維持したまま培養表面から剥離しながら自己凝集・組織化することが確認されています。つまり、任意の形状にCAT用ポリマーを塗布した培養皿に細胞を播種するだけで、その塗布形状に沿った3Dの細胞凝集体が一晩足らずの培養で自動的に作製することが出来ます。目印分子(CD90,CD140B,CD82)により品質管理されたExpLBMを、40nl/spot,300 spot/dishの条件にて塗布された培養皿に播種すると、CATポリマー塗布部分にのみExpLBMが接着し、その形状に細胞が自己凝集化し、それを軟骨分化誘導処理することで、均一な球状の大量の軟骨組織体を簡便に得ることに成功しました(図5)。同組織体を免疫不全ラット膝関節欠損部に移植することで、腫瘍形成されることなくホスト組織に生着し、欠損部の軟骨組織が再生されることを確認しました。
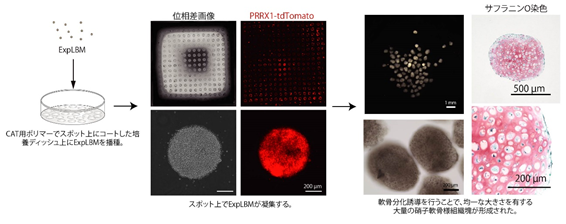
図5.ExpLBMを用いた均一な大きさを有する軟骨組織体の大量生産CAT用ポリマーでスポット上に塗布した培養ディッシュにExpLBMを播種すると、凝集塊が形成され、それらに軟骨分化誘導を行うと、サフラニンO染色(軟骨基質成分が赤色に染まる)陽性な硝子軟骨様組織塊が大量に形成された。
波及効果・今後の予定
本研究では、ヒト多能性幹細胞より安定的・大量にExpLBM(=ヒト軟骨前駆細胞)を産生する方法を開発することに成功しました。ExpLBMは、継代し液体窒素による保存が可能であり、同細胞源からは安定的に成熟化した軟骨細胞を創出することが可能です。さらに、継代・ストックしたExpLBMの品質(=軟骨細胞分化能)を、特定の目印分子(CD90,CD140B,CD82)の有無により管理する方法の開発にも成功しました。
分化能の品質管理されたヒト軟骨前駆細胞を大量培養する技術を開発したことで、再生医療のモダリティー(治療手段)の幅を広げることが出来たと考えています。つまり、iPS細胞などから誘導した最終分化細胞の細胞懸濁液の投与だけでなく、三次元培養技術によるスフェロイド注9形成、あるいは足場材料注10と合わせた形状組織体の作製が可能となりました。本研究グループは自己凝集化を誘導する表面コーティング剤(CAT)とExpLBMを利用することで、足場材料なしに任意の形状の軟骨組織体を形成する技術を開発し、顎顔面領域の再建にて従来頻用される自家肋軟骨移植に代わる医療技術の創出を目指しています(令和2及び3年度AMED技術課発個別課題)。
また本研究では、Ⅱ型コラーゲン異常症患者由来iPS細胞よりExpLBMを樹立することで、疾患ExpLBMを使用した疾患モデリング/創薬スクリーニング方法の実施例を提示することができました。これまでのヒト多能性幹細胞からの分化誘導プロトコールでは、中間状態としての前駆細胞を明確に定義づけできていないため、実験者間、あるいは細胞株間での目的細胞への誘導効率にばらつきが生じることが問題点としてありました。また、遺伝子の強制発現のステップを有したプロトコールでは、安定性・効率性には優れる一方で、生体内での分化系譜を模倣していない可能性があり、疾患iPS細胞を使用した病態解明研究には不適切な可能性も指摘されておりました。今回開発したExpLBM(=ヒト軟骨前駆細胞)が発生過程を模倣して誘導されたものである点において、変異遺伝子の病態発現機構の再現に優れていると考えられます。また、前駆細胞状態において継代培養及び拡大培養できる点は、実験再現性の点で改善されただけでなく、ハイスループット性の高い創薬スクリーニング系の構築には極めて有用です。これらの点から、今回開発したExpLBMが、ヒト四肢の骨格形成メカニズムの解明や各種骨系疾患の病態解明への利用だけでなく、骨系統疾患患者由来iPS細胞を用いた創薬応用への貢献が期待されます。
参考文献
Kyle M. Loh, et al(2016). Mapping the Pairwise Choices Leading from Pluripotency to Human Bone, Heart, and Other Mesoderm Cell Types. Cell, 166(2), 451-67.
論文情報
- 論文名
- Induction and expansion of human PRRX1+ limb-bud-like mesenchymal cells from pluripotent stem cells
- 掲載紙
- Nature Biomedical Engineering
- 著者
- Daisuke Yamada, Masahiro Nakamura, Tomoka Takao, Shota Takihira, Aki Yoshida, Shunsuke Kawai, Akihiro Miura, Lu Ming, Hiroyuki Yoshitomi, Mai Gozu, Kumi Okamoto, Hironori Hojo, Naoyuki Kusaka, Ryosuke Iwai, Eiji Nakata, Toshifumi Ozaki, Junya Toguchida, Takeshi Takarada* (*Corresponding Author)
- DOI
- 10.1038/s41551-021-00778-x
研究資金
本研究は、日本医療研究開発機構(AMED)「再生医療実現拠点ネットワークプログラム(幹細胞・再生医学イノベーション創出プログラム)」、「再生医療実現拠点ネットワークプログラム(技術開発個別課題)」、「再生医療実現拠点ネットワークプログラム(疾患特異的iPS細胞の利活用促進・難病研究加速プログラム)」、科学研究費補助金(17H04399)、京都大学ウイルス・再生医科学研究所 再生医学・再生医療の先端融合的共同研究課題などの支援を受けておこなわれました。
補足・用語説明
- 注1 側板中胚葉
- 哺乳類の発生系譜上に現れる細胞群である中胚葉の一部。側板中胚葉由来の細胞が予定肢領域(肢が発生する部分)に移動、増殖することにより肢芽(limb bud)を形成する。
- 注2 肢芽間葉系細胞(limb bud mesenchymal cells/LBM)
- 四肢の発生過程で一時的に出現する肢芽(Limb bud)に局在する細胞。四肢骨格を構成する多くの細胞種(軟骨細胞、骨芽細胞、腱靭帯細胞、真皮線維芽細胞など)への分化能力を有している。
- 注3 ヒト多能性幹細胞
- ヒト胚性幹細胞(ES細胞)や、ヒト人工多能性幹細胞(iPS細胞)などを指す。胎盤を除く全ての細胞に分化可能であり、無限の増殖能を持っている。
- 注4 II型コラーゲン異常症
- 四肢の骨格形成異常をきたす骨系統遺伝性疾患の一つ。軟骨基質を形成するII型コラーゲンをコードするCOL2A1遺伝子の変異が原因とされ、軟骨内骨化が障害され四肢、体幹ともに短縮する。
- 注5 硝子軟骨
- 関節軟骨、骨端板、肋軟骨、気管軟骨、喉頭軟骨などを構成する軟骨。基質にコラーゲン線維とプロテオグリカンを多く含む。
- 注6 Paired related homeobox1(PRRX1)
- 転写制御因子の一つ。肢芽間葉系細胞で高く発現していることから、肢芽間葉系細胞のマーカー分子として使われている。
- 注7 免疫不全ラット
- 免疫機能が低下あるいは消失したラット。ヒト細胞の移植実験に使用される。
- 注8 CD抗原
- 細胞膜上に発現するタンパク質であり、細胞種毎にCD抗原の発現パターンは異なる。これらの分子に対する抗体により、細胞の選別や単離を行うことが出来る。
- 注9 スフェロイド
- 細胞同士が凝集して塊になったもの。単層に培養された2次元組織体に比べ、より生体に近い構造と機能を持つことが確認されている。
- 注10 足場材料
- 細胞の接着、増殖、分化を制御するための基材。移植細胞の足場として再生医療研究などに使用される。
お問い合わせ
研究に関するお問い合わせ
岡山大学学術研究院医歯薬学域(医学系)
組織機能修復学分野 教授 宝田 剛志
AMED事業に関するお問い合わせ先
日本医療研究開発機構
再生・細胞医療・遺伝子治療事業部 再生医療研究開発課