2021-08-17 国立がん研究センター,慶應義塾慶應義塾大学医学部,日本医療研究開発機構
発表のポイント
- 難治性であり、かつ病態解明が困難であるスキルス胃がんについて、腹膜播種による腹水細胞を用いた全ゲノム解析等によって、疾患に特徴的なゲノム異常を解明しました。
- 治療標的となり得る複数のゲノム異常を発見するとともに、マウスモデルを用いた研究では、治療標的となり得る分子を阻害することで、がん細胞の増殖抑制または腹膜播種の消失を確認しました。
- 今後、がん患者さんを対象とした臨床開発への検討を重ね、がん遺伝子パネル検査への実装や分子標的治療薬の開発を目指します。
概要
国立研究開発法人国立がん研究センター(理事長:中釜斉、東京都中央区)研究所の細胞情報学分野(間野博行分野長)および基盤的臨床開発研究コアセンター創薬標的・シーズ探索部門(佐々木博己研究員)を中心とした研究グループと慶應義塾大学医学部病理学教室(金井弥栄教授)は、難治がんであり、また検体の入手や解析が難しく発がん機構やゲノム異常がほとんど明らかになっていないスキルス胃がんについて、しばしば病初期から存在することが知られる腹膜播種による腹水細胞を対象として全ゲノム解析等を行い、病態の解明と治療標的の同定を試みました。
その結果、スキルス胃がんに特徴的な遺伝子異常を数多く同定し、しかも全体の約1/4が既存の分子標的薬剤の有効性が期待できることを見いだしました。さらに、腹水中のがん細胞から樹立した細胞株を用いて腹膜播種モデルマウスを作成し、各阻害剤を投与したところ、がん細胞の増殖抑制または腹膜播種の消失を確認しました。
スキルス胃がんは、早期発見が難しく、おなかの中にがん細胞が散らばる腹膜播種により治療も難しいため、発がんや腹膜播種を抑制する治療が求められています。今後、がん患者さんを対象とした臨床開発への検討を重ね、がん遺伝子パネル検査への実装や分子標的治療薬の開発を目指します。
本研究成果は2021年8月17日に米国の国際学術誌「Nature Cancer」にオンライン掲載されました。
背景
スキルス胃がんは、がん細胞が、粘膜下に広く浸潤し、診断時に既に腹膜播種や腹水を来すことが多い悪性腫瘍で、膵臓がんなどと並んで最も予後の悪いがん種と考えられています。スキルス胃がんでは腫瘍細胞は低分化型1あるいは印環細胞2の形態を取り、粘膜下への浸潤によって周辺間質の著明な線維化を来すことが知られています。これまで胃がん全体あるいはびまん性胃がんのゲノム解析は報告されてきましたが、スキルス胃がんは、手術があまり行われず、また検体を入手できても線維化が強くがん細胞の含有割合が低いため、スキルス胃がんのゲノム異常や発がん機構はほとんど明らかにされていませんでした。
そこで今回研究チームは、高純度の試料を得るため、胃がんの腹膜播種からがん性腹水を来した患者さんの腹水中のがん細胞を純化すると共にがん細胞株を樹立し、これら試料に対して全ゲノム解析を含む網羅的マルチオミックス解析3を行い、スキルス胃がんの病態解明と治療標的の同定を試みました。
研究方法
胃がんの腹膜播種により腹水が貯留した患者さんより同意の下で腹水を採取し、がん細胞を純化すると共に、細胞株の樹立も試みました。その結果、純化がん細胞のみが得られた患者さん39例、がん細胞株のみ得られた患者さん22例、両者共に得られた患者さん37例の、計98例について腹水由来のがん試料が得られました。これらの試料を同じ患者さんのペア末梢血と共に、ゲノムDNAを調製し全ゲノム解析を行いました。純化がん細胞および細胞株についてはRNAも調製し、次世代シークエンサーによる配列解析も行いました。さらに細胞株が得られた症例については網羅的メチル化解析4、網羅的エンハンサー解析5などのエピゲノム解析を行い統合的な解釈を試みました(図1)。これら症例の約9割は、低分化型がん細胞、印環細胞陽性、びまん性浸潤、最初の転移巣が腹膜、などの特徴を組み合わせて有しており、いわゆるスキルス胃がんに該当すると考えられます。
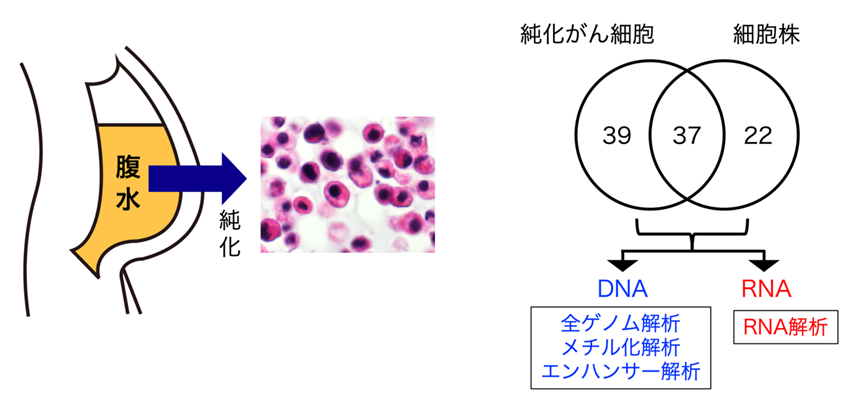 図1 実験の概要
図1 実験の概要
研究結果
- ポイント1
- 受容体型チロシンキナーゼ—RAS—MAPK経路6の遺伝子群の高度増幅・遺伝子融合による発がん機構がスキルス胃がん全体の約半数に存在していることが明らかになりました。その少なくとも半数は既存の分子標的治療薬の治療が有効なことが実験で確認されました。
全ゲノム解析の結果、興味深いことに、細胞増殖の重要な制御系である受容体型チロシンキナーゼ—RAS—MAPK経路の遺伝子群に高頻度にがん化変異(増幅)が認められました。中でも、10コピー以上の高度増幅が認められた遺伝子としてKRAS(全症例中19.4%)、FGFR2(11.2%)、MET(7.1%)、ERBB2(5.1%)およびEGFR(4.1%)が挙げられます。さらに肺がんで認められるEML4-ALK融合遺伝子が2例、甲状腺がんで認められるAGK-BRAF融合遺伝子が1例で発見されました。これら遺伝子の増幅・融合は全体の50%におよび、スキルス胃がんの発症機構に染色体の構造異常が大きな役割を果たしていることが明らかとなりました(図2)。なおKRAS遺伝子については点突然変異(アミノ酸置換)による活性化も11.2%で認められており、上記の遺伝子高度増幅と相互排他的に存在していました。
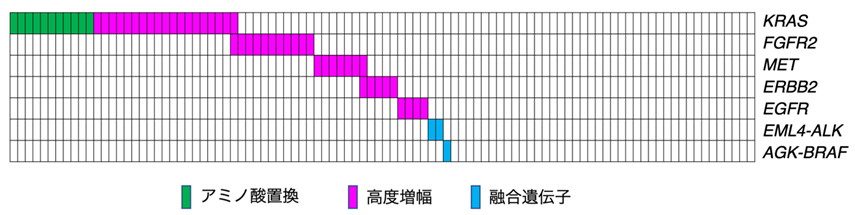 図2 受容体型チロシンキナーゼ-RAS-MAPK経路のがん化変異
図2 受容体型チロシンキナーゼ-RAS-MAPK経路のがん化変異
しかも、これら異常の多くに対応した分子標的治療薬が既に開発・実用化されています。そこで、EML4-ALK、MET、FGFR2各遺伝子の増幅異常をもつ細胞株をマウス腹腔に接種したのちに、ALK阻害剤(alectinib)、MET阻害剤(capmatinib)、FGFR2阻害剤(infigratinib)をそれぞれ経口投与した結果、図3に示されるように、腹膜播種が速やかに消失することが確認されました。
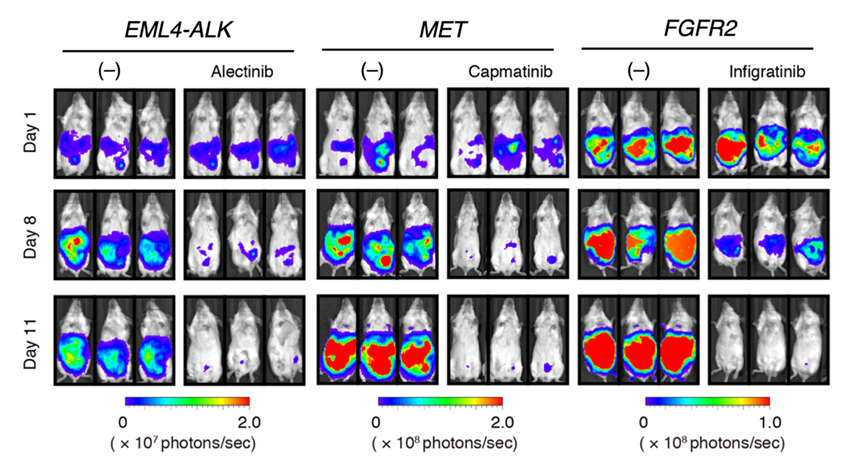 図3 腹膜播種モデルマウスの治療実験
図3 腹膜播種モデルマウスの治療実験
- ポイント2
- 遺伝子発現プロファイルから全体が大きく2群に分類され、片方のグループには上皮間葉転換(epithelial mesenchymal transition: EMT)7に関わる遺伝子が高発現していました。EMTが亢進している群にはTEAD1遺伝子の高発現も認められ、その活性を阻害することが治療効果につながることが腹膜播種モデルマウスを用いて確認されました。
一方、網羅的RNA解析により得られた遺伝子発現プロファイルをもとに検体を階層的クラスタリング8すると、図4左にあるように、全体が大きく2群に分かれました。両群を区別している遺伝子を探索したところ、EMTに関与する遺伝子群が最も明瞭に両群を分けることが明らかになりました。実際、EMTに重要な役割を果たすTGF-β経路の遺伝子群が発現上昇している「EMTグループ」と、それが認められない「non-EMTグループ」に区別されることがわかります。
また、興味深いことに、EMTグループ特異的に、細胞増殖および器官のサイズを制御するHippo経路9の転写因子群TEAD1、WWTR1(TAZ)などが高発現していました(図4中央パネル)。EMT特異的なHippo経路の転写因子高発現はこれまで報告がありません。そこでTEAD抑制の治療効果を検討するために、EMTグループの細胞株を用いて腹膜播種モデルマウスを作成し、TEAD1-4の阻害剤を経口投与したところがん細胞の増殖が抑えられました(図4右パネル)。またTEAD阻害剤とMAPK経路阻害剤の同時投与によって、さらに強いがん細胞死が誘導されました。
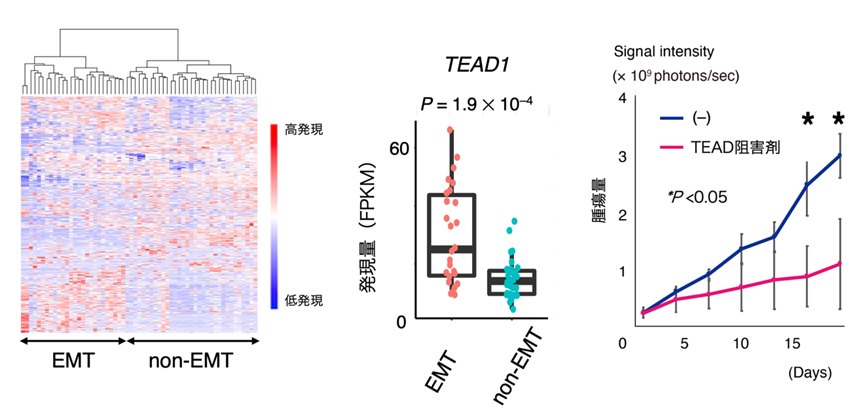 図4 EMTグループ胃がんのTEAD阻害剤による治療
図4 EMTグループ胃がんのTEAD阻害剤による治療
今後の展望
本研究成果により、スキルス胃がんの詳細なゲノム異常が明らかになりました。特に受容体型チロシンキナーゼ—RAS—MAPK経路の遺伝子の高度増幅が特徴的です。また、マウス実験で多くの分子標的薬の有効性も確認されたことから、今後は同様な患者さんのがん遺伝子パネル検査への実装や分子標的治療薬の開発への展開が期待されます。またTEAD経路の阻害が全く新しいスキルス胃がんの治療薬剤として開発される可能性があります。
発表論文
- 雑誌名
- Nature Cancer
- タイトル
- Multi-omic profiling of peritoneal metastases in gastric cancer identifies molecular subtypes and therapeutic vulnerabilities
- 著者名
- Yosuke Tanaka, Fumiko Chiwaki, Shinya Kojima, Masahito Kawazu, Masayuki Komatsu, Toshihide Ueno, Satoshi Inoue, Shigeki Sekine, Keisuke Matsusaki, Hiromichi Matsushita, Narikazu Boku, Yae Kanai, Yasushi Yatabe, Hiroki Sasaki, Hiroyuki Mano
- DOI
- 10.1038/s43018-021-00240-6
用語解説
- 1 低分化型
- がん細胞が、本来の正常な細胞の形態をどれくらい維持しているかを「分化度」といい、「未分化」「低分化」「高分化」などと表現します。分化度の低いがん細胞は、悪性度が高く活発に増殖する傾向があります。病理検査でがん細胞の分化度を調べることで、悪性度の評価や治療効果の予測などを行います。
- 2 印環細胞
- 細胞中に粘液を貯留し、核が辺縁に押しやられるため、印環(家紋などの印の付いた指輪)に似た形態を取る細胞
- 3 マルチオミックス解析
- 本研究における全ゲノム解析のような網羅的な手法を複数組み合わせて解析するアプローチ
- 4 メチル化解析
- ゲノムDNAの一部の5’-CG-3’配列中のシトシン(C)はメチル化されており、近傍の遺伝子発現は抑制されます。アレイ方式あるいは次世代シークエンサーによる解析で、ゲノム中のメチル化シトシンの部位を網羅的に解析することが可能です。
- 5 エンハンサー解析
- 多くの遺伝子の発現は臓器特異的に制御され、また様々な細胞外刺激に応じて発現量が変化します。ゲノム配列中で、そのような遺伝子の発現量を制御する領域をプロモーターあるいはエンハンサーと呼び、後者は遺伝子の5’または3’どちら側にも存在し、また遺伝子座から遠く離れていても制御することが可能です。ゲノム中のエンハンサーとして働いている箇所のヒストンH3の27番目のアミノ酸リジンはアセチル化されているため、ゲノム中のそのような場所を探すことで、エンハンサー領域を網羅的に同定可能です。
- 6 受容体型チロシンキナーゼ—RAS—MAPK経路
- 細胞増殖に関わる最も重要な経路の一つで、細胞外成長因子のシグナルを受容体型チロシンキナーゼが受け取り、そのシグナルをさらに細胞内のRAS分子、MAPK分子群などに順番に伝え、最終的に細胞周期を進める役割を持ちます。なお、チロシンキナーゼとは基質タンパク上のチロシン残基をリン酸化する酵素です。
- 7 上皮間葉転換(epithelial mesenchymal transition:EMT)
- がんは上皮細胞が腫瘍化した状態ですが、上皮由来細胞が細胞間接着能など本来の上皮の性質を失い、間葉系細胞の特性を得て浸潤・遊走能を獲得することをいいます。TGF-β刺激などがEMTを誘導することが知られています。
- 8 階層的クラスタリング
- 遺伝子発現プロファイルの似たサンプルをより近くに置くようにして系統樹を作成する解析法。遺伝子発現の類似性から、サンプルを群分けするのに用います。
- 9 Hippo経路
- ショウジョウバエで発見された細胞増殖・器官サイズを調節する経路。HippoはヒトではMST1/2と呼称されるタンパクキナーゼであり、そのシグナルは最終的に核内転写因子群YAP/WWTR1/TEAD1-4に作用して増殖関連遺伝子の転写を制御します。
本研究への支援
国立研究開発法人日本医療研究開発機構(AMED)
次世代がん医療創成研究事業
「ヒト上皮性腫瘍の発生・進展機構の解明と新規治療標的の同定」
創薬基盤推進研究事業
「多層的オミックス解析による、がん、精神疾患、腎疾患を対象とした医療技術開発」
本件に関するお問い合わせ先
研究者
国立研究開発法人 国立がん研究センター
研究所 細胞情報学分野 間野博行
研究所 創薬標的・シーズ探索部門 佐々木博己
学校法人慶應義塾慶應義塾大学医学部
病理学教室 金井弥栄
機関窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
学校法人慶應義塾慶應義塾大学 信濃町キャンパス総務課:山崎・飯塚
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課
次世代がん医療創生研究事業(P-CREATE)
創薬基盤推進研究事業