ビタミンAや単球を標的にした治療法開発に期待
2021-08-16 九州大学,日本医療研究開発機構
研究概要
九州大学大学院薬学研究院の大戸茂弘教授、吉田優哉特任助教らの研究グループは、松永直哉教授、小柳悟教授らと、薬学部と薬剤部の「薬薬連携研究」の成果として、慢性腎臓病(CKD)時に生じる心臓の炎症/線維化がビタミンAと単球(白血球の1種)を介して悪化する仕組みを明らかにしました。慢性腎臓病(CKD)による腎機能の低下は様々な合併症を引き起こしますが、特に発症頻度が高いのが心疾患です。にもかかわらず、CKD時に心疾患リスクが上昇する要因については十分理解されておらず、末期CKD患者の死因1位は心不全です。
一方、多くの生物は、地球の自転に伴う外部環境の周期的な変化に対応するため、自律的にリズムを発振する機能(体内時計)を保持しています。この体内時計は時計遺伝子と呼ばれる複数の転写因子によって維持されていますが、疾患時には時計遺伝子の発現/機能にしばしば異常が認められます。今回、研究グループはマウスおよびヒト血液検体を用いた実験により、CKD時に生じる血中ビタミンA濃度の上昇が時計遺伝子の発現を変容させること、およびこの発現変容が単球の炎症促進作用を高めることを突き止めました。また、この単球が心臓に浸潤することで、心臓の炎症を悪化させることも明らかにしました。これらの知見から、CKD時に単球の炎症活性を上昇させる分子を標的とした治療薬の開発や、ビタミンAの異常な蓄積を改善する血液浄化法の構築につながることが期待されます。
本研究成果は、2021年5月13日(木)午前10時(英国時間)に国際科学雑誌「Nature Communications」にオンライン公開されました。
研究内容
ヒトを初めとする多くの哺乳動物には、概日周期で生体機能を制御する体内時計が備わっています。体内時計の本体は、時計遺伝子Clock,Bmal1,Per,Cry が構築する転写/翻訳フィードバックループであり、D-site binding protein(DBP)に代表される時計出力遺伝子を介してさまざまな生体機能の概日リズムを制御しています。時計出力遺伝子により制御される分子には、異物の代謝に関わる多くの代謝酵素が含まれています。
慢性腎臓病(chronic kidney disease;CKD)は、腎機能の低下が慢性的に続く病態の総称を指します。成人人口の約13%がCKDと推計されることから、深刻な社会問題とされています。CKD患者に薬物を投与する際は薬物代謝能の低下を考慮する必要がありますが、CKD時の薬物動態学的変化は腎臓のみならず肝臓でも生じています。特にCKD患者の肝臓では薬物代謝を担う酵素であるシトクロムP450(CYPs)の発現量が健常時と比較して顕著に減少することが知られていますが、このうちCYP3A4は、医薬品の50%以上の代謝に関与する代表的な分子種であるため、CKD時におけるCYP3A4発現量低下機構の解明が望まれます。
またCKDは薬物代謝異常のみでなく様々な合併症を引き起こしますが、特に心不全などの炎症を伴う心血管障害は生命予後に影響を及ぼします。しかしながら、これらの障害の発症および増悪メカニズムは十分に解明されていません。一方、我々はCKDモデルマウスの腎臓における炎症増悪因子としてClock遺伝子を見出しており、Clock遺伝子の変異は腎臓の炎症を抑制します。そこで、体内時計の分子機構の側面よりCKD時の肝臓および心臓の病態悪化メカニズムを解析しました。
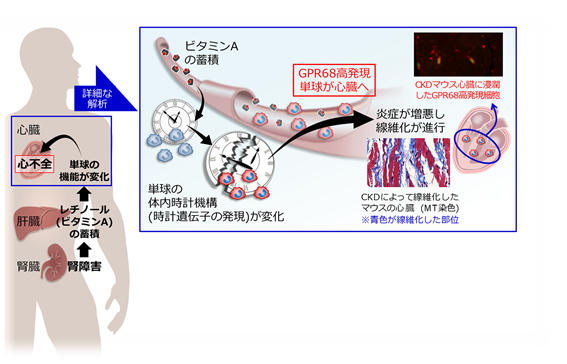
図CKD時には肝臓でビタミンAの代謝不全が生じ、血中のビタミンA濃度が上昇します。ビタミンAは時計遺伝子を介して単球のGPR68というタンパク質の発現を誘導します。GPR68を高発現する単球は高い炎症促進作用を有しており、心臓へ浸潤することで心臓組織の炎症や線維化を進行させます。
以前の研究成果ですでに、CKDモデルマウスの腎臓とはかけ離れた肝臓において、腎臓から遊離するTGF-β1が肝臓の時計遺伝子DBPの発現低下を引き起こし、さらにDBPに制御される代謝酵素CYP3A11およびCYP26A1の発現低下が認められました。これら薬物代謝酵素はレチノールの代謝を担うことからCKDモデルマウスの体内にレチノールの過剰蓄積を生じさせていました。また、過剰蓄積したレチノールは、さらに腎線維化を介し腎機能悪化に寄与することが明らかとされていました。すなわち腎臓で発現が上昇するTGF-β1による腎-肝連関、肝臓で代謝不全が生じるレチノールによる肝-腎連関を組み合わせて、腎-肝-腎連関が腎障害時には生じていること、その過程にDBPやCLOCKといった時計遺伝子が関与してることが明らかになっていました。
そこで本研究では、CKD時の心臓の病態と体内時計との関連性を解明するために、野生型およびClock mutant(Clk/Clk)マウスにて5/6Nx(5/6腎臓摘出マウス(5/6nephrectomy))を作製し、心臓の病態を評価しました。その結果、Clk/Clk5/6Nxマウスと野生型5/6Nxマウスで、血圧や血中アンジオテンシンII値等に差異はなかったにもかかわらず、Clk/Clk5/6Nxマウスのみ、心線維化や心不全マーカーであるナトリウム利尿ペプチド(BNP)値の上昇が抑制されました。この原因遺伝子をマイクロアレイ解析等を用いて探索し、野生型5/6Nxマウスの心臓においてCLOCK依存的に発現制御される遺伝子であるG-protein coupled receptor68(GPR68)を同定しました。この受容体は5/6Nxマウス心室の単球由来マクロファージに高発現しており、単球からの炎症性サイトカイン産生に関与していました。また、GPR68高発現単球は脾臓に貯蔵されていたことから、5/6Nxマウスを対象に脾臓摘出を行ったところ、心室中GPR68高発現細胞数の減少が確認されました。そこで脾臓摘出5/6Nxマウスに対して正常単球またはGPR68をノックダウンした単球を移植したところ、正常単球移植群では心線維化やBNP値の上昇が認められたのと対照的に、GPR68ノックダウン単球移植群ではこれらの上昇が抑制されました。
またマウスおよびヒトのGPR68遺伝子上流には共通してCLOCK/BMAL1の結合配列が存在し、5/6Nxマウス単球のGPR68発現誘導は細胞内のCLOCK/BMAL1増加を介して引き起こされていました。マウス単球を対象としたマイクロアレイ解析や血清成分の曝露実験の結果、これらの発現誘導が5/6Nxマウスの血中に蓄積するレチノール/retinol binding protein4(RBP4)複合体によって引き起こされていることが明らかになりました。さらに5/6Nxマウスに対して術後8-14週の間ビタミンA不含給餌を行った結果、血中レチノール/RBP4の蓄積、単球中のGPR68、CLOCK、BMAL1の発現上昇、およびBNP値の上昇が抑制されました。また、ヒト初代培養単球においてもGPR68発現はレチノール/RBP4を介したCLOCK/BMAL1によるトランス活性化により制御されていたことから、CKD患者由来の血清を対象に検討を行いました。CKD患者血清中にはレチノール/RBP4が蓄積していたが、この血清を曝露したヒト単球のGPR68、CLOCK、BMAL1発現および炎症性サイトカイン産生量はレチノール濃度に相関し、高値を示しました。さらに、患者検体のBNP値も、GPR68発現やレチノール濃度と正の相関を示しました。以上の結果から、レチノール-単球CLOCK/BMAL1-GPR68を軸とした新たな腎-心連関が明らかになりました。CKD時の心臓については、病態悪化に単球内GPR68の発現上昇が重要な役割を担っていること、および単球内GPR68の発現もレチノールおよび時計遺伝子を介して誘導されることを明らかにしました。さらに、マウスで明らかにした機序はCKD患者の単球機能や心臓病態とも関連していました。
概日時計機構の異常、肝臓CYPs発現の低下、レチノール蓄積、単球機能亢進などの現象およびこれらを介した一連の機構は、CKD時における病態解明および創薬ターゲットになりうるだけでなく、他の疾患領域においても応用可能であると考えられます。本研究にて明らかにした新たな機構が、新規治療薬の開発および血液浄化法の発展につながることが期待されます。
発表論文
- 雑誌名
- Nature Communications(2021年5月13日(英国時間)にオンライン版掲載)
- 論文タイトル
- Alteration of circadian machinery in monocytes underlies chronic kidney disease-associated cardiac inflammation and fibrosis.
- 著者
- Yuya Yoshida, Naoya Matsunaga, Takaharu Nakao, Kengo Hamamura, Hideaki Kondo, Tomomi Ide, Hiroyuki Tsutsui, Akito Tsuruta, Masayuki Kurogi, Michio Nakaya, Hitoshi Kurose, Satoru Koyanagi & Shigehiro Ohdo
- DOI
- 10.1038/s41467-021-23050-x
- 九州大学プレスリリース
- https://www.kyushu-u.ac.jp/ja/researches/view/606
研究支援
- 科学研究費補助金(基盤研究(A)16H02636)
- 科学研究費補助金(挑戦的研究(開拓)17H06262)
- 科学研究費補助金(基盤研究(B)18H03192)
- 科学研究費補助金(基盤研究(B)19H02854)
- 日本医療研究開発機構 創薬等ライフサイエンス研究支援基盤事業「グリーンファルマを基盤にした創薬オープンイノベーションの推進」(JP21am0101091)
お問い合わせ先
研究に関すること
九州大学大学院薬学研究院薬剤学分野
教授 大戸 茂弘
AMED事業に関すること
日本医療研究開発機構(AMED)創薬事業部 医薬品研究開発課
創薬等ライフサイエンス研究支援基盤事業(BINDS)