2021-09-16 京都大学iPS細胞研究所
ポイント
- フッ素系エラストマー製マイクロ流体デバイスを用いた肝臓チップを作製可能であることを確認した。
- フッ素系エラストマー製肝臓チップを用いて、薬物収着の影響を最小限にした薬物代謝・毒性試験が可能であることを確認した。
1. 要旨
Organs-on-a-chip(臓器チップ)技術とは、生体内の三次元的かつ動的な環境をin vitroで再現する技術で、創薬研究への応用が期待されています。ポリジメチルシロキサン(PDMS)注1)はOrgans-on-a-chip研究におけるマイクロ流体デバイス注2)の素材として広く用いられるエラストマー注3)です。しかしながら、PDMSは低分子化合物を収着しやすいため、創薬研究への利用は限定的でした。
そこで、佐野絵美(CiRA増殖分化機構研究部門・研究員)、出口清香(CiRA同部門・大学院生)、AGC株式会社、鳥澤勇介(元・京都大学大学院工学研究科・特定准教授)、高山和雄(CiRA同部門・講師)らの研究グループは、低分子化合物を収着しづらいテトラフルオロエチレン-プロピレン(FEPM)注4)エラストマーを素材としたマイクロ流体デバイスを用いて、FEPM製肝臓チップを作製し、薬物代謝・毒性試験を実施しました。
その結果、FEPM製肝臓チップにおける低分子化合物の収着量は、PDMS製デバイスにおける収着量よりも小さく、FEPM製肝臓チップを用いて薬物代謝・毒性試験を実施できることを確認しました。FEPM製肝臓チップは低分子化合物を評価する創薬研究に有用であると考えられます。
この研究成果は2021年9月15日にACS Omegaでオンライン公開されました。
2. 研究の背景
創薬研究の初期段階で実施されるin vitro試験において、Organs-on-a-chipの利用が期待されています。Organs-on-a-chipとは、マイクロ流体デバイスに細胞を搭載することで、生体内の細胞の動的環境や三次元環境を再現できるin vitroモデルです。Organs-on-a-chip技術を用いることで、細胞を培地の流れによるせん断応力や伸縮による力学的刺激に晒すことができるため、臓器機能の一部を再現できます。 また、複数の流路にそれぞれ異なる細胞を播種することで、細胞間相互作用も再現できます。Organs-on-a-chipを創薬研究へ利用することで、従来の二次元培養条件よりも生体に近い条件で、医薬品候補化合物の評価が可能になると考えられます。
Organs-on-a-chipsで使用されるマイクロ流体デバイスの多くは、ポリジメチルシロキサン (PDMS)で作製されています。PDMSは無色透明、成形が容易、安価であり、マイクロ流体デバイス作製に適した特性を持ちます。しかしながら、PDMSは低分子化合物を収着するリスクを抱えているため、PDMSの代わりとなる低収着マテリアルを用いたマイクロ流体デバイスの開発と応用が期待されています。
当研究グループはこれまでに、低分子化合物をほぼ収着しないゴム素材としてテトラフルオロエチレン-プロピレン(FEPM)エラストマーを使用したマイクロ流体デバイスの開発に成功しています(Sano et al, Micromachines, 2019)。しかし、FEPM製デバイスに細胞を搭載したFEPM製臓器チップを用いて、低分子化合物による細胞応答を評価可能かどうか検討していませんでした。そこで本研究では、FEPM製臓器チップを用いて、薬物代謝試験や薬物毒性試験を含む創薬研究が実施できるか検討しました。ここでは、薬物の代謝と毒性に大きく寄与するヒト肝細胞を搭載したFEPM製肝臓チップを作製し、様々な低分子化合物に対する細胞応答を調べました。
3. 研究結果
1) PDMS製およびFEPM製デバイスで培養したヒト肝細胞
当研究グループのFEPM製デバイスとPDMS製デバイスは2つの流路から構成されており、2本の流路はそれぞれ膜で仕切られており、小さな分子のみ透過します。赤で示された領域がトップチャネルで、緑で示された領域がボトムチャネルです(図1A)。ヒト肝細胞をPDMS製デバイスあるいはFEPM製デバイスのトップチャネルに播種したところ(図1B)、多角形で二核というヒト肝細胞の典型的な特徴がいずれの培養器材においても観察できました(図1C)。しかしながら、ポリスチレン注5)製マルチウェルプレート(PS製プレート)と比較すると、PDMS製デバイスとFEPM製デバイスでは細胞の形態観察がやや難しいことが分かりました。
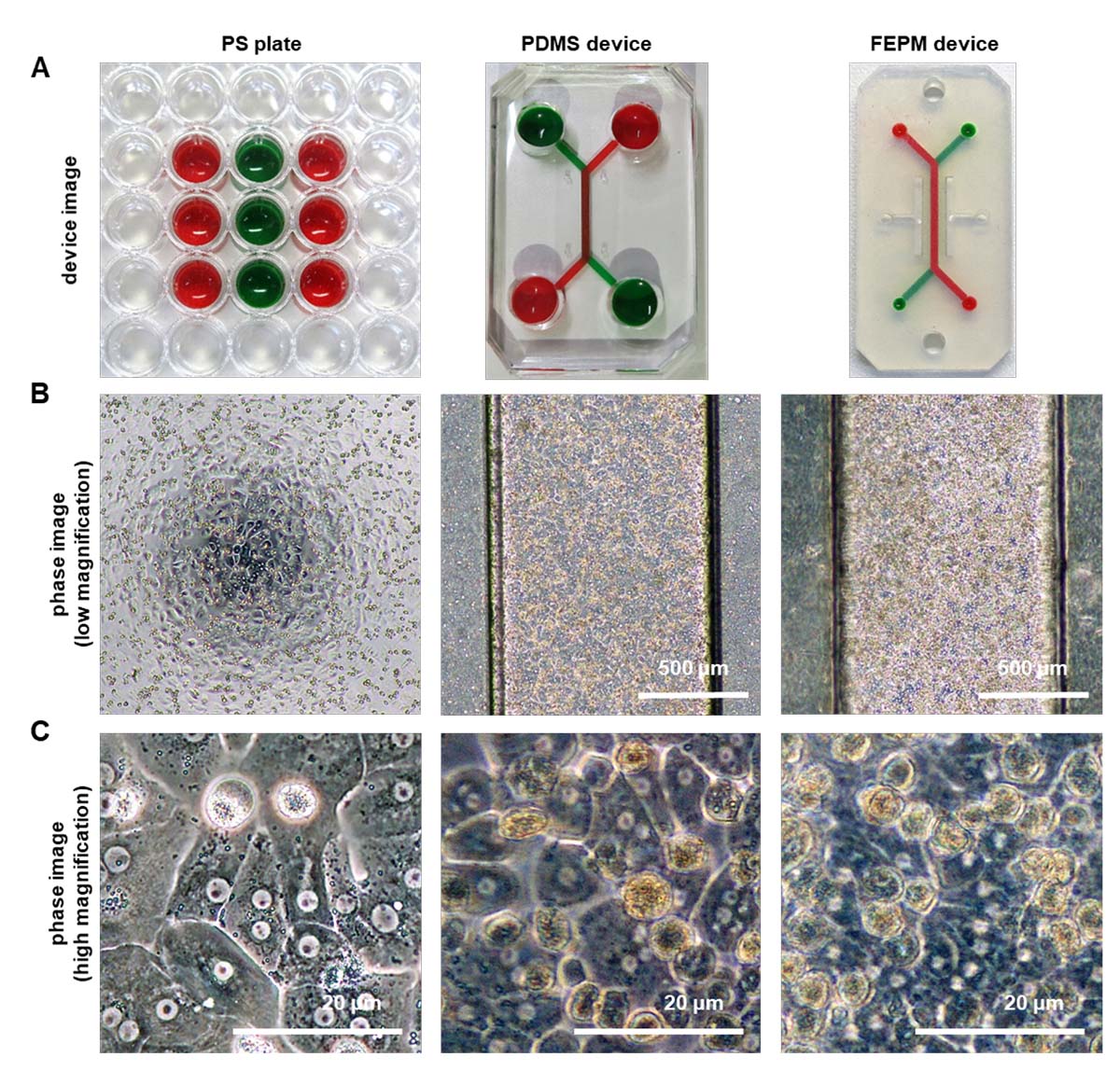
(図1A)PS製プレート及びPDMS製、FEPM製デバイスの写真。
(図1B、C)PS製プレート及びPDMS製、FEPM製デバイスで培養したヒト肝細胞の明視野画像。
2) PDMS製およびFEPM製デバイスで培養したヒト肝細胞における肝細胞マーカーの遺伝子発現およびタンパク質発現解析
FEPM製デバイスを使用することがヒト肝細胞の肝機能にどのように影響を与えるか調べました。PS製プレートまたはPDMS製デバイス、FEPM製デバイスで培養したヒト肝細胞の肝細胞マーカーの遺伝子発現をリアルタイムPCRで調べました。典型的な肝細胞マーカー(アルブミン:ALB)、代表的な薬物代謝酵素注6)など(CYP3A4、UGT1A1、BSEP)の遺伝子発現量は各デバイス間で差がありませんでした(図2A)。次に、培養上清中のヒトALB分泌量をELISAで測定したところ、各デバイス間で差はありませんでした(図2B)。さらに、肝細胞マーカーの免疫染色を実施したところ、PS製プレート及びPDMS製デバイス、FEPM製デバイス上で培養されたヒト肝細胞は肝細胞マーカー(ALB及びCK18、CYP3A4、AAT、HNF4A)を強く発現していました(図2C)。以上より、FEPM製デバイスで培養したヒト肝細胞は、PS製プレートやPDMS製デバイスで培養した肝細胞と同等の機能を有することが示されました。
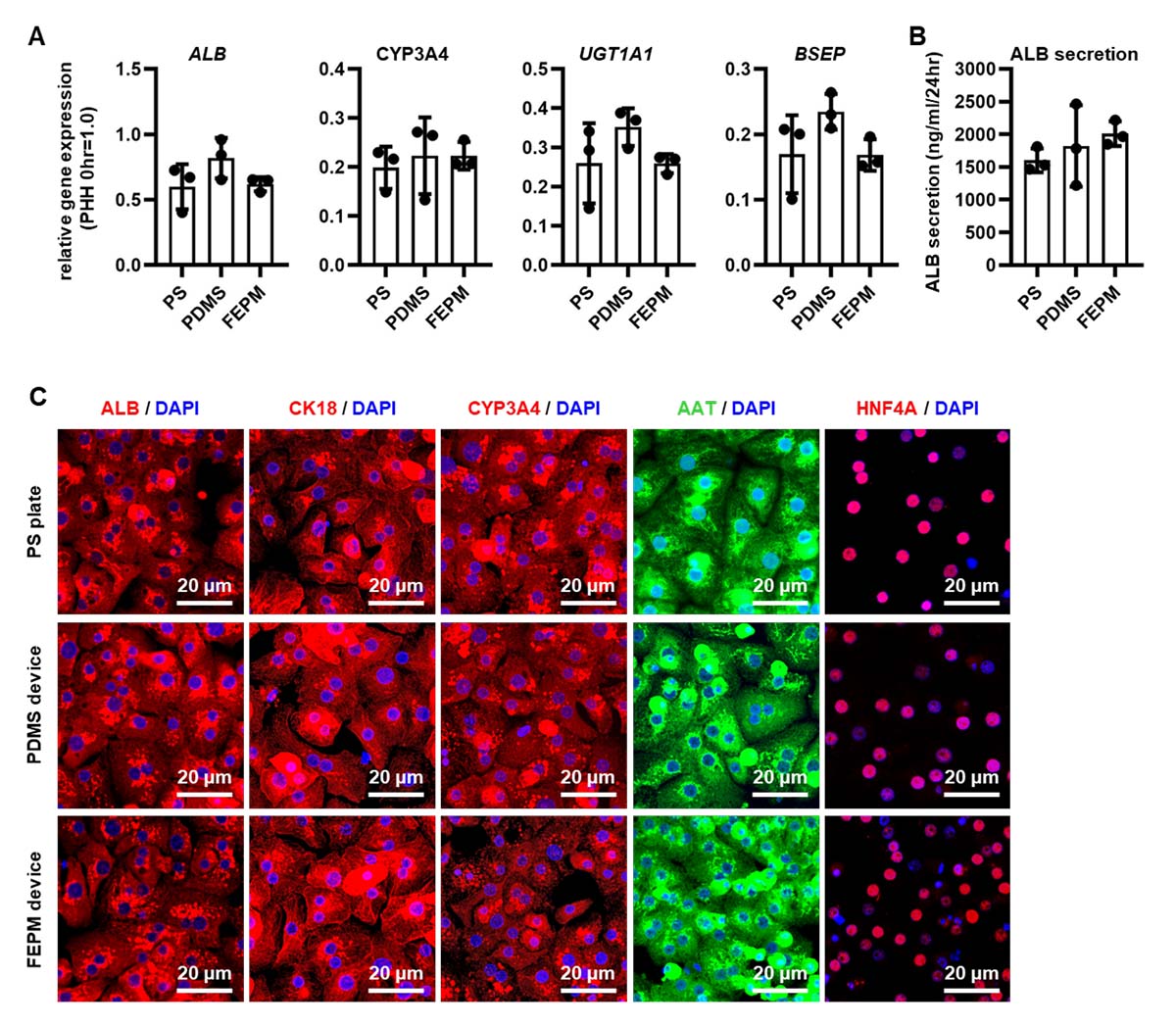
(図2A)PS製プレート及びPDMS製、FEPM製デバイスで培養したヒト肝細胞における肝細胞
マーカーの遺伝子発現解析。
(図2B)PS製プレート及びPDMS製、FEPM製デバイスで培養したヒト肝細胞におけるALB、CK18、CYP3A4、AAT、HNF4Aの免疫染色結果。DAPI(青)で核染色。
3) PDMS製およびFEPM製肝臓チップを用いた薬物毒性試験および薬物代謝試験
当研究グループでは過去にFEPM製デバイスはPDMS製デバイスに比べて、薬物が収着しづらいことを報告しています。そこで、FEPM製肝臓チップが医薬品の毒性試験や代謝試験に使用可能か検討しました。まず、PDMS製デバイスに収着されやすいクマリンによって誘発される肝細胞毒性試験を行いました。クマリンは食品中にも含まれる物質で、過剰量摂取すると肝障害を誘発することが知られています。そこで、PS製プレートまたはPDMS製デバイス、FEPM製デバイスで培養したヒト肝細胞にクマリンを様々な濃度で作用させ、細胞生存率を測定しました(図3A)。FEPM製デバイスにおけるヒト肝細胞の生存率は、PS製プレートのヒト肝細胞の生存率と差がありませんでした。一方で、PDMS製デバイスにおけるヒト肝細胞の生存率は、PS製プレートにおけるヒト肝細胞の生存率よりも高く、肝細胞毒性が生じにくいことが示唆されました。次に、ミダゾラム(MDZ)およびブフラロール(BUF)を用いた薬物代謝試験を行いました。MDZおよびBUFはそれぞれCYP3A4およびCYP2D6の活性測定に使用される薬物です。そこで、PS製プレートまたはPDMS製デバイス、FEPM製デバイスで培養したヒト肝細胞にMDZおよびBUFを作用させ、代謝物の産生量を高速液体クロマトグラフ質量分析計(HPLC-MS/MS)により測定しました。PDMS製デバイスおよびFEPM製デバイスにおけるMDZ濃度は、それぞれPS製プレートの5.23%、86.2%に維持されました(図3B)。PDMS製デバイスおよびFEPM製デバイスにおけるBUF濃度はそれぞれPS製プレートの2.18%、37.2%に維持されました(図3B)。図3Cはそれぞれの代謝物生成量を測定した結果です。PDMS製デバイスで培養した肝細胞における1-水酸化ミダゾラム(1OH-MDZ;CYP3A4によるミダゾラム代謝物)産生量は、PS製プレートで培養した肝細胞の2.16%でしたが、FEPM製デバイスで培養した肝細胞では30.38%でした。同様に、1-水酸化ブフラロール(1OH-BUF;CYP2D6によるブフラロール代謝物)の産生量は、PDMS製デバイスで14.75%、FEPM製デバイスで69.9%でした。これらの結果から、FEPM製肝臓チップはPDMS製肝臓チップよりも低分子化合物の代謝物をより高感度に検出可能であることが分かりました。
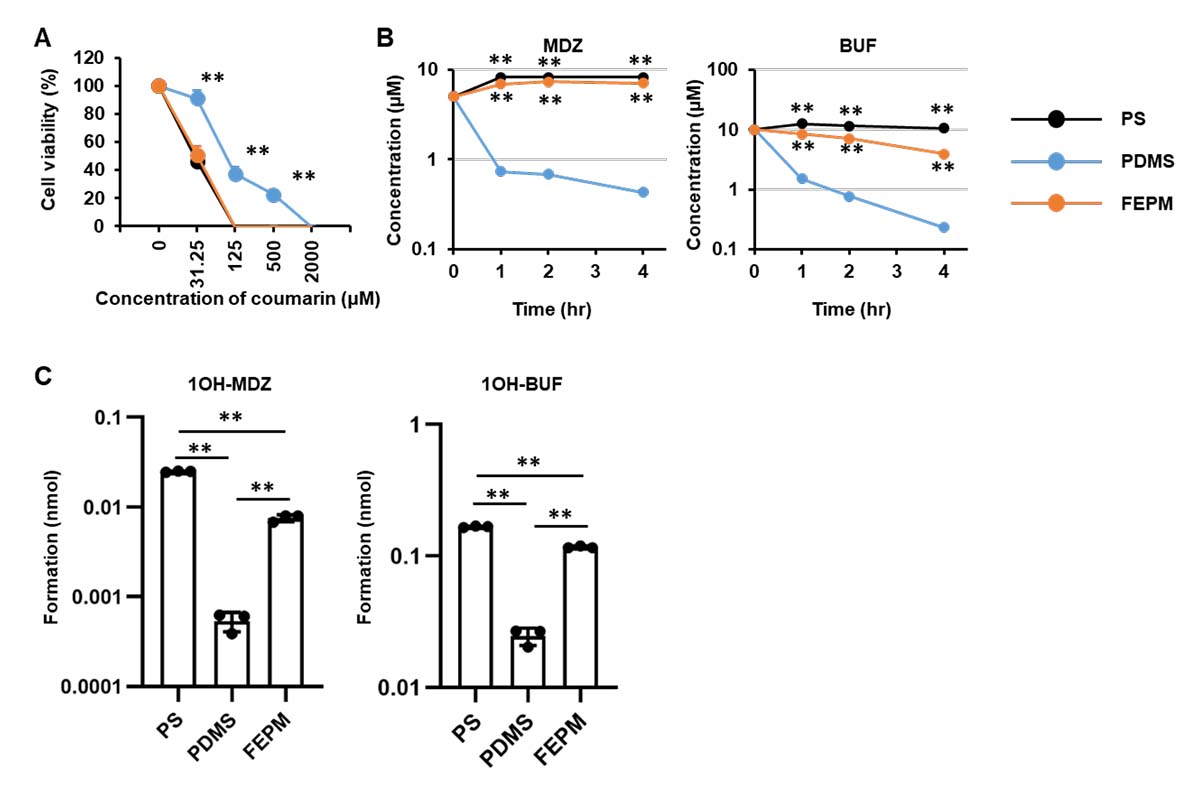
(図3A)PS製プレート及びPDMS製、FEPM製デバイスで培養したヒト肝細胞に対し、様々な濃度でクマリンを作用させ、細胞生存率を測定した。
(図3B、C)MDZおよびBUFを含む培地をPDMS製デバイスまたはPS製プレートに添加し、1、2、4時間後に上清を回収し、培地中のMDZおよびBUF濃度(B)、および各代謝物(1OH-MDZおよび1OH-BUF)の濃度(C)を測定した。
4. まとめ
本研究では、FEPM製デバイスにヒト肝細胞を搭載したFEPM製肝臓チップを作製し、薬物代謝試験や薬物毒性試験を含む創薬研究が実施できるか検討しました。その結果、PS製プレートおよびPDMS製デバイス、FEPM製デバイスで培養したヒト肝細胞の間で肝機能に差異ありませんでした。また、FEPM製デバイス を用いて、PDMS製デバイスに収着されやすいクマリンによる細胞毒性を高感度に検出可能であることを示しました。同様に、FEPM製デバイスを用いて、PDMS製デバイスに収着されやすいMDZおよびBUFを用いた薬物代謝試験を実施可能であることを示しました。薬を収着しづらいFEPM製デバイスを用いたOrgans-on-a-chip技術が創薬研究に活用されることを期待します。
5. 論文名と著者
- 論文名
Generation of Tetrafluoroethylene-Propylene Elastomer-Based Microfluidic Devices for Drug Toxicity and Metabolism Studies - ジャーナル名
ACS Omega - 著者
Emi Sano1,2,*, Sayaka Deguchi1,3,*, Naoki Matsuoka4, Masahiro Tsuda5, Mengyang Wang5, Kaori Kosugi1,2, Chihiro Mori2, Keisuke Yagi4, Aya Wada4, Shinsuke Yamasaki4, Tsuyoshi Kawai4, Masahide Yodogawa4, Hiroyuki Mizuguchi3, Norihito Nakazawa4, Fumiyoshi Yamashita5, Yu-suke Torisawa2**, Kazuo Takayama1**
*:筆頭著者
**:責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 京都大学大学院工学研究科
- 大阪大学大学院薬学研究科
- AGC株式会社
- 京都大学大学院薬学研究科
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 京都大学iPS細胞研究基金
- 国立研究開発法人日本医療研究開発機構(AMED)
再生医療・遺伝子治療の産業化に向けた基盤技術開発事業
再生医療技術を応用した創薬支援基盤技術の開発
7. 用語説明
注1) ポリジメチルシロキサン(PDMS)
マイクロ流体デバイス作製に汎用されているシリコーン・エラストマーの一種。PDMSと呼ばれる。
注2) マイクロ流体デバイス
自在に幅と深さを設計した微小流路を持つ細胞培養装置。
注3) エラストマー
ゴム弾性をもった高分子化合物のこと。
注4) テトラフルオロエチレン-プロピレン(FEPM)
フッ素ゴムの一種で、テトラフルオロエチレン(TFE)とプロピレン(P)との共重合体を基本骨格とする。耐熱性、耐油性、耐薬品性、および電気絶縁性に優れた素材。
注5) ポリスチレン(PS)
プラスチック樹脂。スチロール樹脂とも呼ばれる。細胞培養のためのディッシュやマルチウェルプレートの素材として広く使用されている。
注6) 薬物代謝酵素
薬物などの異物の代謝(分解・排出しやすくするなど)を行う酵素。シトクロムP450(CYP)が代表的な酵素群。CYP3A4やCYP2D6など様々な種類の酵素がある。