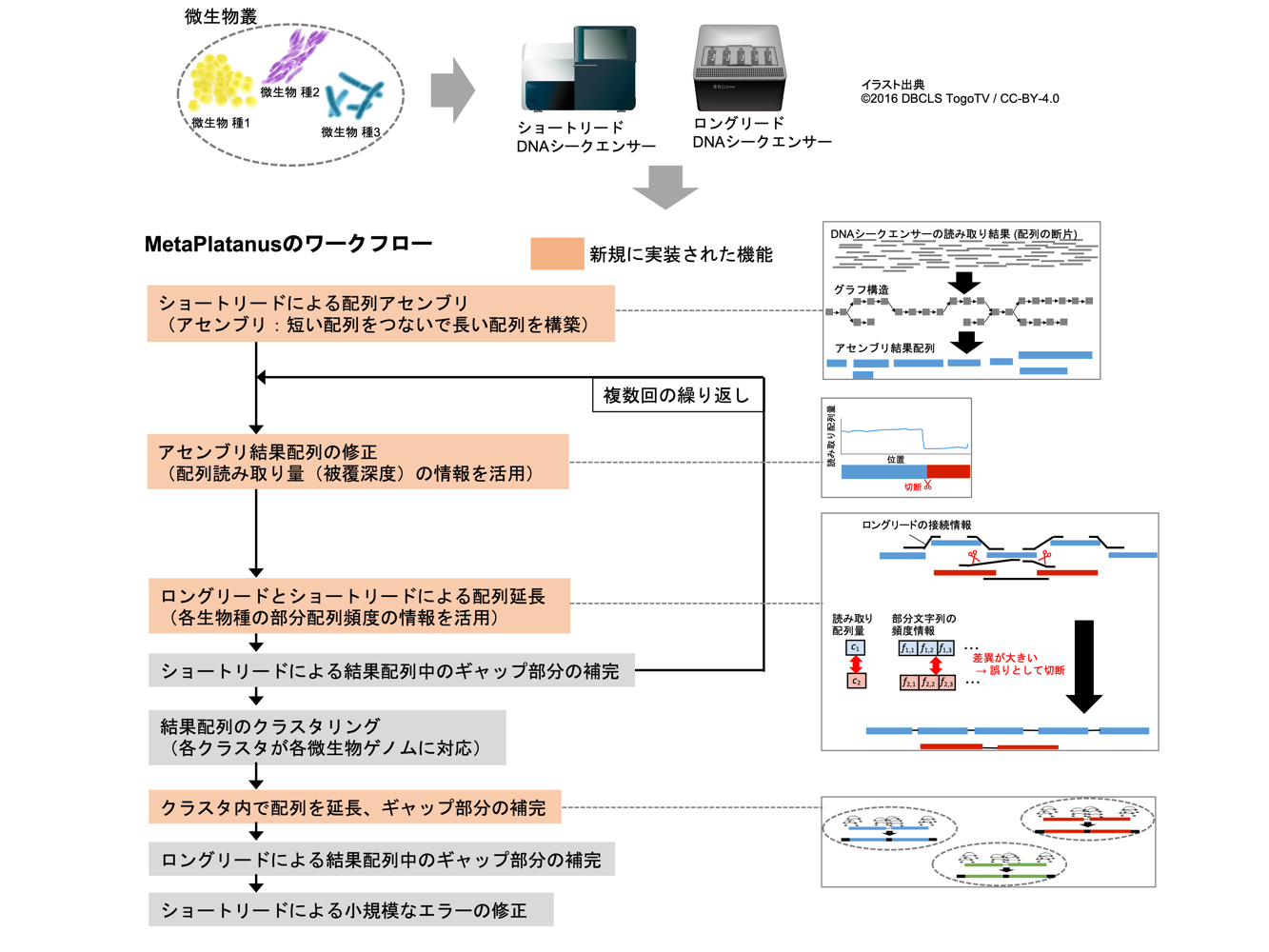
2021-11-01 生命創成探究センター
神戸大学バイオシグナル統合研究センターの蜷川暁助教(旧京都大学特定助教) 京都大学大学院理学研究科のGinto George研究員、岡田徹也助教、森和俊教授、名古屋市立大学大学院薬学研究科の矢木宏和准教授、自然科学研究機構生命創成探究センターの加藤晃一教授(名古屋市立大学 教授兼任)、国立医薬品食品衛生研究所の橋井則貴室長、石井明子部長、大阪大学大学院理学研究科の真木勇太助教、梶原康宏 教授、北海道大学大学院医学研究院の古川潤一准教授らの共同研究グループは、小胞体における糖鎖のマンノース*1切除酵素を精製してその活性を同定することに成功しました。
この成果は、小胞体の構造異常糖タンパク質を分解する小胞体関連分解の深い理解につながります。小胞体関連分解は、アルツハイマー病などの60以上ものヒト疾患と関わるため、本研究成果は、それらの新規治療戦略や予防法の提案の礎となります。
この研究成果は、2021年10月26日に国際学術誌 eLife に掲載されました。
小胞体における構造異常糖タンパク質分解メカニズムの解明〜糖鎖の分解シグナルはどのように露出するか?
研究の背景
全タンパク質の約1/3が生合成される小胞体では、タンパク質の厳密な品質管理が行われており、不要なタンパク質や構造を形成していない異常タンパク質は分解処分されます。小胞体におけるタンパク質の分解は、N型糖鎖*2を持つタンパク質(糖タンパク質)を処分する糖鎖依存分解経路と、糖鎖の構造に依存せずタンパク質を処分する糖鎖非依存分解経路の2つに大別されます。糖鎖依存分解経路では、糖鎖に含まれる9個のマンノースが7個以下へと段階的に刈り込みされることによって、最終的に分解シグナルが露出します。この分解シグナルは、レクチン*3分解因子によって認識され、このことによって構造異常糖タンパク質は分解へと導かれます。本研究グループは、このマンノース刈り込みは第一段階としてEDEM2とTXNDC11がジスルフィド結合を介して結合したEDEM2-S-S-TXNDC11複合体によって開始され、第二段階としてEDEM1もしくはEDEM3によって完了されることを明らかにしていました (Ninagawa et al., JCB, 2014; Geroge et al., 2020 eLife)。ただし、EDEM2-S-S-TXNDC11複合体のin vitro*4活性を示すことはできていましたが、精製EDEM1やEDEM3が単独でin vitro酵素活性を示すのかどうか、またどのような糖鎖フォームへと刈り込むのか詳しくわかっていませんでした。
研究の内容
そこで研究グループは、EDEM1、EDEM2-S-S-TXNDC11、EDEM3をそれぞれ精製し、マンノース刈り込みの第二段階のモデル基質である遊離糖鎖M8Bと反応させました。すると、細胞内においてM9を切除し、M8Bを切除しないEDEM2-S-S-TXNDC11複合体は、細胞内の結果から予想される通りM8Bとはあまり反応しませんでした。一方で精製EDEM1、EDEM3は、M8BをM7、M6、M5へと変換しました。M8Bから糖鎖切除が起こったほとんどの糖鎖は、分解シグナルを呈示していました。またEDEM3の方がEDEM1に比較して、強い酵素活性を発揮していました。

次に、3つN型糖鎖を持つ可溶性タンパク質CD3d-ΔTMとATF6a(C)をEDEM1/3-DKO細胞に発現させ、M8B型の糖鎖をもつ精製CD3d-ΔTMやATF6a(C)を得ました。そしてこれらを精製EDEM1もしくはEDEM3と反応させるとM7、M6、M5への糖鎖の切除が確認されました。この反応においてもEDEM3の方がEDEM1よりも酵素活性が強く検出されました。EDEM2がTXNDC11と複合体を形成しないと酵素活性が検出できなかったことに対して、本研究によって精製EDEM3、精製EDEM1は、それぞれ単独で酵素活性を発揮し、N型糖鎖の分解シグナルを露出させることがわかりました。
今後の展開
小胞体内において、合成されたタンパク質を構造形成させる機構に並んで、構造異常タンパク質を分解する機構は、小胞体の恒常性を維持するためにとても重要であることがわかっています。これがうまく機能できない遺伝子破壊マウスでは、致死になったり、非アルコール性脂肪肝炎(肝臓に炎症が起こる病気)やリウマチなどになったりします。そして小胞体の分解機構は、アルツハイマー病などの60以上ものヒト疾患と関わることも分かっているため、さまざまなヒト疾患に対する新規治療戦略や予防法の提案の礎となります。またこの分解機構は、酵母からヒトまで共通した基本的なシステムが保存されていることから、生命体維持のための分子メカニズムのベースのひとつ理解が本研究によって進んだと考えています。
用語解説
*1 マンノース
N型糖鎖のコア構造を形成する単糖の一種。
*2 N型糖鎖
小胞体を通過する80%程度のタンパク質を修飾する。これは、3つのグルコース、9つのマンノース、2つのN-アセチルグルコサミンからなる。小胞体内において、糖鎖は一部切除される。
*3 レクチン
一定の構造を持つ糖鎖を識別し、結合するタンパク質の総称。
*4 in vitro
試験管内などの人工的に構成された環境下を示す。
謝辞
本研究は下記機関より資金的支援を受けて実施されました。
・JSPS科研費 JP18K06216、JP17H06414、JP21H02625、JP19K06658、JP20K21495、JP18K06110、JP17H01432、JP17H06419
・公益財団法人 武田科学振興財団
・公益財団法人 小林財団
掲載論文
雑誌名:eLife
論文タイトル:
“Purified EDEM3 or EDEM1 Alone Produces Determinant Oligosaccharide Structures from M8B in Mammalian Glycoprotein ERAD”
著者:
Ginto George†, Satoshi Ninagawa†, Hirokazu Yagi , Jun-ichi Furukawa, Noritaka Hashii, Akiko Ishii-Watabe, Ying Deng, Kazutoshi Matsushita, Tokiro Ishikawa, Yugoviandi P. Mamahit, Yuta Maki, Yasuhiro Kajihara, Koichi Kato, Tetsuya Okada* and Kazutoshi Mori*
公表日:日本時間2021年11月4日19時
本件に関するお問い合わせ先
報道について
自然科学研究機構 生命創成探究センター 研究連携推進室