2021-11-15 国立がん研究センター,名古屋大学,大阪大学,九州大学九州大学病院,日本医療研究開発機構
発表のポイント
- TMB が高い肺がんでも、PD-1阻害薬(注1)に抵抗性になるメカニズムを世界で初めて解明しました。
- これまで免疫療法が効きやすいと考えられていた体細胞変異数 (Tumor mutation burden: TMB)(注2)が高い肺がんの一部で、WNT/βカテ二ン経路(注3)が活性化されることにより、CD8 陽性細胞傷害性T細胞 (CD8 陽性CTL)(注4)のがん組織への浸潤が抑制されていることを明らかにしました。
- WNT/βカテ二ン経路阻害薬とPD-1阻害薬の併用により著明な治療効果が認められることを、マウスモデルにて明らかにしました。今後、肺がんの新たな治療戦略を確立するため、臨床試験に展開していくことを目指します。
概要
国立研究開発法人国立がん研究センター (理事長:中釜 斉、東京都中央区、以下国立がん研究センター) 研究所/先端医療開発センターと名古屋大学、大阪大学、九州大学などの研究チームは、体細胞変異数 (Tumor mutation burden: TMB)が高い非小細胞肺がんの一部で、WNT/βカテ二ン経路の活性化がPD-1阻害薬の治療抵抗性に関与していることを明らかにしました。今後、肺がんの新たな治療戦略を確立するため、臨床試験に展開していくことを目指します。
免疫チェックポイント阻害薬を用いた免疫療法は、日本においては2014年に悪性黒色腫で保険適用されて以降、肺がんを含む様々ながん種の治療に用いられていますが、治療効果の認められる患者さんが2~3割と少ないことから、治療抵抗性メカニズムの解明とそれに基づく新たな治療法の開発が求められています。
本研究では、TMBが高く非自己抗原が豊富な非小細胞肺がんの網羅的な遺伝子発現および免疫解析から、TMBが高いにも関わらず免疫細胞浸潤に乏しい肺がんの一群を発見しました。このような肺がんでは、血中にがん細胞を認識するCD8陽性細胞傷害性T細胞(CD8陽性CTL)が多数存在するにも関わらず、肺がん組織内には浸潤できないことが明らかになりました。また遺伝子発現解析の結果、WNT/βカテ二ン経路が活性化することでCCL4(注5)の発現が低下し、CTL浸潤が抑制されていることを解明しました。
さらに、PD-1阻害薬の単剤療法では効果が認められないものの、WNT/βカテ二ン経路阻害薬を併用することで、がん組織内にCD8陽性CTLの浸潤が回復し著明な治療効果が認められることを、マウスモデルにて明らかにしました。
本研究は、国立研究開発法人国立がん研究センター 研究所 腫瘍免疫研究分野/先端医療開発センター 免疫TR分野 西川博嘉 分野長(名古屋大学大学院医学系研究科 微生物・免疫学講座 分子細胞免疫学 教授併任)と、大阪大学大学院医学系研究科 呼吸器・免疫内科学分野 熊ノ郷 淳 教授、九州大学大学院医学研究院 泌尿器科学分野 江藤正俊 教授らの研究チームで実施しました。また、研究の一部は小野薬品工業株式会社との共同研究として実施されました。
なお本研究成果は、米国科学雑誌「Science Immunology」に、日本時間2021年11月13日付けで掲載されました。
背景
免疫療法(注6)は様々ながん種において治療効果を発揮し、幅広く臨床現場で使用されています。特にPD-1阻害薬は、免疫療法の中でも最も広く用いられています。大規模臨床試験やこれまでの複数の基礎研究によって、PD-1阻害薬は、一般的にTMBが高いがんに対して有効性が高いことが示されています。その一方で非小細胞肺がんにおいては、TMBが高いことだけが、PD-1阻害薬の治療効果予測のバイオマーカーにはならないことが示されていました。また、TMBが高く非自己抗原が豊富な非小細胞肺がんにおいて、PD-1阻害薬に抵抗性となる機序やその場合の有効な治療法はこれまで明らかになっていませんでした。
研究方法・成果
TMBが高いにも関わらず、がん組織内での免疫応答が乏しいがんの特徴を捉えるために、The Cancer Genome Atlas (TCGA)(注7)に登録されている230例の非小細胞肺がん遺伝子発現データベースを解析しました。その結果、TMBの高い非小細胞肺がんでは、WNT/βカテ二ン経路の活性化が免疫応答の活性化と逆相関することが示されました。
非小細胞肺がんにおけるWNT/βカテ二ン経路の活性化が、どのようにがん細胞に対する免疫応答に影響するかを詳細に調べるため、国立がん研究センター東病院および大阪大学医学部附属病院の22例の非小細胞肺がん症例から得られた検体を解析しました。その結果TMBが高い群は、非小細胞肺がん組織内の免疫細胞の浸潤を示すスコアが低い一方で、WNT/βカテ二ン経路の活性化を示すスコアが高いことが分かりました。つまり、230例のデータベース解析と同様の所見が22例の検体においても確認されたことになります(図1)。さらに、TMBが高いにも関わらず、がん組織では免疫応答に乏しい非小細胞肺がんにおいて、末梢血液中のCD8 陽性CTLを評価したところ、がん細胞の遺伝子変異に由来するがん抗原を認識し、免疫応答が強く誘導されることが確認されました。
その結果、TMBが高くWNT/βカテ二ン経路が活性化した非小細胞肺がんでは、末梢血液中にはCD8 陽性CTLが豊富に存在するにも関わらず、がん組織内には浸潤できず、それによってPD-1阻害薬に抵抗性となることが明らかになりました。
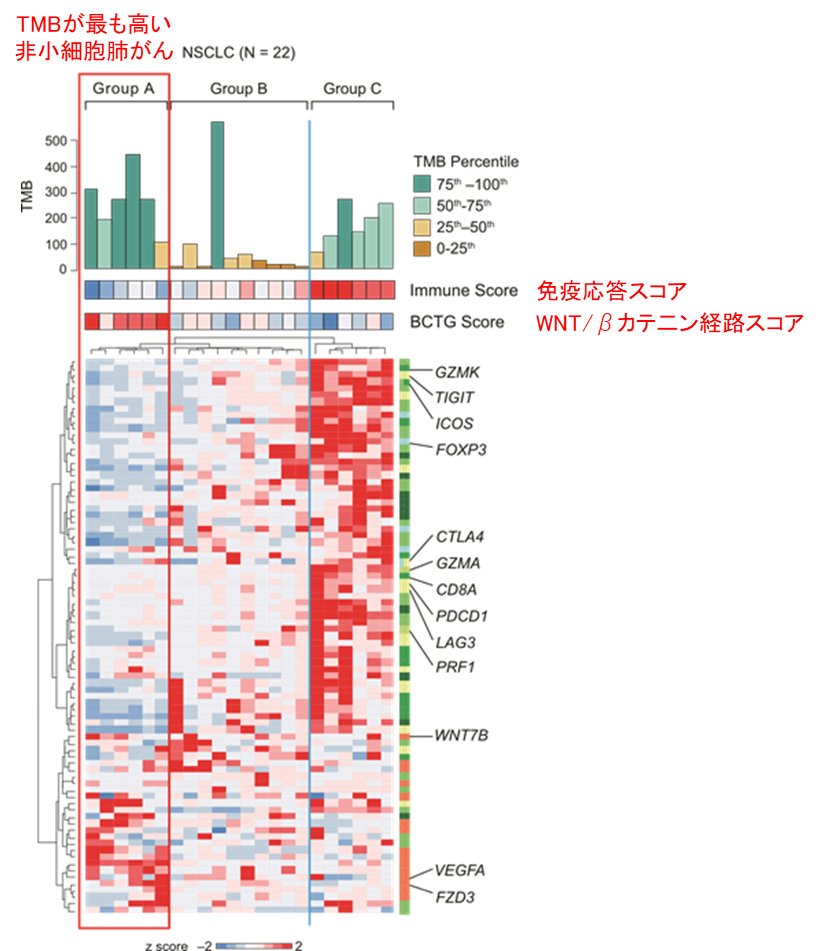
図1:非小細胞肺がんの22例を、フローサイトメトリー、RNAシークエンス、全エクソームシークエンスを用いて解析したところ、TMB が最も高いグループ (赤い四角) では、免疫細胞の浸潤や活性化がむしろ低下していることが分かりました。
次にマウスモデルにおいて、TMBが高くなることによりWNT/βカテ二ン経路が活性化するのか、さらに、その活性化によって免疫細胞の浸潤がどのように影響を受けるのか検証を進めました。がん細胞株に、薬剤によってTMBを蓄積させ、薬剤投与期間の違いを用いて3段階のTMBのがん細胞株を作成し、野生株、中等度変異株、高度変異株に分類しました。
2種の変異株の細胞増殖および遺伝子発現を網羅的に解析して野生株と比較検討したところ、高度変異株は、中等度変異株よりもがんの増殖速度が遅く、WNT/βカテ二ン経路が活性化されていることを見出しました(図2)。またがん組織内の免疫細胞を解析すると、CD8陽性CTLやその活性化に重要な抗原提示細胞(注8)が、高度変異株では有意に減少しており、その要因としてWNT/βカテ二ン経路の活性化に伴うCCL4の発現の低下が関わることを明らかにしました。高度変異株のがん細胞を移植したマウスを、WNT/βカテ二ン経路阻害薬で治療したところ、がん組織内への免疫細胞の浸潤が回復し、それに伴いCD8陽性CTLの増加が認められました。
以上より、TMBが高いがんでは、通常は遺伝子変異に由来するがん抗原に対する免疫応答が誘導されてがん増殖の阻害が起こるものの、遺伝子変異を蓄積する過程でWNT/βカテ二ン経路が活性化されると、CD8陽性CTLのがん組織内への浸潤が妨げられることにより、がん増殖が起こることを解明しました。
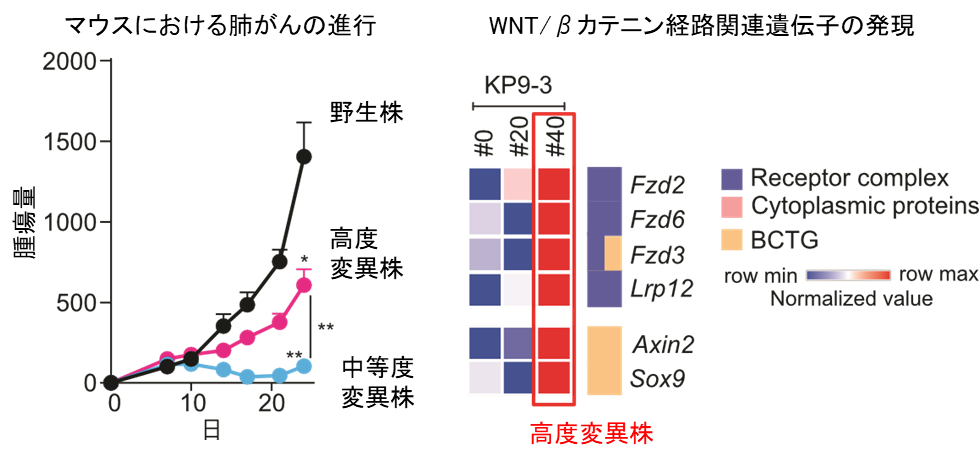
図2:(左)中等度変異株と比べて、高度変異株株ではよりがんが増殖しました
(右)高度変異株ではWNT/βカテニン経路が活性化されていることが分かりました
次に、これらのがんに対するWNT/βカテ二ン経路の阻害による治療効果を検討するために、TMBが高頻度で見られる大腸がんおよび肺がん細胞株を接種したマウスを下記3種の方法で治療しました。
- WNTβ/カテニン経路阻害薬単剤
- PD-1阻害薬単剤
- WNTβ/カテニン経路阻害薬とPD-1阻害薬の併用
検証の結果、それぞれの単剤療法では限定的な治療効果しか認められなかったのに対し、併用療法では、いずれのがんモデルでも完全にがんが消失しました。以上から、WNT/βカテ二ン経路が活性化した高度変異を伴うがんでは、WNT/βカテ二ン経路阻害薬とPD-1阻害薬の併用によって、高い治療効果が得られることが示唆されました(図3)。
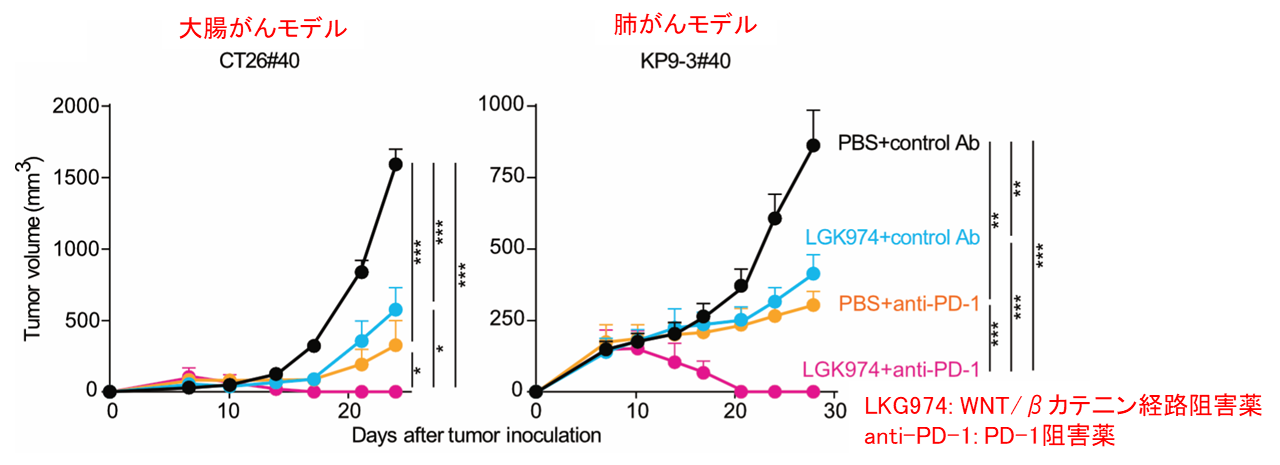
図3:大腸がんおよび肺がん細胞株を用いて、WNTβ/カテニン経路阻害薬・PD-1阻害薬の単剤および併用療法を比較したところ、併用療法でより高い治療効果が得られました。
展望
本研究成果により、TMBの高い非小細胞肺がんの一部では、WNT/βカテ二ン経路阻害薬とPD-1阻害薬の併用によって、免疫療法の治療抵抗性を克服できることが期待されます。今後、がん患者さんを対象とした臨床開発への検討を重ね、新たな治療法の選択肢となることを目指します。
発表論文
雑誌名
Science Immunology
タイトル
Highly Immunogenic Cancer Cells Require Activation of the WNT Pathway for Immunological Escape
著者
Yoshiko Takeuchi, Tokiyoshi Tanegashima, Eiichi Sato, Takuma Irie, Atsuo Sai, Kota Itahashi1 Shogo Kumagai, Yasuko Tada, Yosuke Togashi, Shohei Koyama, Esra A. Akbay, Takahiro Karasaki, Keisuke Kataoka, Soichiro Funaki, Yasushi Shintani, Izumi Nagatomo, Hiroshi Kida, Genichiro Ishii, Tomohiro Miyoshi, Keiju Aokage, Kazuhiro Kakimi, Seishi Ogawa, Meinoshin Okumura, Masatoshi Eto, Atsushi Kumanogoh, Masahiro Tsuboi and Hiroyoshi Nishikawa.
DOI
10.1126/sciimmunol.abc6424
掲載日
2021年11月12日
研究費
文部科学省
科学研究費助成事業 基盤研究(S)
「発がんの人種差と免疫応答の関わりの解明」
国立研究開発法人日本医療研究開発機構(AMED)
次世代がん医療創生研究事業
「がん細胞および免疫応答解析に基づくがん免疫療法効果予測診断法の確立」
次世代治療・診断実現のための創薬基盤技術開発事業
「患者層別化マーカー探索技術の開発/がん免疫モニタリングによる患者層別化を行う基盤技術の開発」
国立がん研究センターがん研究開発費
28-A-7「先端的がん免疫モニタリング法開発体制に関する研究」
31-A-7「がん免疫療法抵抗性を解除する新規治療法の臨床展開に向けた開発研究」
一部の解析については小野薬品工業株式会社から支援を受けました。
用語解説
注1 PD-1阻害薬
PD-1 は免疫細胞上に発現する免疫チェックポイント分子であり、樹状細胞やがん細胞に発現する PD-L1 や PD-L2 と結合することで、免疫細胞の働きを抑制する。PD-1阻害薬治療により PD-1が PD-L1 と結合しなくなることで、免疫細胞が本来の働きを取り戻し、がん細胞を攻撃するようになると考えられている。
注2 体細胞変異(Tumor mutation burden: TMB)
体細胞変異とは、遺伝的なDNAの変異とは異なり、分化や生育の過程で後天的に獲得したDNA変異のことを指す。がんの原因となる体細胞変異(ドライバー遺伝子変異)を特定することもできる。
注3 WNT/βカテ二ン経路
胚発生とがん増殖に関わるシグナルネットワークで、細胞の増殖や分化など多様な機能を果たす。様々ながん種において、WNT/βカテ二ン経路が活性化していることが知られている。
注4 CD8陽性細胞障害性T細胞
リンパ球T細胞のうちの一種で、異物になる細胞(ウイルス感染細胞、がん細胞など)を認識して破壊する。キラーT細胞とも呼ばれる。
注5 CCL4(C-Cケモカインリガンド4)
免疫細胞(単球、B細胞、T細胞)など多種多様な細胞によって産生され、炎症および免疫調節において重要な役割を果たす。
注6 免疫療法
生体内の免疫細胞ががん細胞を異物として認識し、攻撃することを利用したがん治療法。従来の標準治療法として知られている化学療法・外科的治療・放射線療法よりも副作用が少なく長期的な治療効果が期待できることから、近年大きな注目を集めている。
注7 The Cancer Genome Atlas (TCGA)
2006年から米国で開始された大型がんゲノムプロジェクト。20種類以上のがん種について、ゲノム・メチル化異常、遺伝子・タンパク質発現異常について網羅的な解析を行っている。
注8 抗原提示細胞
体内に侵入してきた細菌やウイルス感染細胞などの断片を抗原として自己の細胞表面上に提示し、T細胞を活性化する細胞。
問い合わせ先
研究に関する問い合わせ
国立研究開発法人 国立がん研究センター
研究所 腫瘍免疫研究分野/先端医療開発センター 免疫TR分野 西川博嘉
取材・報道関係からのお問い合わせ
国立研究開発法人 国立がん研究センター
企画戦略局 広報企画室(柏キャンパス)
国立大学法人 東海国立大学機構 名古屋大学
大学院医学系研究科 総務課総務係
大阪大学 大学院
医学系研究科 広報室
国立大学法人 九州大学
九州大学病院 総務課広報室
AMED事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課 次世代がん医療創生研究事業