2021-11-22 東京大学医学部附属病院,日本医療研究開発機構
概要
担がん患者は元来易感染状態で感染症の発症リスクが高いため、がんに対して化学療法を行うと、血球減少による感染症の発症が大きな問題となります。高度顆粒球減少症例の感染症治療は、現在の抗生剤治療、G-CSF製剤といった補助療法でも困難であることから、顆粒球減少期の重症感染症に対する新たな対策が必要です。顆粒球輸注療法(granulocyte transfusion therapy;GTX)はその一つの有力な候補ですが、ドナーへの負担などもあって広く臨床応用されるには至っていません。
東京大学大学院医学系研究科の黒川峰夫教授らの研究グループは、この問題を解決するために、ヒトiPS細胞に複数の遺伝子を導入し、培養条件を最適化することによってiPS細胞から顆粒球を大量産生する新規技術を開発し、迅速に十分量の顆粒球を供給できる基盤を確立することに成功しました。また、この顆粒球を感染症発症マウスに投与して解析した結果、生体内において感染症治療に効果があることを示しました。
本成果は、2021年9月29日に米国血液学会の国際学術誌「Blood」にオンライン掲載されました。
概念図
背景
担がん患者は免疫能が低下していることに加えて、抗癌剤治療や造血幹細胞移植後などによる骨髄抑制期に、細菌もしくは真菌感染による発熱性好中球減少症(FN:Febrile Neutropenia)を高率に生じます。高度の好中球減少を来した症例では抗菌薬・抗真菌薬治療が奏功しないことも多く、特に高齢者や、起炎菌が多剤耐性菌の場合には依然として致死率が高く、治療法の改善が望まれています。GTXは50年以上前から試みられてきた治療法であり、ドナー顆粒球を体外循環により分取して患者に輸注するという手法が行われてきました。この治療法に関する過去の報告では、1.0×1010cell以上の大量顆粒球輸注が血流感染症の発症を有意に予防することがメタ解析で示されており(Cochrane Database Syst Rev. 2015;2015(6):CD005341)、FNの治療においても、既存治療に対するGTXの上乗せは、0.6×109cell/kg以上の高用量群で死亡率を改善させる傾向が示されています(Blood 2015;126(18):2153-61)。いずれの場合にも、臨床効果を得るためには連日の大量顆粒球輸注が必要ですが、ドナーへの負担の問題から大量の顆粒球の確保は困難であり、GTXが普及しない原因となっています。
iPS細胞はドナーに依存せず、無限に顆粒球を供給することが可能であることから、この問題を解決できると考えられました。そこで、研究グループはヒトiPS細胞から誘導した顆粒球を用いたドナーフリーの細胞療法(iPS-GTX)の樹立を目指し、研究に着手しました。
研究成果
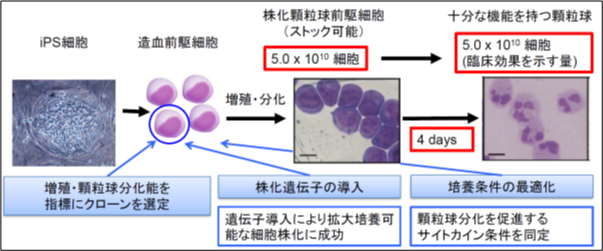
顆粒球の安定供給基盤の構築
研究グループはこれまでに、iPS細胞にc-MYC、BMI-1という2種類の増殖促進遺伝子をドキシサイクリン依存性に導入し、またTPO、SCF、FLT3-L、G-CSFといった血球系の分化増殖に重要なサイトカインの組合せをいくつかの条件で比較検討することにより、顆粒球を速やかに産生する拡大培養可能な顆粒球前駆細胞株を樹立していました。しかし、この条件では10-12週で増殖が止まり、臨床応用に十分な量の顆粒球が得られませんでした(図1左)。この度の研究開発ではこの大量産生基盤を活用し、さらなる長期間の増殖基盤の構築を目指しました。
そこで研究グループはBCL-2 familyというアポトーシス抑制遺伝子群に着目し、その一つであるBCL-XLという遺伝子を新たに導入することによって、増殖速度が上がり、かつ一年以上の長期間にわたって増殖し続ける細胞株の樹立に成功しました(図1右)。また、この前駆細胞株において、ドキシサイクリンを培地から除去することによって導入遺伝子の発現が速やかに減少し、4日後に成熟した顆粒球に分化することを確認しました。
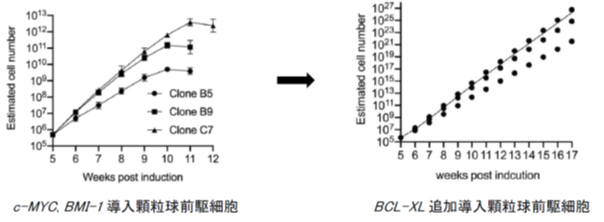
図1 BCL-XL追加導入後の増殖曲線
顆粒球機能の評価
ヒト顆粒球が感染症を制御するためにはいくつかのステップが必要となります。血管内を流れている顆粒球は、まず炎症部位の近くの血管壁に接着し(接着能)、次に血管壁をすり抜けて血管外の炎症部位に遊走し(遊走能)、病原体を貪食して細胞内に取り込み(貪食能)、そして殺菌する(殺菌能)ことで感染症を制御します。研究グループは、これらの各段階での機能を測定するアッセイ系を用いてiPS細胞由来顆粒球と正常のヒト好中球を比較し、同等の機能を有することを確認しました。
また、RNAシークエンス解析とよばれる網羅的な遺伝子発現解析を行い、iPS細胞由来顆粒球が正常のヒト好中球に似た遺伝子プロファイルを有することや、細菌の成分であるLPSを顆粒球に投与することで、活性化シグナルであるMAPキナーゼ経路やNFκB経路が活性化することを確認しました。
マウス生体内における遊走能の解析
続いて、生体内での挙動を詳しく評価するために、マウスに投与して実験を行いました。まず、iPS細胞由来顆粒球が感染巣に遊走することを評価するために、免疫不全マウスの背部に黄色ブドウ球菌の慢性感染巣を作製し、感染の1週間後に、顆粒球を静脈内投与しました。顆粒球にルシフェラーゼという物質を遺伝子導入し、in vivo imaging systemという機械を用いて体内の動態を可視化したところ、静脈内投与して30分後に、感染巣に集積することが確認できました(図2)。
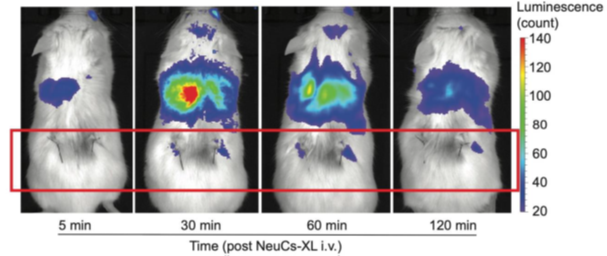
図2 iPS細胞由来顆粒球の感染巣への集積(赤枠内の背部両側に慢性感染巣を作製)
マウス生体内における殺菌能の解析
殺菌能を評価するために、腹腔内にブドウ球菌を投与して重症腹腔感染症を発症したマウスにiPS細胞由来顆粒球を腹腔内投与したところ、生存率を改善させることを示しました(図3)。
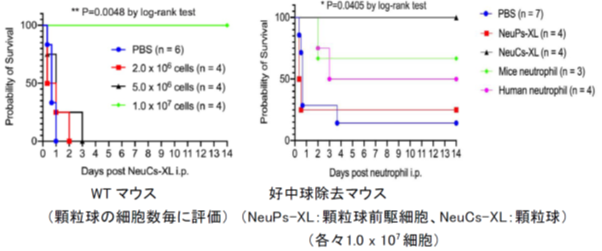
図3 腹腔感染症マウスの生存曲線
マウス生体内における他の免疫細胞への作用
活性化した好中球は、様々なケモカインという因子を産生し、他の免疫細胞を炎症巣に呼び寄せる働きを持っています。iPS細胞由来顆粒球にブドウ球菌を加えて刺激したところ、CCL2、CCL3、CCL4といったマクロファージを呼び寄せる複数のケモカインの産生が亢進することが確認できました。マウスでこの機能を評価するために、マウスの腹腔内にブドウ球菌とiPS細胞由来顆粒球を投与し、6時間後に腹腔内炎症巣に浸潤してきた細胞を解析しました。その結果、iPS細胞由来顆粒球がブドウ球菌によって活性化し、マウスのマクロファージや樹状細胞が有意に増加することが示されました(図4)。以上のことから、iPS細胞から作成した顆粒球がマウスの生体内において有効に機能を発揮することが示されました。
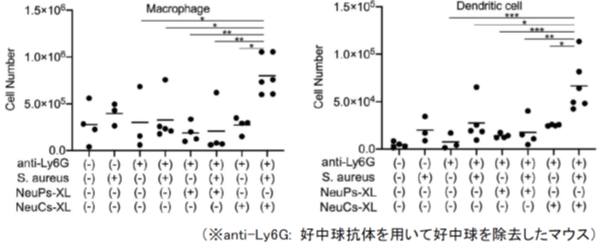
図4 マウス腹腔内浸潤細胞の解析
また、安全面において、免疫不全マウスに顆粒球を投与して体内への残存や腫瘍化のリスクをフォローしましたが、顆粒球は投与後速やかに減少し、48時間後には体内から検出されなくなり、以降3ヶ月にわたって検出されないことを確認しました。
今後の展開
今後、iPS-GTXをFNの治療法として臨床応用するために、①分化期間を短縮させる化合物のさらなる解析、②好中球機能増強による感染症制御の効率向上、③安全性の十分な担保を行い、その上で臨床応用を見据え、実臨床により近い条件下で感染症モデルマウスを用いた治療効果をさらに検証していく必要があると考えています。
研究費
AMED 再生医療実現拠点ネットワークプログラム(技術開発個別課題)
JST センター・オブ・イノベーション(COI)プログラム(拠点名:自分で守る健康社会拠点)
論文書誌情報
- タイトル
- Efficient production of human neutrophils from iPSCs that prevent murine lethal infection with immune cell recruitment
- 著者名
- Masashi Miyauchi, Yusuke Ito, Fumio Nakahara, Toshiya Hino, Fumi Nakamura, Yuki Iwasaki, Taiki Kawagoshi, Junji Koya, Akihide Yoshimi, Shunya Arai, Yuki Kagoya, and Mineo Kurokawa
- 雑誌
- Blood
2021 Sep 29;blood.2021011576. - doi
- 10.1182/blood.2021011576. Online ahead of print.
お問い合わせ先
研究内容に関する問い合わせ先
東京大学医学部附属病院
血液・腫瘍内科 教授 黒川峰夫
報道に関する問い合わせ先
東京大学医学部附属病院
パブリック・リレーションセンター(担当:渡部、小岩井)
AMED事業に関する問い合わせ先
日本医療研究開発機構(AMED)
再生・細胞医療・遺伝子治療事業部 再生医療研究開発課
再生医療実現拠点ネットワークプログラム