がん組織の特徴を利用した新しいがん治療の可能性
2021-12-08 微生物化学研究会がん研究会,日本医療研究開発機構
ポイント
- 微生物化学研究所が単離した新規化合物インターベノリン(intervenolin; ITV)は、ミトコンドリア呼吸鎖(電子伝達系)複合体I(呼吸鎖複合体I)(注1)の阻害剤であることを明らかにしました。
- 呼吸鎖複合体I阻害剤はエネルギー代謝の阻害とは関係なく、細胞内と細胞外の両方の酸性化を誘導することでがん細胞の増殖を抑制することを発見しました。
- 呼吸鎖複合体I阻害剤の腫瘍環境の酸性化による抗がん作用は間質細胞(注2)の存在により増強されることが分かり、間質細胞が豊富な難治がんである膵がんの治療応用に期待が持たれます。
研究の概要
日本医療研究開発機構 次世代がん医療創生研究事業において、微生物化学研究所の川田学部長、吉田潤次郎上級研究員らは、ミトコンドリア呼吸鎖複合体I阻害剤による腫瘍環境の酸性化を介した新しい抗がんメカニズムを解明しました。
呼吸鎖複合体I阻害剤は、これまでがん細胞のエネルギー代謝を阻害することで、がん細胞のエネルギー源であるATPを枯渇させ、抗がん作用を発揮すると考えられてきました。しかし、がん細胞では主要なATP産生を担う代謝経路が様々に変化しているため、エネルギー枯渇を指標とした抗がん剤開発としては、呼吸鎖複合体I阻害剤は必ずしも良い結果が得られていませんでした。
本研究グループは、インターベノリンの作用機序解析の過程で、インターベノリンが呼吸鎖複合体I阻害活性を有することを明らかにしました。さらに、呼吸鎖複合体I阻害剤によって酸化的リン酸化経路が阻害された結果、細胞内における乳酸の蓄積および、細胞外における乳酸分泌が促進され、細胞内外のpHが低下することでがん細胞の増殖が抑制されることを見出しました。この酸性化を介した呼吸鎖複合体I阻害剤の抗がんメカニズムはエネルギー枯渇とは関係なく、化合物による抗がんメカニズムとしては全く新しいものです。また、この酸性化の度合いは、腫瘍内に存在する間質細胞により増強されることから、間質細胞が豊富であることが知られている膵がんに対する創薬研究への応用が期待できます。
本研究は、がん研究会がん研究所およびがん化学療法センター、理化学研究所環境資源科学研究センターとの共同研究で行われました。
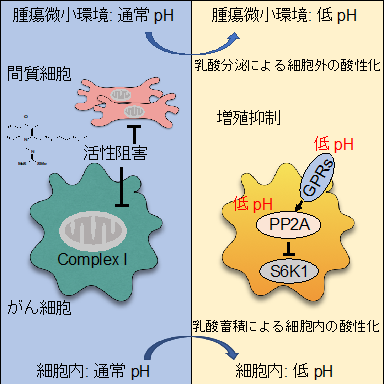
図1 呼吸鎖複合体I(Complex I)阻害剤によって酸化的リン酸化経路が阻害された結果、細胞内における乳酸の蓄積および、細胞外における乳酸分泌が促進され、細胞内外のpHが低下することでがん細胞の増殖が抑制される。
研究の背景
固形腫瘍の組織内はがん細胞だけではなく、様々な細胞、細胞外基質や代謝物が存在しており、このがん細胞を取り巻く環境は腫瘍微小環境と呼ばれ、がん細胞の増殖に重要な働きを担っています。腫瘍微小環境の構築には特に、がん細胞と間質細胞の相互作用が重要であることが以前から知られていましたが、この相互作用を利用した抗がん剤についてはこれまで知られていませんでした。本研究グループでは、このがん細胞と間質細胞の相互作用を化合物によって調節してがん細胞の増殖を抑制できないかと考え、インターベノリンを見出しました。インターベノリンはがん細胞と間質細胞を共培養した際にがん細胞の増殖を強く抑制する活性があることから、インターベノリンは間質細胞存在下で細胞外環境を変化させてがん細胞の増殖を抑制するという抗がんメカニズムが考えられました(図2B)。
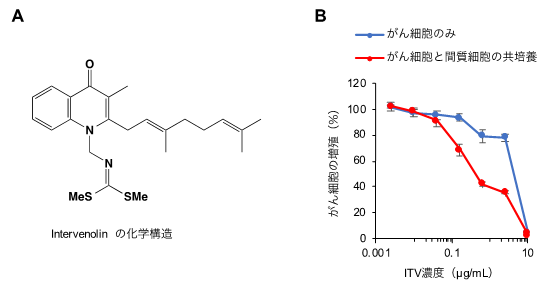
図2 A.インターベノリン(Intervenolin)の化学構造。B.がん細胞単独培養とがん細胞と間質細胞の共培養におけるインターベノリン(ITV)のがん細胞に対する増殖抑制活性。
研究の結果
本研究グループは、インターベノリンの活性を評価し、インターベノリンがミトコンドリア呼吸鎖複合体Iの阻害剤であることを明らかにしました(図3A)。さらに、インターベノリンと他の呼吸鎖複合体I阻害剤を用いて共培養実験を行ったところ、インターベノリンだけでなく他の呼吸鎖複合体I阻害剤も間質細胞存在下でがん細胞の増殖を強く抑制する活性があることがわかりました。
インターベノリンを処理した細胞の代謝を解析した結果、酸化的リン酸化経路が抑制されて解糖系(注3)が亢進し、乳酸の産生が増加していることがわかりました(図3B)。また、低pH条件で呼吸鎖複合体Iを阻害すると、GPR132(注4)のシグナル下でPP2A(注5)によりS6K1(注6)の脱リン酸化が促進されることを突き止めました。このPP2AによるS6K1の脱リン酸化には、乳酸蓄積による細胞内の酸性化も重要であることがわかりました。
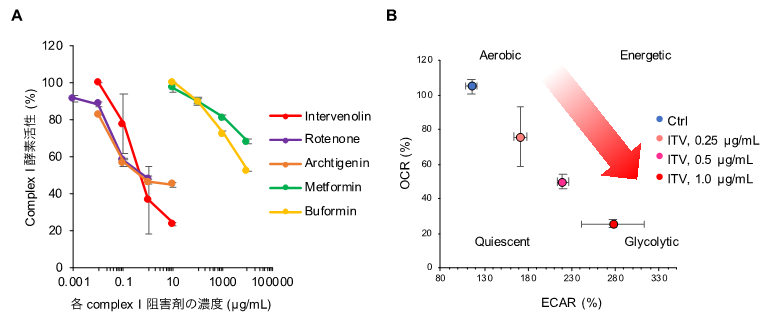 図3 A.がん細胞のミトコンドリア呼吸鎖複合体I(Complex I)に対するインターベノリン(Intervenolin; ITV)と他の呼吸鎖複合体I阻害剤による活性阻害。B.ITV(インターベノリン)は濃度依存的にがん細胞の代謝を酸化的リン酸化経路から解糖系へシフトさせる。OCR(Oxygen consumption rate; 酸素消費速度):酸化的リン酸化の活性の指標。ECAR(Extra-cellular acidification rates; 細胞外酸性化速度):解糖系の活性の指標。
図3 A.がん細胞のミトコンドリア呼吸鎖複合体I(Complex I)に対するインターベノリン(Intervenolin; ITV)と他の呼吸鎖複合体I阻害剤による活性阻害。B.ITV(インターベノリン)は濃度依存的にがん細胞の代謝を酸化的リン酸化経路から解糖系へシフトさせる。OCR(Oxygen consumption rate; 酸素消費速度):酸化的リン酸化の活性の指標。ECAR(Extra-cellular acidification rates; 細胞外酸性化速度):解糖系の活性の指標。
以上の結果から、インターベノリンや他の呼吸鎖複合体I阻害剤は、酸化的リン酸化経路の阻害により乳酸代謝の変化を介して細胞内外の酸性化を同時に誘導し、がん細胞の増殖を抑制することがわかりました。がん細胞は解糖系が元々亢進しており、酸化的リン酸化経路は抑制傾向にあることが知られていますが、酸化的リン酸化を主にエネルギー産生に利用している間質細胞では、呼吸鎖複合体I阻害剤処理した際の乳酸分泌ががん細胞よりも多いことがわかりました。これにより、呼吸鎖複合体I阻害剤は間質細胞存在下でより強い抗がん活性を発揮したと考えられます。
さらに、本研究グループは膵がんのPDX(Patient-derived xenograft)マウスモデル(注7、注8)を用いて、インターベノリンの抗がん活性評価を行いました。この結果、インターベノリンを投与したマウスではコントロールと比較して有意に腫瘍の増殖が抑制されることがわかりました(図4)。この実験結果から、呼吸鎖複合体I阻害剤は膵がんの治療に応用できる可能性があります。
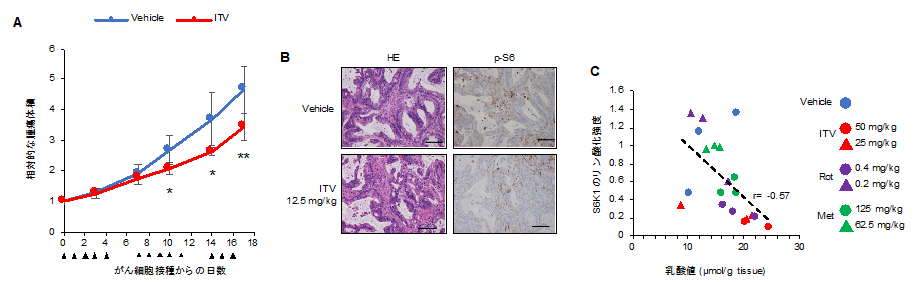 図4 A .膵がんPDXマウスモデルにおけるインターベノリン(ITV)(12.5 mg/kg)の抗がん活性。グラフ下の矢印は投与日。Vehicle:薬剤投与に対するコントロール。B.PDXマウス腫瘍の組織染色の結果。ITV投与によってS6K1の下流のS6のリン酸化が顕著に抑制された。C.マウスゼノグラフトモデル(注9)における呼吸鎖複合体I阻害剤投与による腫瘍内の乳酸値とS6K1のリン酸化強度の相関。呼吸鎖複合体I阻害剤により腫瘍内の乳酸値とS6K1のリン酸化強度は負に相関する。
図4 A .膵がんPDXマウスモデルにおけるインターベノリン(ITV)(12.5 mg/kg)の抗がん活性。グラフ下の矢印は投与日。Vehicle:薬剤投与に対するコントロール。B.PDXマウス腫瘍の組織染色の結果。ITV投与によってS6K1の下流のS6のリン酸化が顕著に抑制された。C.マウスゼノグラフトモデル(注9)における呼吸鎖複合体I阻害剤投与による腫瘍内の乳酸値とS6K1のリン酸化強度の相関。呼吸鎖複合体I阻害剤により腫瘍内の乳酸値とS6K1のリン酸化強度は負に相関する。
今後の展望
がん細胞の特徴の一つとして、解糖系の活性が亢進していることがよく知られています。このため、がん細胞は正常細胞に比べて乳酸の分泌が多く、固形腫瘍では元々pHが低くなっています。今回、本研究グループが発見した、呼吸鎖複合体I阻害剤の抗がん活性は低pH条件でより効果が強くなることから、固形腫瘍の酸性条件は呼吸鎖複合体I阻害剤の標的として適していると考えられます。また、間質細胞が多い腫瘍微小環境ほど呼吸鎖複合体I阻害剤の抗がん活性が期待できることから、これまで効果的な治療法が確立されていなかった膵がんの治療に対しての応用が期待されます。以上のことから、本研究グループが発見した呼吸鎖複合体I阻害剤の新しい抗がんメカニズムは、これまで行われてきた呼吸鎖複合体I阻害剤の創薬研究に革新をもたらすことが期待されます。また、本研究グループが単離したインターベノリンについては、抗がん剤創薬を目指して研究開発を継続しています。
研究支援
本研究は、以下の支援を受けて実施されました。
国立研究開発法人日本医療研究開発機構 (AMED) 次世代がん医療創生研究事業 (P-CREATE) 「がん―間質相互作用を利用した新規抗がん剤の開発基礎研究」
研究開発代表者:川田 学
用語解説
- (注1) ミトコンドリア呼吸鎖(電子伝達系)複合体I(呼吸鎖複合体I)
- 呼吸鎖複合体Iは細胞小器官のミトコンドリア内に存在する酵素で、ATPを生成する。ミトコンドリア呼吸鎖は、呼吸鎖複合体Ⅰ、Ⅱ、Ⅲ、Ⅳから構成され、酸化的リン酸化に関与している。
- (注2) 間質細胞
- 腫瘍内に存在する細胞で、本研究では線維芽細胞を示しています。がん細胞と線維芽細胞の相互作用は増殖促進シグナルの増強や増殖に必要な栄養の供給など、がん細胞にとって有利な微小環境の構築に重要であることが知られています。
- (注3) 解糖系
- ATPを生成する代謝経路の一つです。正常細胞では酸化的リン酸化が主なATP合成経路として利用されていますが、がん細胞では解糖系のはたらきが亢進して酸化的リン酸化経路が抑制されている場合が多いことが知られています。また、正常細胞では解糖系の代謝物は酸化的リン酸化経路に繋がっており、酸化的リン酸化経路の阻害は解糖系の最終産物である乳酸の増加を引き起こします。
- (注4) GPR132(G protein coupled receptor 132)
- 細胞膜に存在する、細胞外のpHの低下を感受するセンサータンパク質です。本研究では、乳酸分泌の増加による細胞外の酸性化により活性化し、酸性化シグナルを細胞内に伝える機能があることがわかりました。
- (注5) PP2A(Protein phosphatase 2A;プロテインホスファターゼ2A)
- 脱リン酸化酵素のひとつとして知られています。本研究では、細胞内外の酸性化により、がん細胞のS6K1を標的として脱リン酸化し、S6K1の活性を抑制することがわかりました。
- (注6) S6K1(Ribosomal protein S6 kinase beta-1)
- タンパク質の翻訳に重要な酵素です。S6K1の活性は細胞の増殖に非常に重要なため、増殖が速いがん細胞にとってS6K1の活性抑制は深刻なダメージとなります。一方で、増殖がそれほど速くない正常細胞とはダメージの深刻さに差があることが考えられるため、抗がん剤の標的としてはがん細胞特異的な増殖抑制活性が期待できます。
- (注7) PDX(Patient-derived xenograft)
- PDXは、がん患者由来のがん細胞・組織で、試験管内で培養された「がん細胞株」と比較して、生体内のがんの多様性や薬剤反応性をよく反映しています。
- (注8) PDXマウスモデル
- がん患者さんの腫瘍組織を免疫不全マウスに移植し生着させたマウスモデルです。PDXマウスでは、ヒトの腫瘍とよく似た病理的な組織構造やがん細胞の特徴を維持できるため、患者さんへの投与を想定した化合物の薬効評価系として非常に有用です。
- (注9) マウスゼノグラフトモデル
- 研究で使用するがん細胞株を免疫不全マウスに接種して腫瘍を形成させて実験を行う系です。PDXモデルと比較すると実際の患者さんの腫瘍環境とは異なる場合がありますが、生体内における腫瘍の解析、化合物の薬効評価が行えます。
論文
- タイトル
- Mitochondrial complex I inhibitors suppress tumor growth through concomitant acidification of the intra- and extracellular environment
- 著者
- Junjiro Yoshida, Tomokazu Ohishi, Hikaru Abe, Shun-ichi Ohba, Hiroyuki Inoue, Ihomi Usami, Masahide Amemiya, Raphael Oriez, Chiharu Sakashita, Shingo Dan, Minoru Sugawara, Tokuichi Kawaguchi, Junko Ueno, Yuko Asano, Ami Ikeda, Manabu Takamatsu, Gulanbar Amori, Yasumitsu Kondoh, Kaori Honda, Hiroyuki Osada, Tetsuo Noda, Takumi Watanabe, Takao Shimizu, Masakatsu Shibasaki, Manabu Kawada
- 雑誌
- iScience
- DOI
- 10.1016/j.isci.2021.103497
お問い合わせ先
研究に関すること
川田 学(かわだ まなぶ)
公益財団法人微生物化学研究会 微生物化学研究所 第1生物活性研究部 部長
菅原 稔(すがわら みのる)
公益財団法人がん研究会 がんプレシジョン医療研究センター
がんゲノム医療開発プロジェクト
報道担当
山﨑 勝久(やまざき かつひさ)
公益財団法人微生物化学研究会 微生物化学研究所 知的財産情報部 部長
公益財団法人がん研究会 調達・社会連携部 広報課
AMED事業に関すること
国立研究開発法人日本医療研究開発機構
次世代がん医療創生研究事業(P-CREATE)


