2020-07-08 国立大学法人神戸大学,国立研究開発法人日本医療研究開発機構
神戸大学大学院医学研究科シグナル統合学分野の村田陽二准教授、的崎尚教授らと、東京大学大学院理学系研究科の菅裕明教授、大阪大学蛋白質研究所の中川敦史教授らの研究グループは、がん細胞を食べる(貪食)能力を持つマクロファージ※1上のSIRPα※2という膜タンパク質に特異的に結合する環状ペプチド※3を発見しました。さらに、そのペプチドが抗体医薬※4により誘導されるマクロファージのがん細胞に対する貪食作用を高め、マウスに移植されたがん細胞の排除を増強することを明らかにしました。今後、有効性と安全性の高い最適化されたSIRPα結合環状ペプチドを開発できれば、がんの新たな治療薬になることが期待されます。
この研究成果は、令和2年7月7日(現地時間)に、米国科学誌「Cell Chemical Biology」にオンライン掲載される予定です。
ポイント
- マクロファージの貪食作用に関わる膜タンパク質SIRPαに結合する環状ペプチド(SIRPα結合環状ペプチド)を発見した。
- SIRPα結合環状ペプチドはSIRPαと膜タンパク質CD47の結合を阻害する作用を示した。
- がん細胞を標的とする抗体医薬によるマクロファージのがん細胞貪食をSIRPα結合環状ペプチドが促進した。
- ヒトもしくはマウス由来がん細胞を移植したマウスにおいてがん細胞を標的とする抗体医薬の抗がん作用をSIRPα結合環状ペプチドが増強した。
- 抗体医薬の抗がん作用を高める薬剤としてSIRPα結合環状ペプチドの利用可能性が示された。
研究の背景
1981年以来、がんは日本国内において死因の第一位であり、新規の抗がん剤や従来の薬剤の効果を増強する薬剤の開発が望まれています。近年、がん細胞や正常細胞に存在する特定のタンパク質に作用する薬剤(分子標的薬)を用いたがんの治療が行われ、その有効性が示されつつあります。分子標的薬の中でも、薬剤の製造コストや副作用の面などから低分子薬※5と抗体医薬の特性を併せ持つ中分子サイズの薬剤(低分子薬と抗体医薬の中間的な大きさを持つ薬剤)として環状ペプチドが注目されており、抗がん剤や他の薬剤の作用を増強する薬剤としての利用が期待されています。
研究の内容
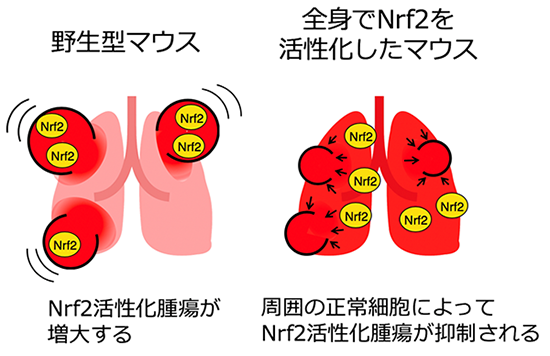
これまでに、的崎教授らの研究グループでは、マクロファージの細胞膜に存在するタンパク質SIRPαとその貪食標的となるがん細胞の細胞膜に存在するタンパク質CD47が結合すると、がん細胞を標的とする抗体(がん細胞上に存在する抗原に結合)により誘導されるマクロファージのがん細胞に対する貪食能力(貪食活性)が弱められ(図1左)、一方で、SIRPαとCD47の結合を阻害するとその活性が高められることを見つけていました(図1右)。
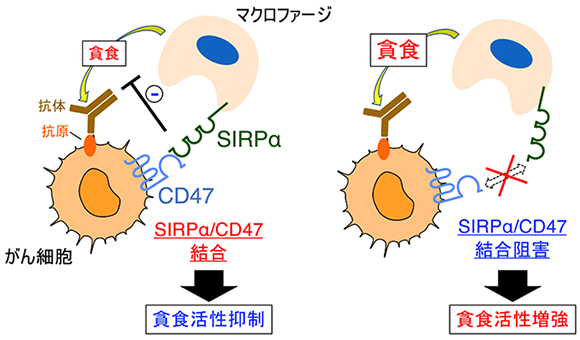
図1 がん細胞を標的とする抗体により誘導されるマクロファージのがん細胞貪食のSIRPαとCD47との結合による抑制
今回、研究グループは、菅教授らが先に開発したRaPIDシステム※6を利用し、SIRPαに結合する中分子サイズの環状ペプチドの探索を行い、15個のアミノ酸からなるSIRPα結合環状ペプチドを見つけました(図2左)。さらに、得られたSIRPα結合環状ペプチドがSIRPαとCD47の結合を阻害する作用を持つことを発見しました。また、X線結晶構造解析※7を行い環状ペプチドとSIRPαの結合の様子を捉えた結果(図2右)、その阻害メカニズムはSIRPαのペプチドとの結合によるダイナミックな構造の変化によるものであると考えられました。
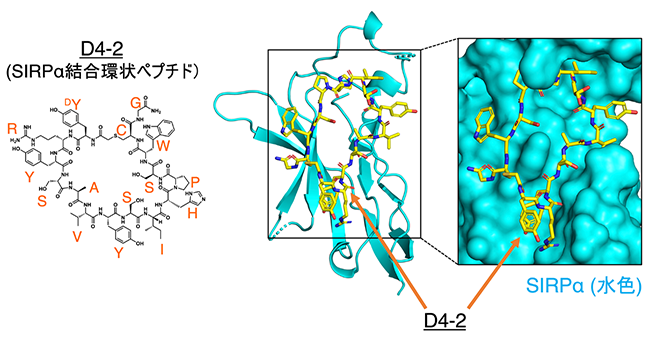
図2 SIRPα結合環状ペプチド(D4-2)とSIRPαとの複合体の構造(モデル図)そこで、研究グループは、SIRPαとCD47との結合を阻害する能力を持つSIRPα結合環状ペプチドが、がんの治療薬として利用可能であるかについてさらに検討を進めました。その結果、ヒトBリンパ腫由来がん細胞※8を標的とする抗体医薬であるリツキシマブ※9やマウス由来のメラノーマ細胞※10を標的とする抗体(TA-99抗体)により誘導されるがん細胞に対するマクロファージの貪食作用をSIRPα結合環状ペプチドが高めることが確認できました。さらに、メラノーマ細胞を移植した腫瘍モデルマウスにTA-99抗体※11とSIRPα結合環状ペプチドを同時に投与した場合には、それぞれの単独投与に比べ、マウスの肺に形成されたメラノーマ細胞の腫瘍結節(メラノーマ細胞の塊)の数が著明に減少することが分かりました(図3)。これらのことから、少なくともマウスの生体内では、SIRPα結合環状ペプチドががん細胞を標的とする抗体医薬の抗がん作用を増強することが示されました(図4)。
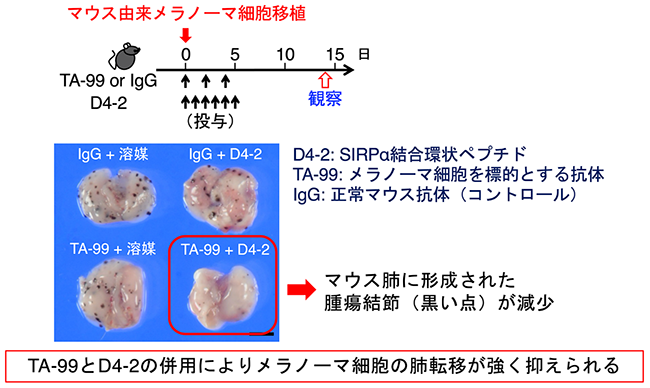
図3 マウスメラノーマ肺転移に対するSIRPα結合環状ペプチドとTA-99抗体の併用効果
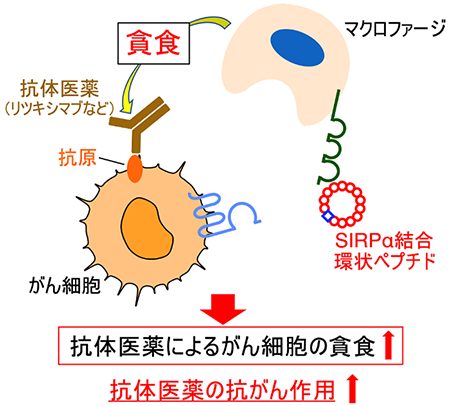
図4 SIRPα結合環状ペプチドによる抗体医薬の抗がん作用の増強
今後の展開
本研究により、SIRPα結合環状ペプチドががん細胞を標的とする抗体医薬の抗がん作用を増強する薬剤として利用できる可能性を示しました。今後、がんの治療薬として最適化されたSIRPα結合環状ペプチドの開発を進めていきたいと考えています。
用語解説
- ※1 マクロファージ
- 生体内に侵入した病原体などを貪食し排除するのに特化した免疫細胞。老化した細胞やがん細胞なども貪食し、生体内からの不要な細胞の排除にも関わっている。
- ※2 SIRPα
- 細胞の内外を分ける細胞膜上に存在する膜タンパク質の一つで、マクロファージに豊富に存在している。SIRPαはマクロファージの貪食標的となる細胞上の別の膜タンパク質CD47と結合することで、その貪食の活性調節を担っている。SIRPαは、Signal regulatory protein αの略。
- ※3 環状ペプチド
- タンパク質の構成成分であるアミノ酸が、数個から数十個程度、環状につながりできた物質を環状ペプチドという。一般的に、環状構造を持つ化合物は、生体内で安定であり、また標的タンパク質との強い相互作用を獲得しやすいと考えられている。
- ※4 抗体医薬
- B細胞という免疫細胞から産生され、抗原と呼ばれる特定の分子と特異的に結合する性質を持つタンパク質(抗体)を基に改変を加えた分子標的薬の一つ。標的への高い特異性や強い結合力を持つが、化学合成ができないため製造コストが高く、腸から吸収されないため経口投与が困難というデメリットもある。
- ※5 低分子薬
- 分子量が500Da以下の薬剤。分子量が小さいため経口投与が可能で、安く製造することができる反面、標的への特異性が低いため副作用が起こりやすく、また、分解されやすいため半減期が短い(頻回の投与が必要になる)などの欠点もある。
- ※6 RaPIDシステム
- 標的となる分子(主にタンパク質)に高い親和性と特異性をもつ環状ペプチドを、迅速かつ安価に同定できる実験系。RaPIDは、Random nonstandard Peptides Integrated Discoveryの略。
- ※7 X線結晶構造解析
- タンパク質は、多種のアミノ酸が鎖状に連結した高分子であり、それぞれ特定の立体構造をとることで機能を発揮する。そのため、目的とするタンパク質の結晶にX線を照射して回折点を測定し、立体構造を決定することで、それぞれのタンパク質の機能を正確に理解することが可能となる。
- ※8 ヒトBリンパ腫由来がん細胞
- Bリンパ腫とは、血液細胞に由来するがんの1つで、白血球の一種であるB細胞というリンパ球ががん化した病気である。
- ※9 リツキシマブ
- 細胞の膜上に存在するCD20と呼ばれているタンパク質と特異的に結合する抗体(抗CD20抗体)であり、主に悪性リンパ腫の抗がん剤として用いられている。CD20は正常なB細胞や悪性リンパ腫の中でもB細胞リンパ腫に豊富に存在することが知られている。
- ※10 メラノーマ細胞
- 悪性黒色腫という非常に悪性度の高い皮膚がんの一種。皮膚の色と関係するメラニン色素を産生する細胞(メラノサイト)、あるいは母斑細胞と呼ばれるほくろの細胞が悪性化した腫瘍と考えられている。
- ※11 TA-99抗体
- 細胞の膜上に存在するgp75と呼ばれているタンパク質と特異的に結合する抗体(抗gp75抗体)。gp75はメラノーマの細胞上に強く発現するため、マウスを用いた実験でTA-99抗体のメラノーマに対する抗がん作用が証明されている。
謝辞
本研究は、主に国立研究開発法人日本医療研究開発機構(AMED)次世代がん医療創生研究事業(P-CREATE)「貪食細胞-がん細胞相互作用を制御する新たながん免疫療法の開発」(研究開発代表者:的崎尚)、創薬等ライフサイエンス研究支援基盤事業(BINDS)「創薬等ライフサイエンス研究のための相関構造解析プラットフォームによる支援と高度化(創薬等ライフサイエンス研究のための多階層構造生命科学解析技術の支援と高度化)」(補助事業代表者:中川敦史)、科学研究費助成事業、大阪大学蛋白質研究所共同研究事業の支援を受けて実施されました。
論文情報
- タイトル
- “Macrocyclic Peptide–Mediated Blockade of the CD47-SIRPα Interaction as a Potential Cancer Immunotherapy”
- DOI:
- 10.1016/j.chembiol.2020.06.008
- 著者
- Daisuke Hazama1,2,#, Yizhen Yin3,#, Yoji Murata1,*, Makoto Matsuda4, Takeshi Okamoto1, Daisuke Tanaka1, Naohiro Terasaka3, Jinxuan Zhao3, Mariko Sakamoto1, Yuka Kakuchi1, Yasuyuki Saito1, Takenori Kotani1, Yoshihiro Nishimura2, Atsushi Nakagawa4, Hiroaki Suga3,*, and Takashi Matozaki1,*
1Division of Molecular and Cellular Signaling, Department of Biochemistry and Molecular Biology, Kobe University Graduate School of Medicine
2Division of Respiratory Medicine, Department of Internal Medicine, Kobe University Graduate School of Medicine
3Department of Chemistry, Graduate School of Science, The University of Tokyo
4Laboratory of Supramolecular Crystallography, Research Center for Structural and Functional Proteomics, Institute for Protein Research, Osaka University
#These authors contributed equally
*Corresponding authors - 掲載誌
- Cell Chemical Biology
お問い合わせ先
研究について
神戸大学医学研究科生化学・分子生物学講座 シグナル統合学分野
教授 的崎尚
報道担当
神戸大学総務部広報課
AMED事業に関すること
国立研究開発法人日本医療研究開発機構 (AMED)
創薬事業部医薬品研究開発課
次世代がん医療創生研究事業 (P-CREATE)
創薬等ライフサイエンス研究支援基盤事業 (BINDS)