2022-03-16 量子科学技術研究開発機構
発表のポイント
- 放射線腸管障害に防護効果がある高硫酸化ヒアルロン酸の開発に成功
- 高硫酸化ヒアルロン酸は、血液の凝固を妨げず、出血誘発の可能性が低い
- 開発した高硫酸化ヒアルロン酸は放射線障害防護薬として有望であり、出血の誘発を避けなければならない、傷口・火傷など様々な治療への応用にも期待
国立研究開発法人量子科学技術研究開発機構(理事長 平野俊夫。以下「量研」という。)量子生命・医学部門放射線医学研究所 放射線規制科学研究部 組織再生治療研究グループの三浦太一研究員、中山文明グループリーダーと東京化成工業株式会社の湯浅徳行、松崎祐二らは、放射線腸管障害1)に対する防護効果が得られ、かつ、出血誘発もない、安全な“高硫酸化ヒアルロン酸2)”糖鎖3)の開発に成功しました。
小腸などの消化管は放射線感受性4)が非常に高いため、骨盤内の臓器にある腫瘍を放射線治療する際は、腸になるべく放射線が当たらないように照射する、遮へい材を用いて線量を下げるなどの工夫がされますが、場合によっては腫瘍に十分な線量を照射できないことや、放射線腸管障害が起きてしまうことがあります。そのため、障害を防ぐ薬剤の開発が求められています。
我々は、これまでの研究で、液性因子(細胞外に放出されて生理的な機能を持つ物質)5)の一つで、放射線障害から小腸を防護する効果があるFGF1(線維芽細胞増殖因子-1、fibroblast growth factor 1)6)はヘパリン7)の存在下でその構造が安定化し、高い防護効果が得られることを明らかにしています。しかし、ヘパリンには出血を促す作用があり、しばしば出血が起こる放射線腸管障害の患者さんに対して用いることができません。そこで、我々は、出血を促進することなくFGF1の構造を安定化できる薬剤の開発を試みました。
着目したのは、ヒアルロン酸という糖鎖です。ヒアルロン酸は、ヘパリンを構成する糖鎖に似た骨格構造を持っていますが、糖鎖に硫酸基がついていない点がヘパリンと異なります。このため、先ず、ヒアルロン酸に適度な数の硫酸基を付加して硫酸化度を制御した、大量の“高硫酸化ヒアルロン酸”を合成する技術を開発しました。開発した高硫酸化ヒアルロン酸の放射線腸管障害に対する防護効果について、ガンマ線(10 Gy)を照射したマウスで評価したところ、FGF1と高硫酸化ヒアルロン酸の組み合わせは、FGF1とヘパリンの組み合わせと同等の効果を持つことが分かりました。課題である、出血の誘発回避について調べたところ、高硫酸化ヒアルロン酸はヘパリンとは異なり、血液の凝固を妨げないことから、出血を誘発する可能性が低いことが分かりました。これらの結果は、高硫酸化ヒアルロン酸が、出血の危険性が低い放射線障害防護薬として有望であることを示しています。
今後、高硫酸化ヒアルロン酸の薬剤としての安全性などが確認できれば、放射線障害防護薬としてだけでなく、出血の誘発を避けなければならない様々な治療、例えば腸管以外の放射線障害部位(皮膚や神経)の治療や、傷口・火傷の治療(創傷治癒)などにも応用の範囲を広げられることが期待できます。
この成果は、放射線腫瘍学分野でインパクトの大きい論文が数多く発表されている米国科学誌「Advances in Radiation Oncology」のオンライン版に2022年3月13日に掲載されました。
研究開発の背景と目的
小腸などの消化管は放射線感受性が非常に高いため、放射線治療の際の副作用として放射線腸管障害が起こることが未だに大きな問題となっています。そのため、医療現場において放射線腸管障害の克服が強く求められています。
これまでに我々は、マウスを用いて、放射線腸管障害の防護や治療に有効な治療薬を模索してきました。その結果、液性因子のFGF1が、放射線障害から小腸を防護する効果を有することを明らかにしました。しかし、FGF1はとても不安定な構造で壊れやすい性質があり、これを解決できなければFGF1が一定の防護効果を発揮し続けることができません。
FGF1はヘパリンと結合することで構造が安定化するという性質があります。我々は、放射線照射前のマウスに、FGF1を単独投与した場合と、FGF1とヘパリンを併用して投与した場合を比べると、ヘパリンを併用した方が、防護効果が有意に高くなることを明らかにしています。
さらに、ヘパリンはFGF1をはじめとする多くの液性因子と結合して、液性因子を安定化できるという特性もあります。液性因子はそれぞれの受容体と結合することで機能しますが、ヘパリンは液性因子と受容体の相互作用に関しても協調的に働くことから、ヘパリンは、液性因子が正常に機能するようにサポートする重要な因子であるといえます。
このことから液性因子を利用した治療にヘパリンの併用が有効であることが分かっているのですが、ヘパリンは血液の凝固を阻害し、出血を促進するという副作用があるため、出血している患者や出血の危険性がある患者には投与することは禁止、または制限されています。放射線腸管障害の患者においてもしばしば出血が認められることがあるため、ヘパリンを使用することはできません。
そこで、ヘパリンが属するグリコサミノグライカン(Glycosaminoglycan : GAG)8)と呼ばれる糖鎖の一種であるヒアルロン酸(Hyaluronic acid :HA)に着目しました。HAはグルクロン酸とN-アセチルグルコサミン(GlcNAc)の二糖の繰り返しの構造を持っており、その基本構造はヘパリンと非常によく似ていますが、ヘパリンのように高度に硫酸化されていません(図1)。これまで、HAに付加する硫酸基の数を制御し、かつ大量製造することはできていませんでしたが、共同研究グループが製造・精製工程について検討を重ね、硫酸化度を制御した”高硫酸化ヒアルロン酸(High-sulfated hyaluronic acid :HA-HS)”を製品化することに成功しました(図1)。そして、HA-HSとヘパリンを比較しながら、(1)放射線腸管障害に対するHA-HSとFGF1の併用による防護効果と、(2)HA-HSの抗凝固作用について解析し、HA-HSがヘパリンに代わる安全な薬剤になり得るか検討しました。
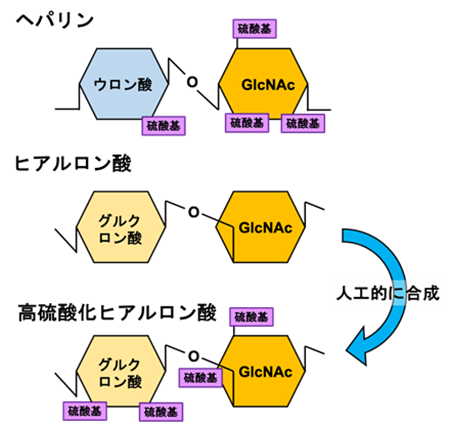
図1:ヘパリン・ヒアルロン酸・高硫酸化ヒアルロン酸の構造
(1)高硫酸化ヒアルロン酸はFGF1に結合できるか?
作成したHA-HSのFGF1への結合能を検討しました(図2A)。はじめに、ヘパリン、(硫酸化されていない)HA、HA-HSの3種の糖鎖それぞれをFGF1と混合し、しばらく静置します。その後、糖鎖とFGF1を混合したものをヘパリンが草のように底に生えている特殊なディッシュに入れます。既に糖鎖とFGF1が強く結合している場合、FGF1はディッシュに生えているヘパリンとは結合できません。一方、FGF1が糖鎖と結合していない場合、FGF1はディッシュに生えたヘパリンと強く結合することができます。
ディッシュに生えたヘパリンに結合したFGF1の量を検出することで各糖鎖のFGF1への結合能を評価した結果、FGF1への結合能は、HA-HSとヘパリンとでは同程度に強く、硫酸化されていないHAではほとんど結合しないことを初めて明らかにすることができました(図2B)。この結果は、HA-HSがヘパリンと同様にFGF1をはじめとした液性因子に対する強い結合能を有していることを示しています。
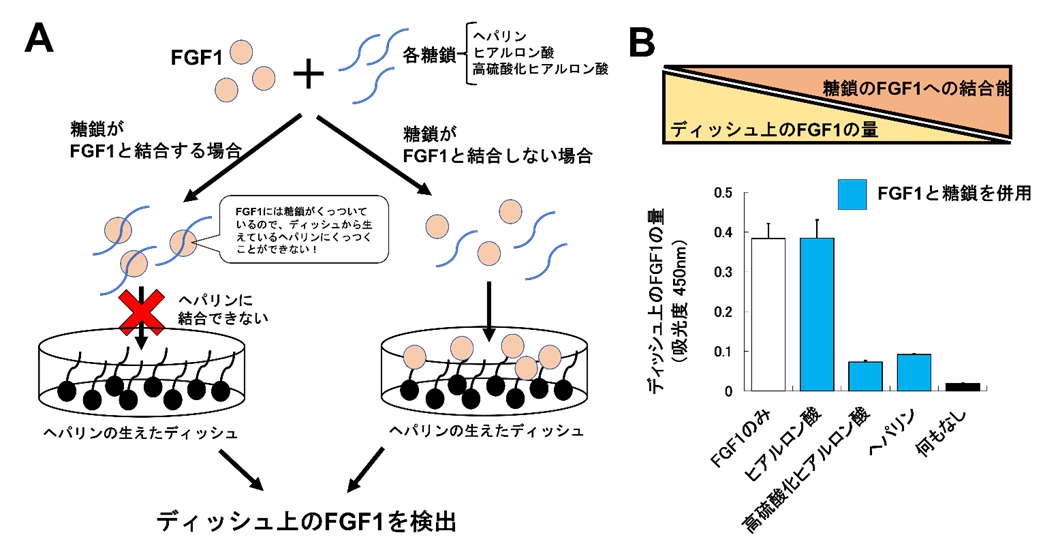
図2:FGF1との結合能の解析
(2)高硫酸化ヒアルロン酸は放射線腸管障害に対する防護効果を有するか?
放射線照射後に小腸などの腸管で障害が起こる主要な原因の一つに、腸を構成する様々な細胞を作ることができる特殊な細胞(幹細胞)が放射線により死ぬこと(または、放射線により細胞増殖が抑制されること)があげられます。この幹細胞はクリプトと呼ばれるユニークな構造(図3A)を形成しており、放射線障害が起こった小腸ではこのクリプト数が少なくなることが分かっています。したがって、放射線照射後にクリプト数を計測することで放射線腸管障害の程度を評価することができ、これをクリプト解析と呼びます。
マウスにあらかじめヘパリン、HA、HA-HSを単独、またはFGF1と併用して腹腔内に投与し、投与24時間後に放射線(ガンマ線、10 Gy)を照射し、投与物が放射線障害からマウスの小腸を防護するか、クリプト解析により評価しました(図3B)。その結果、コントロールに比べて、ヘパリンまたはHA-HSの単独投与ではクリプト数が多く、FGF1とヘパリンまたはHA-HSを併用することでさらにクリプト数が多くなることが分かりました(図3C)。これらの結果は、ヘパリンまたはHA-HS自体に防護効果があり、さらにFGF1と併用することでFGF1の防護効果を促進する作用があることを示しています。この効果はヘパリンとHA-HSでは同程度でした。また、(硫酸化のない)HAにはこのような効果は認められませんでした。
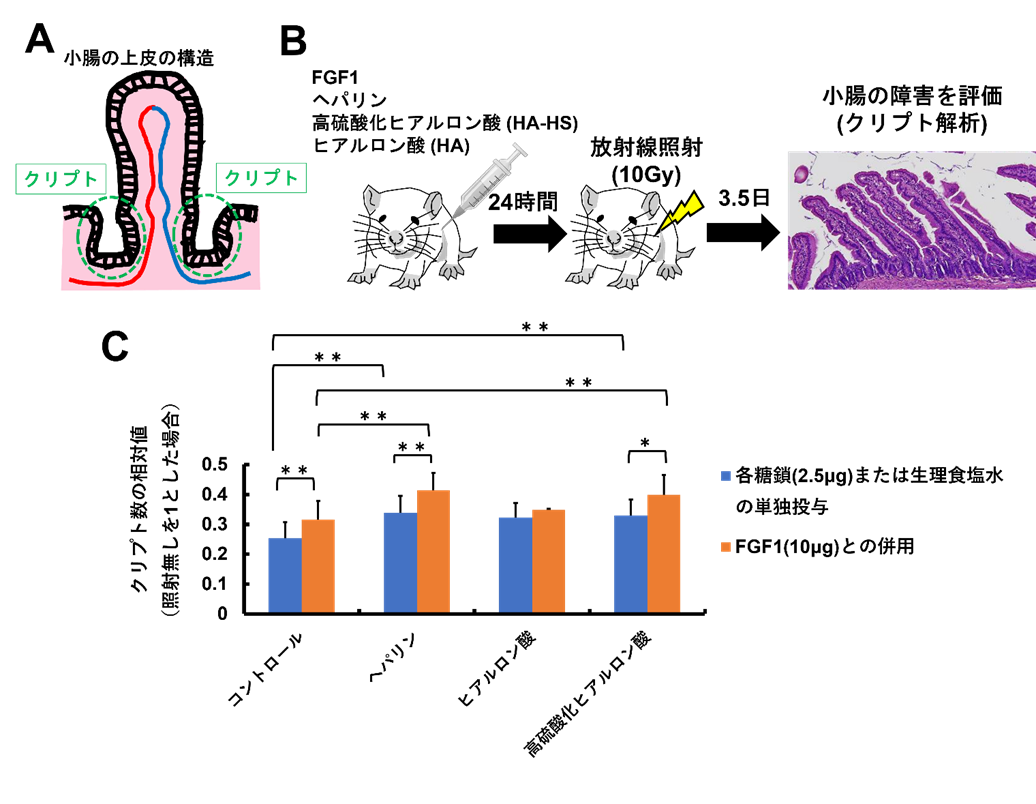
図3:放射線腸管障害に対する防護効果の解析
有意差:*P <0.05; **P <0.01
(3)高硫酸化ヒアルロン酸は放射線により引き起こされる細胞死を抑制するか?
死んだ細胞を検出することのできる特殊な染色を実施することで、放射線照射前と比較して照射後の小腸ではクリプトにおいて多数の死んでいる細胞を確認することができます(図4)。HA-HS単独、またはFGF1との併用での腹腔内投与により、この放射線照射により引き起こされる細胞死を抑制できるか検討しました。マウスに放射線を照射する24時間前にヘパリン、HA、HA-HSを単独、またはFGF1と併用して腹腔内投与し、照射後のクリプトにおける死細胞を検出しました。その結果、ヘパリン、またはHA-HSの単独投与は放射線による細胞死を抑制することが分かりました。HA単独投与にはこのような効果はありませんでした。また、FGF1とヘパリンまたはHA-HSの併用により、放射線により引き起こされる細胞死を抑制する効果がより増強されることも分かりました。
以上より、HA-HSは、ヘパリンと同様に放射線により引き起こされる細胞死を抑制する能力を有すること、FGF1と併用することでその効果が増強されることを明らかにすることができました。
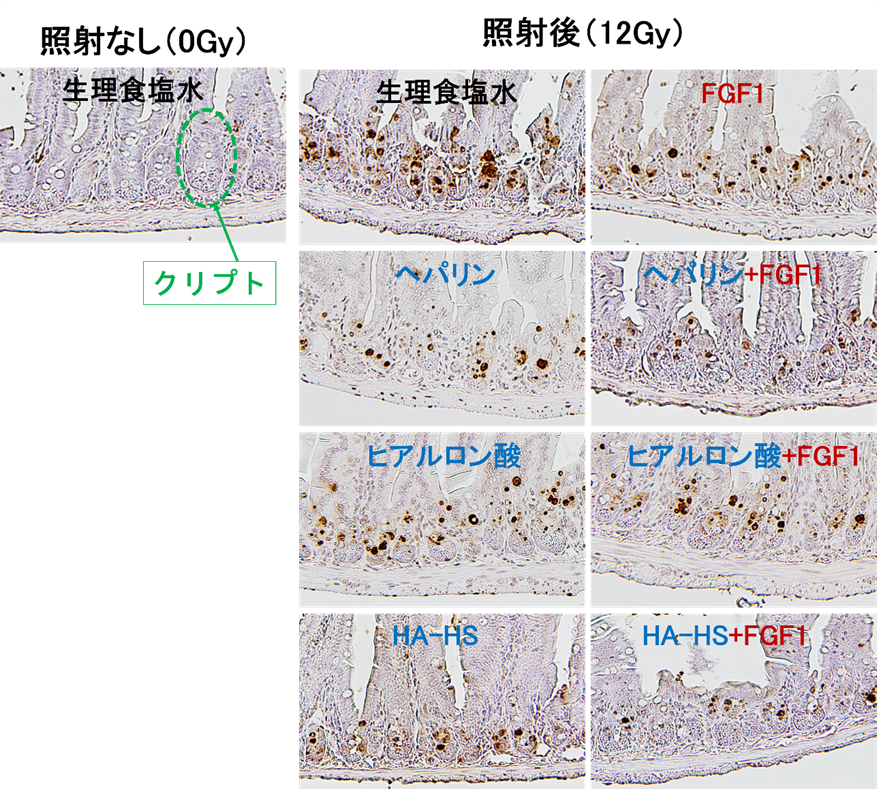
図4:放射線誘発性の細胞死に関する解析
死細胞のみを焦げ茶色に染色できる方法で検出しています。
(4)高硫酸化ヒアルロン酸は抗凝固作用を有するか?
HA-HSがヘパリンと同等の抗凝固作用を有している場合、放射線障害部位に出血が認められる患者や出血の危険性のある患者には適用することはできません。そこでマウスの血液にヘパリン、HA、HA-HSをそれぞれ添加し、37度に保ちながら血液が固まるまでの時間を計る方法でHA-HSの坑凝固作用を検討しました(図5)。
その結果、ヘパリンは強力な坑凝固作用があるため血液が固まるまでに少なくとも3時間以上かかりましたが、HAまたはHA-HSは8分以下の短時間で固まりました。したがって、HA-HSの坑凝固作用はヘパリンよりもはるかに弱いことが分かりました。
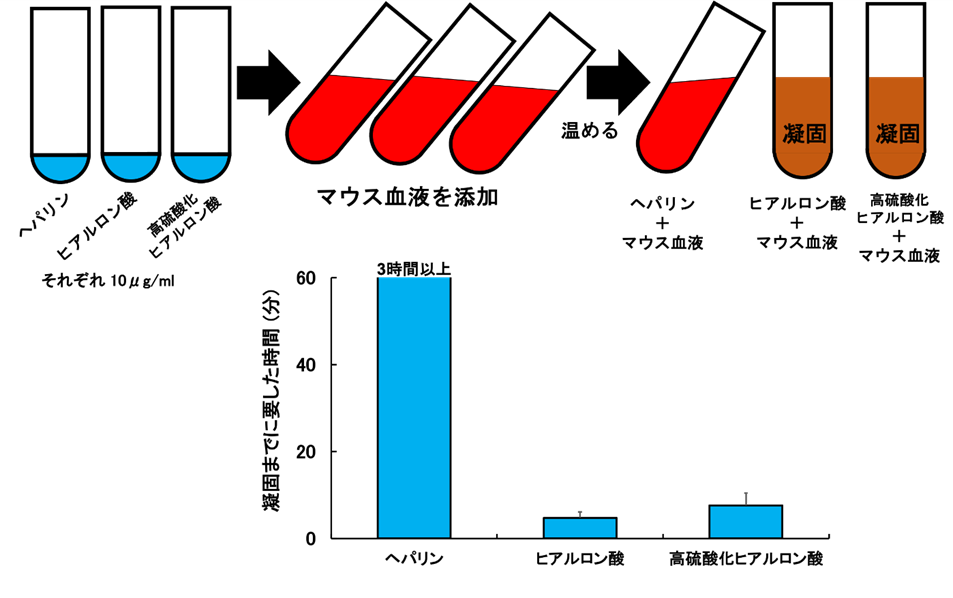
図5:マウス血液を用いた糖鎖の凝固作用の解析
【今後の展開】
本研究により、出血の危険性のないHA-HSはヘパリンに代わる安全な薬剤として、放射線腸管障害の防護に利用できる可能性を示すことができました。また、上記の結果では示していませんが、放射線照射後のマウスにFGF1とHA-HSを併用して腹腔内投与することで、障害を受けた小腸の再生が促進することをクリプト解析により明らかにしています。今後は、防護効果だけでなく、予期せぬ被ばく後の再生治療にもFGF1とHA-HSを用いることができるのか、さらなる解析を実施する予定です。
FGFは25種類あり、FGF1以外のいくつかのFGFにも放射線腸管障害に対して防護や再生促進などの治療効果があることが報告されています。これまでの解析からHA-HSはFGF1以外にも、放射線腸管障害に対して効果を有するいくつかのFGFと強く結合し安定化するという結果を得ています。今後は、それらのFGFをFGF1とHA-HSの組み合わせに併用し、高い治療効果を得ることのできる条件を探索していこうと考えています。また、FGF以外の液性因子や、幹細胞を用いた再生治療などとHA-HSを組み合わせた“複合的な治療”についても研究を実施し、放射線腸管障害の克服を目指したいと考えています。
本研究では放射線腸管障害に着目しましたが、FGF1とヘパリンの併用は放射線により引き起こされる脱毛の治療、放射線関連以外では創傷治癒、神経の再生、大腸炎や糖尿病の治療にも有効であることが動物実験により示唆されています。出血やその恐れがあるこれらの治療においてもヘパリンの代わりにHA-HSを応用できると期待されます。
用語解説
1)放射線腸管障害
小腸などの消化管に放射線が照射されると、まず放射線による影響を受けやすい幹細胞に増殖の抑制や細胞死の誘導が起こり、続いて粘膜の炎症などが起こります。高い線量の被ばくでは、広範囲で幹細胞が死滅し、細胞の供給は断たれ、絨毛の構造は消失し、粘膜に潰瘍や出血が進み粘膜の細胞は壊死します。また、被ばくにより急性の腸疾患を起こした場合は高い確率で晩期障害(数ヶ月〜数年後に現れる障害)が起こり、粘膜上皮の障害だけでなく血管の損失や繊維化などの慢性的・複合的な症状が現れます。
2)高硫酸化ヒアルロン酸
ヒアルロン酸はヘパリンと同様にグリコサミノグライカンに属する糖鎖で、その基本構造はヘパリンと似ています。一般的に、自然界においてヒアルロン酸はヘパリンのように硫酸化されていません。共同研究機関である東京化成工業は人工的にヒアルロン酸に硫酸化を施し、高硫酸化ヒアルロン酸を作成しました。高硫酸化ヒアルロン酸は、基本構造だけでなく高度に硫酸化されている点も、ヘパリンと非常によく似ています。
3)糖鎖
各種の単糖(ウロン酸やGlcNAcなど)がグリコシド結合によって鎖のようにつながった化合物を糖鎖と呼びます。糖鎖はタンパク質や脂質、その他の低分子と相互作用することができ、生体内で重要な機能を担っています。そのため、糖鎖は、核酸(ヌクレオチドが連続して結合した鎖)やタンパク質(アミノ酸が連続して結合した鎖)に並ぶ「第三の生命鎖」として注目されています。
4)放射線感受性
生物に放射線が照射されると、一般的に細胞分裂が盛んな細胞や未成熟な細胞ほど大きなダメージを受けます。この放射線による影響の受け方の度合を感受性といいます。体内で放射線に対して高い感受性を示す臓器としては、骨髄、リンパ節、脾臓、胃、腸、生殖腺、皮膚などがあります。
5)液性因子
液性因子とは細胞が細胞外に放出する生理的機能を有した物質のことをいいます。一般的に液性因子は細胞膜上の受容体に結合することで、受容体の下流の経路(シグナル)を活性化し、結果的に様々な生理的な現象(例えば細胞増殖、細胞運動、細胞死など)を制御しています。
6)FGF1(線維芽細胞増殖因子-1、fibroblast growth factor 1)
液性因子であるFGFファミリーの一つです。FGFは25種類(ヒトでは22種類)見つかっており、細胞増殖、血管新生、創傷治癒、神経再生などの様々な現象に密接に関与しています。一般的にFGFはヘパリンに結合できるタンパク質で、このヘパリン(または、へパラン硫酸)との結合はFGFのシグナル伝達に必須であるとされています。
7)ヘパリン
ヘパリンは、グリコサミノグライカンのへパラン硫酸と呼ばれる糖鎖の一つで、細胞表面に存在し、種々のタンパク質と相互作用します。それらのタンパク質は、抗凝固作用に関与する凝固系のタンパク質や、種々の成長因子(液性因子)など多種多様なタンパク質が含まれ、細胞増殖などの生理現象に関与しています。強い抗凝固作用を有しているので、一般的に抗凝固薬として臨床の現場で、例えば、血栓塞栓症の治療や、人工透析での凝固防止のために使用されます。
三浦らは、これまでの研究で、液性因子の一つで、放射線障害から小腸を防護する効果があるFGF1は、ヘパリンと併用することで、より高い防護効果が得られることを明らかにしています。しかし、ヘパリンは抗凝固作用の強さから出血を促す副作用があり、しばしば出血が起こる放射線腸管障害の患者さんに投与することはできませんでした。
8)グリコサミノグライカン(Glycosaminoglycan : GAG)
グリコサミノグライカンは、結合組織などの様々な組織に存在している糖鎖です。硫酸基が付加した2糖の繰り返し構造からなり、うち1つはアミノ糖(ガラクトサミンやグルコサミン)であり、もう1つはウロン酸(グルクロン酸やイズロン酸)またはガラクトースです。多数の硫酸基とカルボキシル基を持つために、強く負に帯電しており、シグナル伝達を含めあらゆる現象に関与しています。しかし唯一の例外として、ヒアルロン酸はグリコサミノグライカンではありますが、硫酸基を持っていません。グリコサミノグライカンには、ヘパリン、へパラン硫酸、ヒアルロン酸の他に、コンドロイチン硫酸、ケラタン硫酸、デルマタン硫酸があります。近年はその重要性からグリコサミノグライカンの機能についての研究が盛んに行われています。
論文情報
タイトル: High-sulfated hyaluronic acid ameliorates radiation-induced intestinal damage without blood anticoagulation
著者: Taichi Miura, Ph.D.1, Mitsuko Kawano, Ph.D.1, Keiko Takahashi, B.S.1, Noriyuki Yuasa, Ph.D.2, Masato Habu2, Fumie Kimura, M.S.2, Toru Imamura, Ph.D.1,3, Fumiaki Nakayama, M.D., Ph.D.1
所属:
- Regenerative Therapy Research Group, National Institutes for Quantum Science and Technology (QST), Chiba, Japan
- Tokyo Chemical Industry Co., Ltd. (TCI), Tokyo, Japan
- School of Bioscience and Biotechnology, Tokyo University of Technology, Hachioji, Japan.