ウイルスの感染を阻止する経鼻ワクチンへの応用に期待
2021-08-20 東京大学
発表のポイント
- 上気道常在菌を死滅させると、死滅した常在菌がアジュバント(注1)となり経鼻ワクチンの効果が上がることが分かった。
- 培養した口腔菌をワクチンに混ぜると経鼻ワクチンの効果が上がることを明らかにした。
- 経鼻ワクチン接種群ではインフルエンザウイルスや、SARS-CoV-2従来株および変異株の増殖量を有意に抑制させることに成功した。
発表者
長井みなみ(東京大学大学院新領域創成科学研究科メディカル情報生命専攻 修士課程2年)
森山 美優(研究当時:東京大学大学院新領域創成科学研究科メディカル情報生命専攻 博士課程3年、
現在:Yale University/日本学術振興会海外特別研究員)
一戸 猛志(東京大学医科学研究所 附属感染症国際研究センター ウイルス学分野 准教授)
発表概要
腸内細菌由来代謝産物(注2)は、インフルエンザウイルス特異的な免疫応答の誘導に役立っていることが分かっています(注3)。一方、インフルエンザウイルスの感染の場となる上気道にも常在菌が生息していますが、この上気道常在菌がウイルス特異的な免疫応答の誘導やワクチン効果に与える影響は不明でした。
東京大学大学院新領域創成科学研究科メディカル情報生命専攻の長井みなみ大学院生(修士課程2年)、森山美優大学院生(研究当時博士課程3年)、東京大学医科学研究所附属感染症国際研究センターウイルス学分野の一戸猛志准教授らの研究グループは、マウスの上気道常在菌を抗生物質で死滅させるとインフルエンザウイルス感染後に誘導されるウイルス特異的な抗体応答が増加することを見出しました。
MyD88(注4)欠損マウスではこの効果が認められなかったことから、死滅した上気道常在菌由来の病原体関連分子パターン(pathogen-associated molecular patterns, PAMPs、注5)がアジュバントとして機能し、ウイルス特異的な抗体応答を増加させていることが分かりました。またマウスやヒトの鼻腔内に生息する常在菌数は口腔内の1/10~1/100と少ないことが分かり、スプリットワクチン(注6)だけを経鼻投与しても十分な抗体を誘導できない原因が上気道常在菌の数や質によるものであることが示唆されました。そこで培養した口腔菌をワクチンと混合して経鼻投与すると、ワクチン接種群ではウイルスに対する抗体が誘導され、インフルエンザウイルスやSARS-CoV-2の増殖量が有意に抑制されていることを確認しました(図1)。本研究成果は上気道粘膜でウイルスの感染そのものを阻止する経鼻ワクチンの効果を高めるための研究に役立つと期待されます。
本研究は、日本学術振興会(JSPS)科学研究費補助金事業、日本医療研究開発機構(AMED)振興・再興感染症に対する革新的医薬品等開発推進研究事業などの一環として、またヤクルト・バイオサイエンス研究財団、日立財団および三菱財団の助成を受けて得られたものです。本研究成果は2021年8月17日、米国科学誌「mBio」にオンライン公開されました。
発表内容
① 研究の背景・先行研究における問題点
経鼻インフルエンザワクチンに関するこれまでの研究から、経鼻ワクチンはウイルスの感染の場となる上気道粘膜にウイルス特異的なIgA抗体(注7)を誘導するため、ウイルスの感染そのものを阻止する有効なワクチンであることが分かっていました。しかしスプリットワクチンであるインフルエンザウイルスのHAワクチンだけを経鼻投与しても十分な抗体応答を誘導できないため、ワクチンにアジュバントを添加する必要がありました。また腸内細菌がワクチン効果に与える影響は解明されてきた一方、上気道常在菌が経鼻ワクチンの効果に与える影響については不明でした。
② 研究内容
研究グループは、マウスの上気道常在菌を抗生物質で死滅させるとインフルエンザウイルス感染後に誘導されるウイルス特異的なIgGおよりIgA抗体応答が増加することを見出しました。同様に上気道常在菌をリゾチーム(注8)で破壊することにより、同時に経鼻投与したインフルエンザHAワクチンに対する抗体応答が増加することを確認しました。MyD88欠損マウスではこの効果が認められなかったことから、死滅した上気道常在菌由来の病原体関連分子パターン(pathogen-associated molecular patterns, PAMPs)がアジュバントとして機能し、ウイルスやワクチン特異的な抗体応答を増加させていることが分かりました。またマウスやヒトの鼻腔内に生息する常在菌数は口腔内の1/10~1/100と少ないことが分かり、スプリットワクチンだけを経鼻投与しても十分な抗体を誘導できない理由が上気道常在菌の数や質によるものであることが示唆されました。そこで培養した口腔菌をワクチンと混合して経鼻投与すると、ワクチン接種群ではウイルスに対する抗体が誘導され、インフルエンザウイルスやSARS-CoV-2の増殖量が有意に抑制されていることを確認しました(図1)。
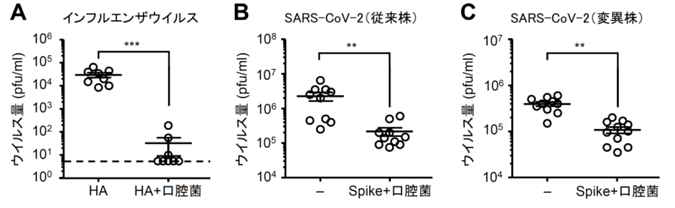
図1.経鼻ワクチンによるインフルエンザウイルスおよびSARS-CoV-2の増殖抑制効果
(A) インフルエンザウイルスHAワクチン単独または口腔菌とともに3週間隔で2回経鼻投与したマウスにインフルエンザウイルスを感染させ、感染3日後の肺胞洗浄液中のウイルス量を測定した。(B, C) 新型コロナウイルスのスパイクタンパク質(Spike)と口腔菌を3週間隔で2回経鼻投与したハムスターに、SARS-CoV-2の従来株 (B)、変異株(C)を感染させ、感染3日後の肺胞洗浄液中のウイルス量を測定した。点線はウイルス量の検出限界値(5 pfu/ml)を示す。**P < 0.01, ***P < 0.001
③ 社会的意義・今後の予定
これまでの研究から、経鼻インフルエンザワクチンはウイルスの感染の場となる上気道粘膜にウイルス特異的なIgA抗体(注7)を誘導するため、ウイルスの感染そのものを阻止することができる有効なワクチンであることが明らかになっています。このことから近い将来、日本でも経鼻投与型のインフルエンザワクチンが実用化する予定です。本研究成果はこのような経鼻ワクチンの効果を高めるために必要な重要な知見であり、より少ない量のワクチンで最大限の効果を発揮する経鼻ワクチンの開発研究に役立つと期待されます。また現在、世界中で問題となっている新型コロナウイルス(SARS-CoV-2)もインフルエンザウイルスと同様、呼吸器を標的としたウイルスであるため、今後はSARS-CoV-2の感染そのものを阻止することができる有効な経鼻ワクチンを開発することを目指します。
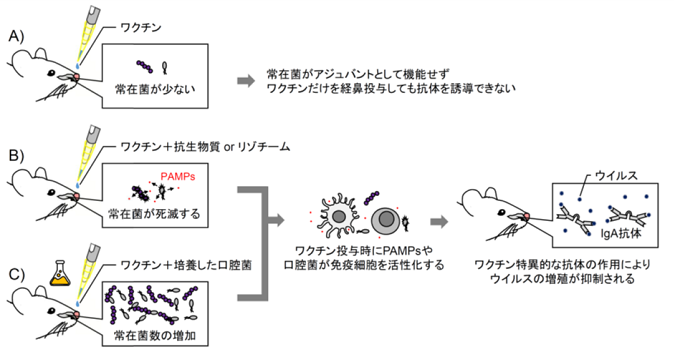
図2.本研究成果のまとめ
(A) 上気道常在菌はその数が少ないせいでアジュバントとして機能せず、スプリットワクチンだけを経鼻投与しても十分な抗体を誘導できない。(B) 抗生物質やリゾチームで上気道常在菌を破壊するか、(C) ワクチンに培養した口腔菌を混ぜて経鼻投与することにより、死滅した細菌由来のPAMPsまたは口腔菌が免疫細胞のMyD88シグナルを活性化させる。これによりワクチンに特異的な抗体が効率よく誘導され、上気道におけるインフルエンザウイルスおよびSARS-CoV-2の増殖量が有意に抑制された。
発表雑誌
雑誌名:mBio
論文タイトル:Oral bacteria combined with an intranasal vaccine protect from influenza A virus and SARS-CoV-2 infection
著者:Minami Nagai, Miyu Moriyama, Takeshi Ichinohe*
DOI:10.1128/mBio.01598-21
URL:https://doi.org/10.1128/mBio.01598-21
問い合わせ先
<研究に関するお問い合わせ>
東京大学医科学研究所 附属感染症国際研究センター ウイルス学分野
准教授 一戸 猛志(いちのへ たけし)
<報道に関するお問い合わせ>
東京大学医科学研究所 国際学術連携室(広報)
用語解説
(注1)アジュバント
抗原(ワクチンなど)と混合して投与することにより、その抗原に対する免疫応答を増加させることができる物質の総称。合成二本鎖RNAのpoly(I:C)は、経鼻インフルエンザワクチンの効果を増加させるアジュバントになる(Ichinohe et al. J Virol. 2007)。
(注2)腸内細菌由来代謝産物
腸内細菌は、ヒトの消化酵素では消化できない食物繊維を消化して、短鎖脂肪酸(酪酸、酢酸、プロピオン酸など)の生成を行っている。
(注3)腸内細菌叢がインフルエンザワクチンの効果を高めるメカニズム
研究グループはこれまでに、腸内細菌由来代謝産物やグルコースがインフルエンザウイルス感染後のウイルス特異的な免疫応答の誘導に重要であることを明らかにしている。
【参考】2019年2月5日プレスリリース「腸内細菌叢がインフルエンザワクチンの効果を高めるメカニズムを解明」https://www.ims.u-tokyo.ac.jp/imsut/content/900004337.pdf
(注4)MyD88
自然免疫系で中心的な役割を果たすtoll-like receptorsファミリーのアダプタータンパク質。Toll-like receptorsはさまざまな病原体関連分子パターン(注4)を認識することにより、その病原体に非特異的な自然免疫応答および病原体特異的な獲得免疫応答を誘導する。
(注5)病原体関連分子パターン(PAMPs)
病原体を構成する成分のうち哺乳類にはない病原体特異的な分子パターン。細菌の細胞壁を構成するペプチドグリカンや、グラム陰性菌の外膜構成成分であるリポ多糖、ウイルス由来のDNAやRNAなどがある。
(注6)スプリットワクチン
ウイルス粒子そのものを不活化した全粒子ワクチンではなく、ウイルスの抗原だけを精製したワクチン。例えばインフルエンザウイルスのヘマグルチニン(HA)ワクチンなど。
(注7)IgA抗体
血液中のIgG抗体と異なり、IgA抗体にはウイルスの感染の場となる粘膜面に積極的に分泌する機構が備わっている。このためIgA抗体は、上気道粘膜でウイルスの感染そのものを阻止することができる。
(注8)リゾチーム
細菌の細胞壁を構成する多糖類を加水分解する酵素であり、細菌に対し溶菌作用を示す。ヒトの涙や鼻汁、母乳などにも含まれている。