2021-08-20 理化学研究所,東京大学,神戸大学,新潟大学,帝京大学,京都先端科学大学
理化学研究所(理研)環境資源科学研究センター細胞機能研究チームの岩瀬哲上級研究員、杉本慶子チームリーダー(東京大学大学院理学系研究科教授)、植物免疫研究グループのアヌポン・ラオハビシット研究員、白須賢グループリーダー(東京大学大学院理学系研究科教授)、神戸大学大学院理学研究科の近藤侑貴准教授、新潟大学理学部の池内桃子准教授、帝京大学理工学部の朝比奈雅志准教授、京都先端科学大学バイオ環境学部の福田裕穂教授らの共同研究グループは、転写因子[1]WINDが傷口のカルス化[2]だけでなく、道管[3]の再形成や病原菌への抵抗性獲得に重要な働きをしていることを発見しました。
本研究成果は、組織培養技術を用いた増産や品種改良、接ぎ木[4]の効率化、病害抵抗性付与など、植物による持続的な食料・バイオマスの生産に貢献する技術開発につながると期待できます。
植物は傷がつくと、組織の再生や防御応答などさまざまな生理反応を起こしますが、これらの反応を統合的に活性化させる分子の存在は知られていませんでした。
転写因子WINDの一つであるWIND1は、傷害ストレスによるカルス[2]形成や茎葉の再生を促進することが分かっています。今回、共同研究グループはシロイヌナズナ[5]を用いて、WIND1によって発現量が増加する遺伝子を網羅的に調べました。その結果、再生に関わる遺伝子だけでなく、道管の形成や防御応答に関与する遺伝子も発現が上昇することが分かりました。また、WIND1や他のWIND(WIND2~4)の機能を抑えると、接ぎ木における道管の再形成や病原菌に対する抵抗性が弱まったことから、実際にWINDが傷の修復や防御応答を統合的に制御する因子であることが明らかになりました。
本研究は、科学雑誌『New Phytologist』のオンライン版(8月10日付)に掲載されました。
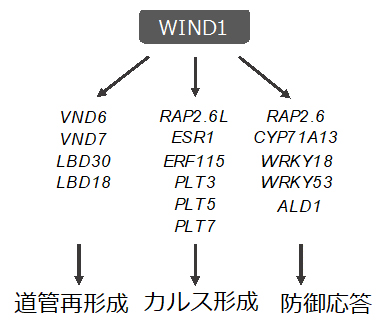
転写因子WIND1はカルス形成だけでなく、道管再形成と防御応答も制御する
背景
私たちの体は、傷がつくと傷口をふさいで治そうとすると同時に、病原菌の侵入や繁殖を抑えようとする免疫[6]応答が起こります。植物も同様に、傷口で組織の再生や防御応答など多様な生理反応が活性化しますが、これらの反応を統合的に制御する分子の存在は知られていませんでした。
岩瀬哲上級研究員らは、植物が種々のストレスに応じて組織再生を引き起こす分子メカニズムについて解析を進め、2011年にシロイヌナズナで傷口の細胞の脱分化を促進する「転写因子WIND1(WOUND INDUCED DEDIFFERENTIATION 1)」や、同じ機能を持つWIND2~4を発見しました注1)。さらに、分化した細胞ではWINDの働きをエピジェネティック[7]に抑える機構があること注2)、WINDがESR1という別の転写因子の働きを傷口で活性化させることで傷口におけるカルス形成や茎葉の再生を促進していることを明らかにしてきました注3)。
今回、共同研究グループは、転写因子WINDによって発現する遺伝子を網羅的に調べ、傷口の再生に関わる因子の探索やWINDのこれまで知られていなかった機能を解析しました。
注1)2011年3月11日プレスリリース「植物細胞の脱分化を促進するスイッチ因子を発見」
注2)2015年6月30日プレスリリース「植物の分化全能性抑制の分子メカニズムの一端を解明」
注3)2017年1月17日プレスリリース「植物が傷口で茎葉を再生させる仕組み」
研究手法と成果
共同研究グループはまず、培地にエストラジオールという化合物を添加することで、WIND1遺伝子を発現誘導できるシロイヌナズナ植物体(XVE-WIND1)を作製しました。10日齢の無傷の芽生えを用いて、WIND1遺伝子を発現誘導してから0、1、3、6、12、24時間が経過した時点での遺伝子発現をDNAマイクロアレイ法[8]で調べたところ、約2,400個の遺伝子が誘導後24時間以内に発現することが分かりました(図1)。
これらの遺伝子は発現パターンにより、四つのグループに分けられました。初期に一過的な発現を示すグループ(発現誘導後1~3時間で発現量が上昇し、6時間後には元に戻る)には、病害応答に関係する遺伝子が多く含まれていました。恒常的な発現を示すグループ(発現誘導後1~3時間で発現量が上昇し、24時間後まで高い発現量を維持する)には、さまざまな転写因子の遺伝子が多く含まれており、WIND1が転写ネットワークの重要な制御因子として機能していることが示唆されました。この恒常的な発現グループや、遅いタイミング(発現誘導後12時間後や24時間後)で発現を示すグループには、傷害応答に関係する遺伝子、水分欠乏に応答する遺伝子、細胞壁のリモデリングに関与する遺伝子などが多く含まれていました。
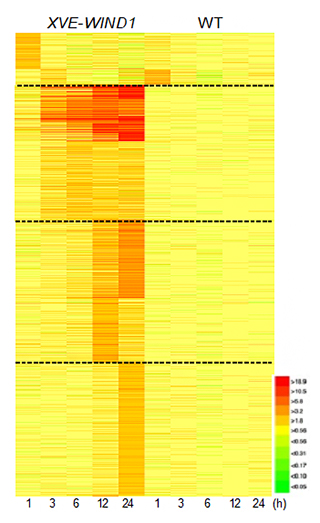
図1 シロイヌナズナにおいて転写因子WIND1により発現する遺伝子のグループ分け
エストラジオールの添加によりWIND1遺伝子の発現を誘導できる植物体(XVE-WIND1)では、約2,400個の遺伝子が24時間後以内に発現した。図ではそれらの遺伝子を縦軸に並べ、時間経過による遺伝子発現の変化量を横軸に表した。赤色は発現量の上昇、黄色は変化なし、緑色は低下を意味する。破線で発現のパターンによって四つのグループに分けている。野生株(WT)では、ほとんど発現量の変化は起きていない。
細胞機能研究チームはこれまで、文献調査から細胞リプログラミング(初期化)に関わる遺伝子91個をリスト化していましたが、そのうち30個の遺伝子がWIND1遺伝子の発現誘導後24時間以内に発現していました。それらの中にはESR1遺伝子が含まれており、ほかにもLBD18、OBP4、ESR2、RAP2.6L、ERF115、WUS、PLT5、WOX5、LEC2、ANAC071など重要な転写因子の遺伝子が含まれていました。
そこで、これらの因子の機能抑制植物体または機能欠損変異体を作製し、傷害処理後のカルス形成を観察しました。また、WIND1の機能抑制植物体(WIND1-SRDX[9])でそれぞれの因子の遺伝子の発現量を指標にして調べたところ、葉柄(葉と茎をつなぐ部位)の傷口では、RAP2.6LやERF115がWIND(WIND1~4)の下流因子としてカルス化を促進していることが分かりました(図2)。これら二つの転写因子の遺伝子も、WINDやESR1と同様にAP2/ERF型の転写因子[10]のグループに含まれており、それらが階層的な制御関係をもってカルス化を促進していることが明らかになりました。
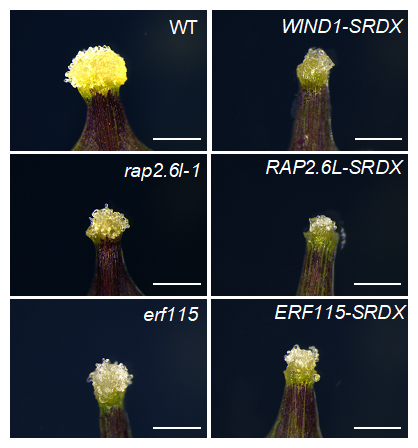
図2 WIND1が制御する転写因子の機能抑制・欠損株における傷口のカルス形成抑制
シロイヌナズナの葉柄の切断部位にできたカルスの写真。黄色の部分がカルス。転写因子WIND1の機能抑制植物体(WIND1-SRDX)、RAP2.6LとERF115という転写因子の機能欠損変異体(rap2.6l-1とerf115)および機能抑制植物体(RAP2.6L-SRDXとERF115-SRDX)のカルスは、野生株(WT)に比べて小さかった。スケールバーは1mm。
次に、いまだに知られていないWINDの機能として、道管の再形成に着目しました。これまでに、カルス細胞塊の中で道管を構成する管状要素(細胞壁にリグニン[11]が沈着した死細胞)がつくられることや、傷害ストレスが傷口の細胞を管状要素に分化転換[12]させる現象が報告されています。今回、WIND1遺伝子を誘導した際に発現上昇する細胞壁関連の遺伝子の中にも、管状要素形成を促進する転写因子の遺伝子が見いだされたことから、「傷口やカルスの中でWINDが道管の再形成に関与する」という仮説を立てました。
詳細に観察したところ、WIND1遺伝子を過剰発現させた植物体では、子葉の葉肉細胞や根先端の根毛細胞などが管状要素に分化転換していることが分かりました。これは、WIND1の機能の一つに管状要素形成が含まれることを示す重要なデータです。そこで、VISUAL(Vascular Cell Induction Culture System Using Arabidopsis Leaves)法[13]を用いて、4日間程度の液体培養条件下で、人為的に葉肉細胞を管状要素が含まれる維管束[3]細胞への分化転換を誘導したところ、WIND1機能抑制植物体(WIND1-SRDX)やWIND1~4の遺伝子機能が全て破壊されたwind1/2/3/4四重変異体では、異所的な管状要素の形成が抑えられることが分かりました(図3)。また、VISUAL法の培養開始から48時間において、WIND1-SRDX植物体では道管の形成に関与する遺伝子(VND7やLBD15など)の発現上昇が抑えられていることが分かりました。
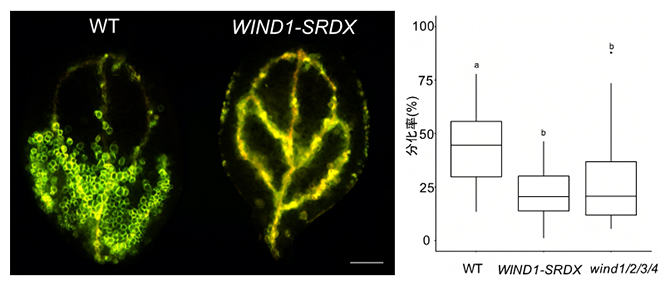
図3 転写因子WINDの機能抑制・欠損株における管状要素の形成抑制
左)VISUAL法を用いて、WTとWIND1の機能抑制植物体(WIND1-SRDX)の子葉の葉肉細胞を維管束細胞に分化転換した。緑色や黄色が管状要素を示す。WIND1-SRDXでは異所的な管状要素がほとんどできずに、元からある維管束の管状要素(道管)だけが黄色に染まっており、WTに比べて管状要素が少ないことが分かる。スケールバーは0.5mm。
右)子葉全体の面積における蛍光面積の割合で概算した管状要素への分化率のグラフ。WIND1-SRDXと機能欠損変異体(wind1/2/3/4)では、管状要素形成が抑えられることが分かった。
そこで、これらのWIND機能抑制植物体で、組織の再接着と道管の再形成を評価しました。実験方法としては、葉を葉柄部分でいったん切断し、再び同じ部位で接ぐ葉柄の接ぎ木(接ぎ葉)をした後、根から蛍光色素を含む水を吸収させ、葉身(葉)の維管束における蛍光を確認した後、葉を引っ張りました。
この結果、WIND1-SRDX植物体やwind1/2/3/4四重変異体では、道管再形成が著しく阻害されることが分かりました(図4左)。この阻害は、WIND1遺伝子のみの機能が欠損したwind1変異体でも観察されたことから、葉柄の接ぎ葉面で見られる道管再形成にはWIND1の機能が重要であることが分かりました。また、WIND1-SRDX植物体では、組織の再接着も阻害されたことから、切断面に形成されるカルスの質(大きさ、細胞壁の質など)が組織の再接着に影響することが示唆されました(図4右)。
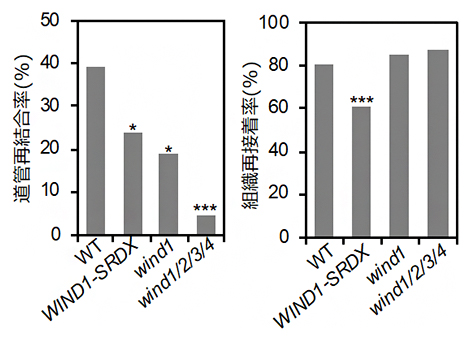
図4 転写因子WINDの機能抑制・欠損株における道管再結合の抑制
葉柄の接ぎ木(接ぎ葉)法を用いて、WINDの組織再接着能(左)と道管再結合能(右)を評価した。機能抑制植物体(WIND1-SRDX)では、組織再接着率と道管再結合率の両方が低く、機能欠損変異体(wind1、wind1/2/3/4)では、道管再結合率が低くなった。これは、組織再接着ではWINDのほかに機能重複する因子が多く存在することや、組織接着面における道管再結合においてはWINDの貢献度がより高いことを示唆している。
最後に、WINDと病害応答の関係を調べました。植物の病害応答機構を調べるには、シロイヌナズナに感染し斑点病を引き起こすバクテリアPseudomonas syringae pv. tomato DC3000株[14]がよく用いられます。このバクテリアに感染したシロイヌナズナで発現する遺伝子を調べた先行研究の遺伝子リストと、今回調べたWIND1遺伝子によって誘導される遺伝子のリストは統計的有意に重複していました。そこで、野生株、WIND1-SRDX植物体、wind1/2/3/4四重変異体に、それぞれP. syringaeを感染させました。すると、WIND1-SRDX植物体やwind1/2/3/4四重変異体では、野生株に比べてP. syringaeの高い増殖が見られました(図5)。これはWIND転写因子がP. syringaeの増殖を抑える働きを持っていることを示しています。
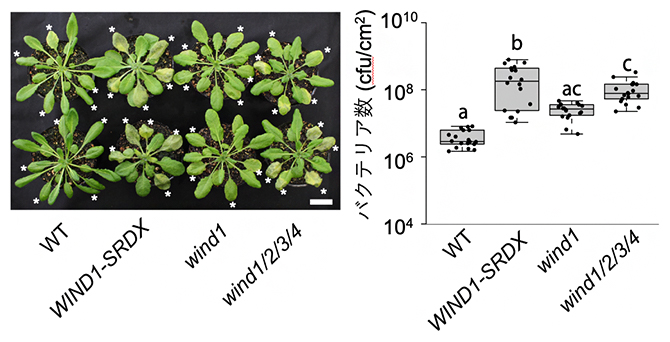
図5 転写因子WINDの機能抑制・欠損株における病原菌への感受性の上昇
シロイヌナズナ野生株(WT)、WIND1-SRDX変異体、wind1変異体、wind1/2/3/4四重変異体の*のついている葉に病原菌を等量注入後3日後、コロニーカウント法で増殖した菌体数を数えた(左)。この結果、WIND1-SRDX変異体とwind1/2/3/4四重変異体では、野生株と比べて統計的有意に菌が増殖しやすい、すなわち抵抗性が弱いことが分かった(右)。スケールバーは2cm。
機能欠損によってP. syringaeの感染性が上がることは既に報告されており、これに加えWIND1遺伝子の発現誘導で発現レベルが増加するいくつかの重要な遺伝子の傷害後の発現を調べました。その結果、野生株では傷害後の葉柄部位で、抗菌性の二次代謝産物であるカマレキシン[15]の合成に関わるCYP71A13遺伝子や、病害抵抗性を誘発する化合物であるピペコリン酸[16]の合成に関わるALD1遺伝子などの発現が上昇することや、反対にWIND1-SRDX植物体やwind1/2/3/4四重変異体ではその発現が抑えられることが分かりました(図6)。
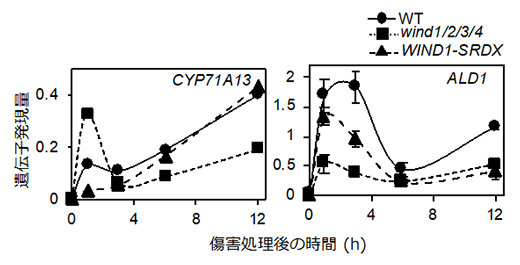
図6 WINDの機能抑制・欠損株における防御応答関連遺伝子の傷害による発現上昇の抑制
シロイヌナズナの葉柄部位を切断し、葉を植物ホルモンを含まない培地で培養して、0、1、3、6、12時間後の切断部位におけるCYP71A13遺伝子(左)とALD1遺伝子(右)の発現をRT-qPCR法で解析した。野生株(WT)ではどちらの遺伝子も発現が上昇した。一方、WIND1-SRDX植物体とwind1/2/3/4四重変異体では、野生株(WT)と比べて発現が著しく抑えられる複数のタイムポイントが存在することが分かった。
今後の期待
本研究から、転写因子WIND1や他のWIND(WIND2~4)は、傷口のカルス化、組織の再接着、道管の再結合といった組織の再生機構や、バクテリアなどへの防御応答を統合的に制御し得る分子であることが分かりました。傷害ストレスは、傷口から病原体が感染するリスクを伴うため、再生と免疫反応を同時に高めることは生理学的に理にかなっています。例えば、哺乳類でも傷害に反応して発現が上昇し、創傷部位の再生、血管新生、体液性免疫の活性化など、幅広い機能を持つ転写因子が存在することが知られています。WINDのように複数の経路を素早く誘導できる因子を持つことは、進化の過程で植物の生存に有利であったと考えられます。
今後、傷口での防御活性化物質の合成にWINDが実際に関わっているのかどうかや、どのように多様な遺伝子を誘導できるのかなどの分子メカニズムの解明も進めていく予定です。ナタネなどの実用作物での検討も並行して進めていくことで、組織培養技術を用いた増産や品種改良、接木の効率化や病害抵抗性付与など、植物による持続的な食料・バイオマス生産に貢献する技術開発につながると期待できます。
また、本研究成果は、国際連合が2016年に定めた17項目の「持続可能な開発目標(SDGs)[17]」のうち「2.飢餓をゼロに」と「15.陸の豊かさも守ろう」に大きく貢献するものです。
補足説明
1.転写因子
特定のDNA配列に結合し、遺伝子発現を制御するタンパク質の一群。遺伝子発現のスイッチに例えられ、遺伝子発現を促進するものを転写活性化因子、抑えるものを転写抑制因子と呼ぶ。
2.カルス化、カルス
カルスは植物が傷害部位に形成する細胞塊を元来示す言葉であり、癒傷組織とも呼ばれる。現在では、広く組織培養条件下で組織片から生じる細胞塊を示す言葉として使われている。カルスが生じることをカルス化と呼ぶ。医学分野では、骨折の後に生じる小さな骨断片や、皮膚にできる硬い組織、胼胝(たこ)もカルスと呼ばれる。
3.道管、維管束
植物は、水や光合成でつくった糖などの栄養を運ぶための通道組織を持っている。水や無機養分を運ぶための管が道管であり、栄養を運ぶための管が篩管である。維管束は多くの道管や篩管などが集まって束になっている部分を指す。
4.接ぎ木
植物体を切断面で接着させる方法で、農業的にも植物の基礎科学でも古くから用いられている。例えば、病害虫に強い根を持つ近縁種を台木とし、良い実のなる品種を穂木として接ぐことで、病害虫に強く良い実のなる個体を作ることができる。接ぎ木が起こる断面ではカルスの形成が頻繁に見られ、カルスの質が接ぎの良し悪しに影響することが知られている。接ぎ木面では、台木と穂木の組織同士の道管や篩管の再結合が起こる。
5.シロイヌナズナ
アブラナ科の植物。2000年に全ゲノム配列が解読されており、植物が持つ環境応答機能や個々の遺伝子機能を調べるために、世界中で研究材料に用いられている。
6.免疫
体内に侵入した異物や病原菌に対して抵抗、排除、死滅させたりする能力のことで、先天的に備わっている免疫を自然免疫、後天的に備わり記憶される免疫を獲得免疫という。植物は自然免疫を持ち、感染細胞が病原菌を巻き込んで死滅したり、防御のための低分子化合物やタンパク質の生産を活性化させたりすることが知られている。
7.エピジェネティック
近年、DNAのメチル化やDNAが巻きつくヒストンタンパク質の化学修飾(メチル化やアセチル化など)によって、遺伝子発現のしやすさが変化し、かつその状態が細胞分裂後の娘細胞や場合によっては次世代に受け継がれることが分かってきた。このような、遺伝子の本体であるDNAの塩基(A、T、G、C)の並び方の変化に依存しないで起こる遺伝子発現の制御や伝達を研究する研究分野を、エピジェネティクス(epi-後生的な、genetics-遺伝学)と呼ぶ。エピジェネティックはその形容詞的用法をする語で、もっぱらDNAメチル化やヒストン修飾によって支配される遺伝子発現の変化の状態を示す。
8.DNAマイクロアレイ法
網羅的遺伝子発現解析法の一つ。ある生物が有する全ての遺伝子や、調べたい遺伝子を選抜してその実体であるDNAを基盤に固定したもの(マイクロアレイ)を予め作製しておく。ここに、任意の状態の生体から取り出したmRNAを鋳型にして逆転写でcDNAに変換したのち蛍光を発する分子をつけておく。この蛍光標識したcDNAをマイクロアレイと反応させ、蛍光強度を読み取ることで、着目した遺伝子の発現量を定量的かつ網羅的に調べることができる。
9.SRDX
平津圭一郎博士らによって2002年に報告されている。転写抑制因子であるSUPERMANタンパク質から見つかった短いアミノ酸配列ドメイン(LDLDLELRLGFA)で、これを転写活性化因子のアミノ酸配列に付与することで、強い転写抑制因子(キメラリプレッサー)に変換できる。キメラリプレッサーを発現した植物は、ドミナントネガティブな表現型を示す。これは、キメラリプレッサーが機能重複する他の転写因子に優先して標的遺伝子の発現を抑制するためと考えられており、最近ではこのドメインがヒストン化学修飾関連制御因子と結合することが報告されている。SUPERMAN Repression Domain Xの略。
10.AP2/ERF型の転写因子
転写因子はそのタンパク質構造の中にDNAと結合するためのアミノ酸配列領域(ドメイン)を持ち、通常その領域のアミノ酸配列の進化的保存性が高いため、ドメインによる分類が可能である。ドメインの特徴ごとにまとめた因子群は、「型」や「ファミリー」の語を伴って総体として表現されることがある。AP2とERFはそれぞれ個別の転写因子の名前であり、これらの因子と類似のドメインを持つ転写因子をAP2/ERF型やAP2/ERFファミリーと表現する。真核生物に普遍的に保存されているドメインや、その種に特異的に保存されているドメインがある。AP2/ERF型は植物特異的な転写因子群であると考えられている。
11.リグニン
植物に含まれる高分子化合物で、モノリグノールと呼ばれるフェノール性の化合物が重合したもの。細胞の二次壁や道管をはじめ、根のカスパリー線、葯壁の内被細胞、鞘の開裂部などに分布しており、疎水性と構造の硬さから通水や開裂機構で機能している。
12.分化転換
広義には、一度分化し機能を持った細胞が別の分化状態に変化することの意味で用いられる。シロイヌナズナのVISUAL法において葉肉細胞が管状要素に分化転換する際には、一度幹細胞的な性質を持つ細胞に脱分化していることが維管束幹細胞のマーカー遺伝子の発現から示されている。狭義には、幹細胞化を経ることなく直接変換すること(Transdifferentiation)を示す語としても用いられる。
13.VISUAL(Vascular Cell Induction Culture System Using Arabidopsis Leaves)法
共同研究グループの近藤侑貴博士、福田裕穂博士らによって2016年に開発された手法で、シロイヌナズナの芽生えの子葉などを用いて、一度分化した細胞(例えば葉肉細胞)を、維管束幹細胞性を持つ細胞に脱分化させた後に、道管や篩管などの維管束を構成する細胞に再分化させることができる。培養開始からわずか4日程度で細胞の分化転換が起こせることや、細胞の同調性が高いことから、維管束細胞形成のメカニズム解明に近年頻繁に用いられている。
14.Pseudomonas syringae pv. tomato DC3000株
Pseudomonas syringaeはバクテリアの一種であり、グラム陰性桿菌に分類される。植物の葉の表面などに生息し、気孔や組織の傷口から侵入して病原性を発揮する。tomato DC3000株はトマトやシロイヌナズナ属の植物を宿主とする。
15.カマレキシン
シロイヌナズナがつくる二次代謝産物の一つ(含硫インドールアルカロイドに分類される)で、病原体の感染に対する化学的な防御物質である。アミノ酸の一種トリプトファンから7回の酵素反応により合成されると考えられており、CYP71A13はカマレキシン前駆体のインドール-3-アセトアルドキシムからインドールアセトニトリルの反応をつかさどる酵素である。
16.ピペコリン酸
アミノ酸の一種リジンから生合成されるカルボン酸の一種。植物では病害応答によって生合成が促進され、ピペコリン酸から生じるN-ヒドロキシ-ピペコール酸が全身性獲得抵抗性を引き起こす重要なシグナル因子であることが近年明らかになっている。ピペコリン酸生合成の重要な酵素であるALD1は、その機能が欠損すると病害抵抗性が弱まることが知られている。
17.持続可能な開発目標(SDGs)
2015年9月の国連サミットで採択された「持続可能な開発のための2030アジェンダ」にて記載された2016年から2030年までの国際目標。持続可能な世界を実現するための17のゴールから構成され、地球上の誰ひとりとして取り残さないことを誓っている。SDGsは発展途上国のみならず、先進国自身が取り組むユニバーサル(普遍的)なものであり、日本としても積極的に取り組んでいる。
共同研究グループ
理化学研究所 環境資源科学研究センター
細胞機能研究チーム
上級研究員 岩瀬 哲(いわせ あきら)
(科学技術振興機構(JST) さきがけ研究員)
テクニカルスタッフⅡ 竹林 有理佳(たけばやし ありか)
チームリーダー 杉本 慶子(すぎもと けいこ)
(東京大学 大学院理学系研究科 教授)
植物免疫研究グループ
研究員 アヌポン・ラオハビシット(Anuphon Laohavisit)
グループディレクター 白須 賢(しらす けん)
(東京大学 大学院理学系研究科 教授)
神戸大学 大学院理学研究科 生物学専攻
准教授 近藤 侑貴(こんどう ゆうき)
新潟大学 理学部
准教授 池内 桃子(いけうち ももこ)
帝京大学 理工学部 バイオサイエンス学科
研究員(研究当時) 松岡 啓太(まつおか けいた)
准教授 朝比奈 雅志(あさひな まさし)
産業技術総合研究所 生物プロセス研究部門 植物機能制御研究グループ
グループ長 光田 展隆(みつだ のぶたか)
東京大学 大学院理学系研究科 生物科学専攻
教授(2021年3月退官) 福田 裕穂(ふくだ ひろお)
(現 京都先端科学大学 バイオ環境学部 教授)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究(C)「傷害誘導性脱分化の分子ネットワーク解析(研究代表者:岩瀬哲)」、新学術領域(研究領域提案型)「植物の生命力を支える多能性幹細胞の基盤原理」の研究課題「非生物ストレスによる維管束幹細胞新生の分子メカニズム(研究代表者:岩瀬哲)」「傷害ストレス誘導性カルスの幹細胞新生メカニズム(研究代表者:岩瀬哲)」)、同基盤研究(B)「植物の器官再生を制御する分子機構(研究代表者:杉本慶子)」、学術変革領域研究(A)「不均一環境変動に対する植物のレジリエンスを支える多層的情報統御の分子機構」の研究課題「植物の環境レジリエンスを支える傷害修復機構(研究代表者:杉本慶子)」、科学技術振興機構(JST)の戦略的創造研究推進事業さきがけ「植物分子の機能と制御(研究統括:西谷和彦)」による助成を受けて行われました。
原論文情報
Akira Iwase, Yuki Kondo, Anuphon Laohavisit, Arika Takebayashi, Momoko Ikeuchi, Keita Matsuoka, Masashi Asahina, Nobutaka Mitsuda, Ken Shirasu, Hiroo Fukuda, Keiko Sugimoto, “WIND transcription factors orchestrate wound-induced callus formation, vascular reconnection and defense response in Arabidopsis”, New Phytologist, 10.1111/nph.17594
発表者
理化学研究所
環境資源科学研究センター 細胞機能研究チーム
上級研究員 岩瀬 哲(いわせ あきら)
チームリーダー 杉本 慶子(すぎもと けいこ)
(東京大学 大学院理学系研究科 教授)
植物免疫研究グループ
研究員 アヌポン・ラオハビシット(Anuphon Laohavisit)
グループディレクター 白須 賢(しらす けん)
(東京大学 大学院理学系研究科 教授)
神戸大学大学院 理学研究科 生物学専攻
准教授 近藤 侑貴(こんどう ゆうき)
新潟大学 理学部
准教授 池内 桃子(いけうち ももこ)
帝京大学 理工学部 バイオサイエンス学科
准教授 朝比奈 雅志(あさひな まさし)
京都先端科学大学 バイオ環境学部
教授 福田 裕穂(ふくだ ひろお)
報道担当
理化学研究所 広報室 報道担当
東京大学大学院理学系研究科 広報室
神戸大学 総務部広報課
新潟大学 広報室
帝京大学本部広報課
京都先端科学大学 広報課