2022-05-19 神戸医療産業都市推進機構,日本医療研究開発機構
神戸医療産業都市推進機構先端医療研究センター血液・腫瘍研究部の林康貴特任研究員(日本学術振興会特別研究員SPD)、井上大地部長、東京大学医科学研究所先端医療研究センター細胞療法分野の北村俊雄教授(現神戸医療産業都市推進機構先端医療研究センター長)らの研究チームは、骨髄異形成症候群(Myelodysplastic Syndromes, MDS)(注1)においてMDS細胞から放出される細胞外小胞(エクソソーム)(注2)が骨髄間葉系幹細胞(MSC)(注3)の分化障害を介して正常造血に対するニッチ機能を破綻させ、造血不全を引き起こす新しいメカニズムを解明しました。
MDSは遺伝子異常をもつ造血幹細胞(Hematopoietic Stem Cell, HSC)(注4)に起因する悪性疾患であり、無効造血(注5)による血球減少をきたし、高率に急性骨髄性白血病(Acute Myeloid Leukemia, AML)に形質転換することが知られています。AMLと異なり増殖が遅くアポトーシスの亢進を特徴とするMDS細胞が、経時的に骨髄中で正常HSCに対して優位性を獲得するメカニズムは分かっていませんでした。
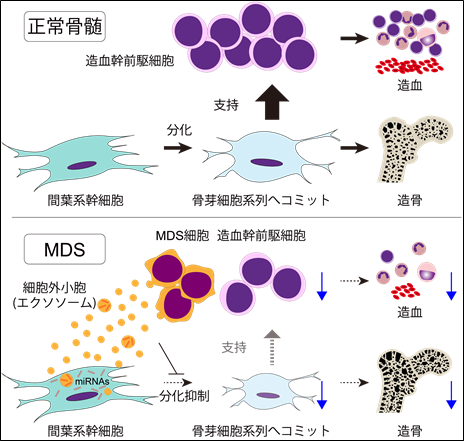
本研究では、骨髄微小環境を構成する細胞群のうち、骨芽細胞系列にコミットしたMSCが正常造血のサポートに不可欠であり、MDS細胞がMSCの骨芽細胞系列への分化抑制を介して正常造血を間接的に負に制御していることを明らかにしました。またこの制御機構には、MDS細胞由来のエクソソームに含有されるmiRNA群が重要な役割を果たすことが示されました。その一方でMSCの数や多分化能は維持されており、骨芽細胞系列への分化誘導を促進することで造血支持能が回復することが分かりました。これらの結果は骨髄微小環境の改善が造血抑制の解除につながることを示しており、MDS の新規治療法の開発に大きく貢献することが期待されます。
本研究成果は、2022年5月11日(米国東部時間)に国際科学誌『Cell Reports』(オンライン版)に掲載されました。
研究の背景と概要
赤血球や白血球、血小板といった成熟血球細胞は全て造血組織の幹細胞である造血幹細胞(Hematopoietic Stem Cell, HSC)より産生されます。造血幹細胞は骨髄の様々な細胞からなる微小環境(造血幹細胞ニッチ)の支持を受け、自己複製や成熟血球細胞への分化が制御されると考えられています。骨髄間葉系幹細胞(Mesenchymal Stem Cell, MSC)は造血幹細胞ニッチを構成する細胞の一つであり、骨芽細胞や軟骨細胞、脂肪細胞等、様々な細胞への分化能を有し、微小環境を構成する細胞を供給しています。
骨髄異形成症候群(Myelodysplastic Syndromes, MDS)は遺伝子異常をもつHSCに起因する悪性疾患であり、無効造血による血球減少をきたし、高い比率で急性骨髄性白血病(Acute Myeloid Leukemia, AML)に形質転換することが知られています。MDS においてHSC だけでなくMSC の機能異常が知られており、また、マウスモデルを用いた研究から、MSC の機能異常は造血器疾患様の病態を引き起こすことが報告されてきました。しかしながら、AMLと異なり増殖が遅く、アポトーシスの亢進を特徴とするMDS細胞が、経時的に骨髄中で優位性を獲得するメカニズムは分かっていませんでした。そこで、本研究ではエクソソームを始めとする細胞外小胞(Extracellular Vesicle, EV)に着眼し、 MSC の異常とそれを引き起こす原因と、正常造血を抑制して相対的にMDS細胞が優位になるメカニズムの解明を目指しました。
まず、MDSモデルマウスを用いた解析および、MDS細胞と正常造血幹細胞との共培養実験の結果から、MDSにおける正常造血の抑制は骨髄微小環境を介した間接的なものと考えられました。そこで病理標本とマイクロCT による解析を行ったところ、MDSモデルマウスでは顕著な骨量の減少を確認しました。血中の骨代謝マーカーの計測値、骨形成計測データが顕著な造骨抑制を示す一方で破骨細胞の活性亢進を認めず、骨形成の低下がその原因と考えられました。こうした骨代謝の異常は、ヒトMDS患者検体においても認められました。骨形成低下の原因としてMSC から骨芽細胞への分化プログラムを評価するため、単一細胞レベルでのRNAシークエンスを実施しました。MSCはマーカー遺伝子の発現や分化系列とその段階によって骨芽細胞系列や線維芽細胞等のクラスターに分類され、MDSマウスでは骨芽細胞系列クラスターの著しい減少を認めました。その一方でMSCの数や多分化能は維持されており、MDS環境下でMSC の分化障害は起こるものの、MSC本来の能力は保たれていると考えられました。
次に骨芽細胞系列への分化障害を起こしたMSCが造血抑制を引き起こしていることを確認するため、正常あるいはMDS由来MSC と正常造血幹前駆細胞(Hematopoietic Stem Progenitor Cell, HSPC)の共培養を行いました。2週間共培養後に正常HSPC のコロニー形成能を調べた結果、MDS群では正常HSPC のコロニー形成能が障害され、造血支持能の低下が確認されました。この造血抑制は、MSC に骨芽細胞への分化誘導を促進することで完全にレスキューされ、MSCの骨芽細胞への分化が造血支持能の回復に不可欠であることが明らかとなりました。
続いてMDS細胞とMSC における細胞間コミュニケーションの手段としてエクソソームに着目し、その影響を骨芽細胞系列分化と造血支持能の観点から解析を行いました。MDS 由来のエクソソームは骨芽細胞分化の関連遺伝子の発現誘導を抑制し、また造血支持能を低下させることがわかりました。エクソソームはマイクロRNA(miRNA)(注6)等の機能分子を輸送する媒体として知られています。そこでMDS由来エクソソームがMSCに異常を起こすメカニズムを詳細に解析するため、エクソソーム内に包含されるmiRNAの網羅的発現解析を行いました。興味深いことに、2種類のMDSモデルマウスと、38検体のMDS患者由来エクソソームにおいて高発現するmiRNA群は、多くのシグナルパスウェイを共通して標的としており、その中にはMSCの生存・増殖や骨芽細胞分化に関わるものを多く含んでいました。これらの結果から、MDS細胞から放出されるエクソソームに含まれるmiRNAが、MSCに異常を生じ造血不全を引き起こす上で主要な役割を担っていると考えられます。
研究の成果と意義・今後の展開
本研究は、骨髄異形成症候群(MDS)ではMDS細胞が産生するエクソソームが骨髄間葉系幹細胞(MSC)の骨芽細胞分化障害を介して造血不全を惹起することを明らかにしました。この知見は骨髄微小環境の改善により造血抑制の解除につながることを示しています。MDS は骨髄移植以外に根治療法のない難治疾患です。しかし罹患者の多くは高齢者であるため移植療法の対象となりにくく、造血不全による輸血依存に陥りやすいという問題があります。そのため骨髄微小環境の改善で正常造血を回復させることができれば、輸血依存の解消につながると期待されます。またMDS細胞より分泌されるエクソソームを抑制できれば、MDS の治療に大きく貢献することが期待されることから、エクソソームを制御し骨髄環境を改善する新規治療法の開発に取り組んでいます。
特記事項
本研究は日本医療研究開発機構(AMED)の革新的先端研究開発支援事業ソロタイプ「生体組織の適応・修復機構の時空間的解析による生命現象の理解と医療技術シーズの創出」(研究開発代表者:井上大地)、JSPS科研費(15H04855, 20K21622, 20J01911, 21K16258)、先進医薬研究振興財団、テルモ生命科学振興財団、大和証券ヘルス財団、横浜市立大学先端医科学研究センター共同利用・共同研究拠点事業「マルチオミックスによる遺伝子発現制御の先端的医学共同研究拠点」、日本新薬公募研究助成の支援によって行われました。
掲載論文
- 英文タイトル
- MDS cells impair osteolineage differentiation of MSCs via extracellular vesicles to suppress normal hematopoiesis
- タイトル和訳
- MDS細胞は分泌する細胞外小胞を介してMSCの骨芽細胞系列への分化を傷害し正常造血を抑制する
- 著者名
- Hayashi Y, Kawabata KC, Tanaka Y, Uehara Y, Mabuchi Y, Murakami K, Nishiyama A, Kiryu S, Yoshioka Y, Ota Y, Sugiyama T, Mikami K, Tamura M, Fukushima T, Asada S, Takeda R, Kunisaki Y, Fukuyama T, Yokoyama K, Uchida T, Hagihara M, Ohno N, Usuki K, Tojo A, Katayama Y, Goyama S, Arai F, Tamura T, Nagasawa T, Ochiya T, Inoue D*, Kitamura T*.
*corresponding author - 掲載誌
- Cell Reports
- DOI
- 10.1016/j.celrep.2022.110805
用語解説
- (注1)骨髄異形成症候群(MDS)
- 遺伝子異常をもつ造血幹細胞に起因する造血器腫瘍で、無効造血による血球減少や血液細胞の形態異常を特徴とする。高齢者に多く、造血不全、感染症、白血病への進展などをきたす予後不良な疾患群である。
- (注2)細胞外小胞(エクソソーム)
- 細胞から分泌される、脂質二重膜構造をもつ100nmほどの小胞。miRNA等の核酸やタンパク質、脂質等の機能分子を内包しており、細胞間コミュニケーションのツールとして機能しうることが示されている。サイズや分泌経路等による様々な名称の細胞外小胞をまとめてExtracellular vesicles, EVsと呼称することが推奨されているが、ここではより世間に浸透しているエクソソームの名称を用いた。
- (注3)間葉系幹細胞(MSC)
- 骨髄や脂肪などの間葉組織に存在する、自己複製能と他分化能をもつ体性(組織)幹細胞のひとつ。骨や軟骨、脂肪細胞等へ分化することができる。
- (注4)造血幹細胞(HSC)
- 主に骨髄中に存在する造血系の組織幹細胞で、自己複製能を有し、赤血球や白血球、血小板といった成熟血球細胞を産生する。
- (注5)無効造血
- 造血幹細胞からの成熟過程でアポトーシスや分化異常により血球が壊れ、末梢血中で正常な血球細胞が減少した状態。
- (注6)マイクロRNA(miRNA)
- 21から25塩基からなる1本鎖RNA分子であり、タンパク質をコードしないノンコーディングRNAの一つ。一般に標的遺伝子の3’UTRを認識し、標的mRNAの翻訳抑制や分解によりその遺伝子発現を抑制すると考えられている。
本発表資料のお問い合わせ先
神戸医療産業都市推進機構
先端医療研究センター 血液・腫瘍研究部
部長 井上 大地 (いのうえ だいち)
本リリースの配信元
神戸医療産業都市推進機構
経営企画部 広報戦略課 永田・太田・森口
AMED事業に関するお問い合わせ先
日本医療研究開発機構(AMED)
シーズ開発・研究基盤事業部 革新的先端研究開発課