2022-06-01 東北大学,科学技術振興機構
ポイント
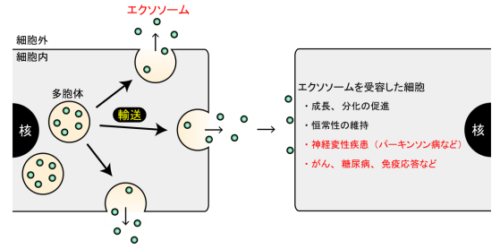
- 細胞から小胞に包まれて分泌されたエクソソームは、周囲の細胞の増殖や分化を制御し、さまざまな疾患とも関連
- 細胞内で形成されたエクソソームを、細胞膜へと輸送する新たな制御分子としてRab39AおよびRab39Bを同定
- Rab39Bは若年性パーキンソン病の原因遺伝子で、疾患変異型Rab39Bのエクソソーム分泌能が低下していることを発見
エクソソームにはさまざまな生理活性物質が含まれており、周囲の細胞や組織、器官の恒常性を調節しているほか、パーキンソン病などさまざまな疾患とも密接に関連しています。しかし、細胞内で形成されたエクソソームがどのようにして細胞膜まで輸送され、分泌に至るのか、その詳細な分子機構はこれまで不明でした。
東北大学 大学院生命科学研究科の松井 貴英 助教、福田 光則 教授らの研究グループは、エクソソームの細胞内輸送を制御する分子として、Rab39AおよびRab39B(以下、Rab39A/B)を発見しました。Rab39A/Bが正常に機能できない細胞では、エクソソームが核の周辺に蓄積し、その分泌が阻害されます。興味深いことに、Rab39Bは若年性パーキンソン病の原因遺伝子として知られていますが、その発症機序は不明でした。研究グループはパーキンソン病変異型Rab39Bを発現した細胞では、野生型細胞に比べ、エクソソーム分泌が減少することも見いだしました。今後、本研究成果が、Rab39Bとエクソソーム分泌に着目したパーキンソン病の新たな治療薬開発へと応用されることが期待されます。
本研究成果は、2022年6月1日付けで、米国の国際科学誌「Cell Reports」の電子版に掲載されます。
本研究成果は、科学技術振興機構(JST) 戦略的創造研究推進事業 CREST「細胞外小胞の形成・分泌とその異質性を生み出す分子機構の解明~人工細胞外小胞への展開(JPMJCR17H4)」(研究代表者:福田 光則 東北大学 大学院生命科学研究科 教授)、日本学術振興会・学術研究助成基金助成金 基盤研究C「エクソソームの多様性を生み出す分子基盤の解明(22K06197)」(研究代表者:松井 貴英 東北大学 大学院生命科学研究科 助教)などのサポートによるものです。
<論文タイトル>
- “Rab39 and its effector UACA regulate basolateral exosome release from polarized epithelial cells”
- DOI:10.1016/j.celrep.2022.110875
<お問い合わせ先>
<研究に関すること>
松井 貴英(マツイ タカヒデ)
東北大学 大学院生命科学研究科 助教
福田 光則(フクダ ミツノリ)
東北大学 大学院生命科学研究科 教授
<JST事業に関すること>
保田 睦子(ヤスダ ムツコ)
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
<報道担当>
東北大学 大学院生命科学研究科 広報室(担当:高橋 さやか)
科学技術振興機構 広報課