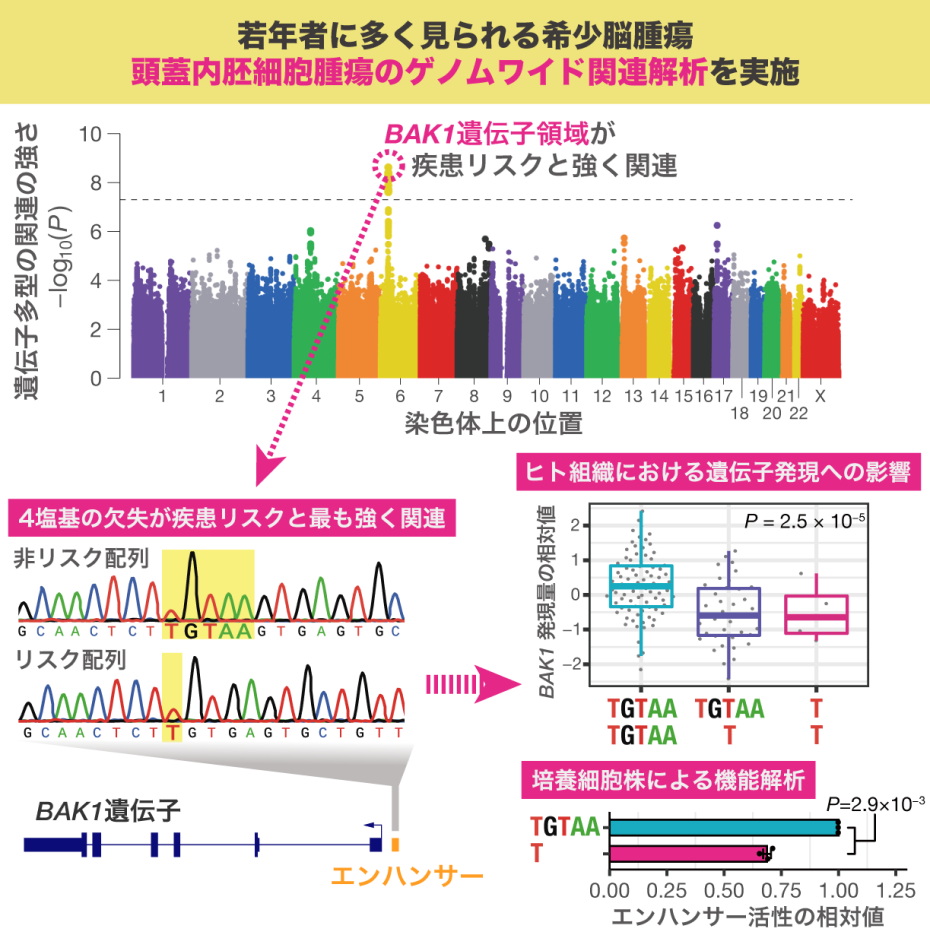
2022-08-25 日本原子力研究開発機構,量子科学技術研究開発機構
【発表のポイント】
- 一般に放射線治療では低確率で晩発の2次がんが発生することが知られていますが、重粒子線治療は放射線治療の中では2次がんの発生率が低いとの報告があります。放射線による2次がん発生の仕組みをより深く理解するためには、従来の治療部位周辺のみの線量評価だけでなく、患者全身の被ばく線量の評価が必要になります。
- 本研究では、過去の症例データから重粒子線治療の患者毎に異なる複雑な照射体系を構築し、シミュレーションにより患者全身の被ばく線量を高精度に評価するシステムRT-PHITS for CIRTを開発しました。
- 原子力機構が保有する放射線挙動解析技術と世界最多の重粒子線治療実績を持つ量研が保有する症例データを組み合わせることにより、重粒子線治療の2次がん発生率の低い理由を解明し、放射線による2次がん発生の仕組みを理解することで、未来の放射線治療に活かすことができます。
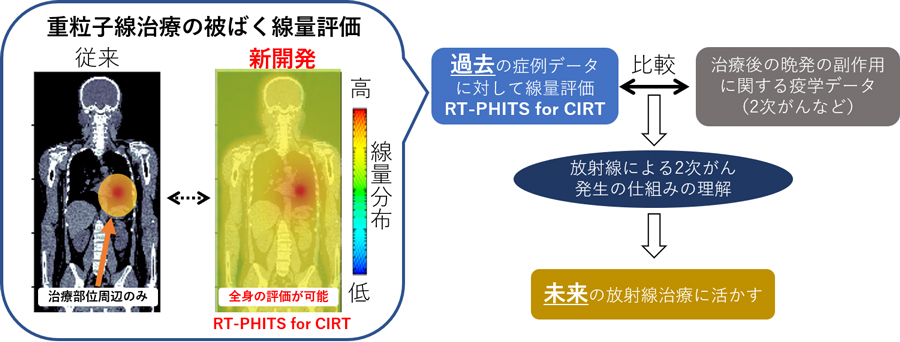
図1.開発した線量評価システム(RT-PHITS for CIRT)の役割のイメージ図
【概要】
国立研究開発法人日本原子力研究開発機構(理事長 小口正範、以下「原子力機構」という。)原子力基礎工学研究センター放射線挙動解析研究グループの古田琢哉研究主幹、国立研究開発法人量子科学技術研究開発機構(理事長 平野俊夫、以下「量研」という。)量子生命・医学部門放射線医学研究所放射線規制科学研究部の古場裕介主任研究員をはじめとするチームでは、重粒子線治療1)後の2次がん2)などの副作用の発生原因を究明することを目的として、患者の全身を対象とした線量評価システムRT-PHITS for CIRTを開発しました。
放射線治療では治療を行う腫瘍領域以外の正常組織への照射を完全に無くすことはできず、正常組織でがん(2次がん)などの副作用が発生するリスクがあります。2次がんなどの確率的に非常に低い割合で起きる晩発の副作用の原因を究明するには、患者体内の詳細な被ばく線量分布を基に、臓器ごとの被ばくがどの程度で、それにより副作用がどれくらい発生しているのかを膨大な数の患者に対して調べる必要があります。重粒子線治療ではX線やガンマ線を利用する治療に比べて2次がんの発生率が有意に低いとの報告3)があるものの、統計的に十分な症例データに対して、治療部位から離れた正常組織への被ばく線量を調べるシステムがなく、定量的な評価がされていませんでした。
そこで、原子力機構と量研では重粒子線治療後の副作用の発生原因の調査に必要となる詳細な被ばく線量データを取得するために、治療部位から遠く離れた正常組織を含む全身の正確な線量分布を評価できるシステムの開発を行いました。 本システムは、重粒子線治療の治療計画データ(照射装置の部品配置や患者体系の情報を含む)から治療時の照射体系4)の再構築に必要な情報を抽出し、コンピュータ上の仮想空間に再現します。 そして、原子力機構が中心となって開発したモンテカルロ放射線挙動解析5)コードPHITS6)を用いて、照射体系内の重粒子線および2次粒子の挙動を正確にシミュレーションします。 これにより、従来の線量評価に使用していた治療計画装置7)では評価ができない患者の体内や照射装置内で生じた2次粒子8)(中性子など)からの被ばくを含めて患者全身の詳細な線量分布の評価を実現しました。また、治療計画データを直接読み込み、線量分布を自動的に計算するシステムとすることで、膨大な数の患者データを処理できる体制を整えました。
本システムは、世界最多の重粒子線治療実績を持つ量研で、過去に実施した重粒子線治療の再評価に活用される予定です。評価結果を治療後の疫学データと組み合わせることで、2次がんなどの放射線治療後の副作用と被ばく線量の相関関係を明らかにすることができます。この症例データの再評価を通して重粒子線治療の2次がん発生率の低い理由や放射線治療における副作用の発生の仕組みを究明し、現状の腫瘍周辺のみの線量を評価する治療計画を超えて、将来的な副作用の発生リスクの低減を考慮した新たな放射線治療計画へと発展することが期待されます。
本研究成果は、国際科学誌「Physics in Medicine and Biology」に7月4日オンライン掲載されました。
【研究開発の背景と目的】
放射線治療は、手術や薬物療法と並ぶがん治療における三大治療の一つであり、その効果・身体的負担・副作用の少なさなどから年々治療件数が増えています。JROD(放射線治療症例全国登録事業)の2020年報告書では、国内で年間5万件以上の放射線治療の実施が報告されています。
放射線治療では腫瘍に線量を集中させることで周辺の正常組織への影響を軽減できますが、正常組織に当たる線量を完全に無くすことはできず、これが2次がんなどの晩発の副作用の発生の要因になります。重粒子線治療でも従来の放射線治療に比べて、より線量を腫瘍に集中できるものの、正常組織の副作用の発生リスクは無視できません。重粒子線治療の治療成績の向上や普及に伴い、腫瘍のがん細胞を死滅させる優れた治療効果だけではなく、報告されている低い2次がん発生率へも注目が集まっています。治療後の副作用の発生原因を調べるためには、腫瘍から離れた領域まで含めた患者全身の線量分布の評価が必要となりますが、従来の線量評価に使用していた治療計画装置では腫瘍周辺の線量分布しか評価できません。これは、治療計画装置では治療効果と周辺重要臓器の急性障害の回避を目的に、治療までの時間と計算精度を鑑みて、治療部位近傍に評価範囲を限定し、2次発がんなどの低確率の副作用に影響する低線量の領域までの線量評価を行わないためです。
そこで本研究では、患者体内および照射装置内の核反応で生じた中性子などの2次粒子の挙動まで正確にシミュレーション可能なモンテカルロ放射線挙動解析コードPHITSを用いて、重粒子線治療を再現することで、腫瘍から離れた正常組織までを含む広い領域の線量分布を低線量まで評価できるシステムの開発を目的としました。
【開発したシステム】
確率的影響である晩発の副作用の発生原因の調査はデータ数が多いほど精度が高まります。量研におけるブロードビーム法9)は重粒子線治療の中で一番多く実施されており、世界最多の症例数(約9千人以上)となっています。 そこで、この症例データを対象としてシステムを開発しました。 症例データには、治療時に使用した患者CT画像データや、重粒子線ビームを患者毎の腫瘍の形状に合わせて調整した照射装置(レンジシフタやコリメータ)の設定などの情報がDICOM10)規格のデータ(以下、DICOMデータ)として記録されています。 原理的には、これらのデータを基に過去の重粒子線治療の照射体系を1つずつ手作業によりシミュレーション上で忠実に再現することができますが、この照射体系は患者毎に異なるため、膨大な数の患者データを手作業で処理することは不可能でした。
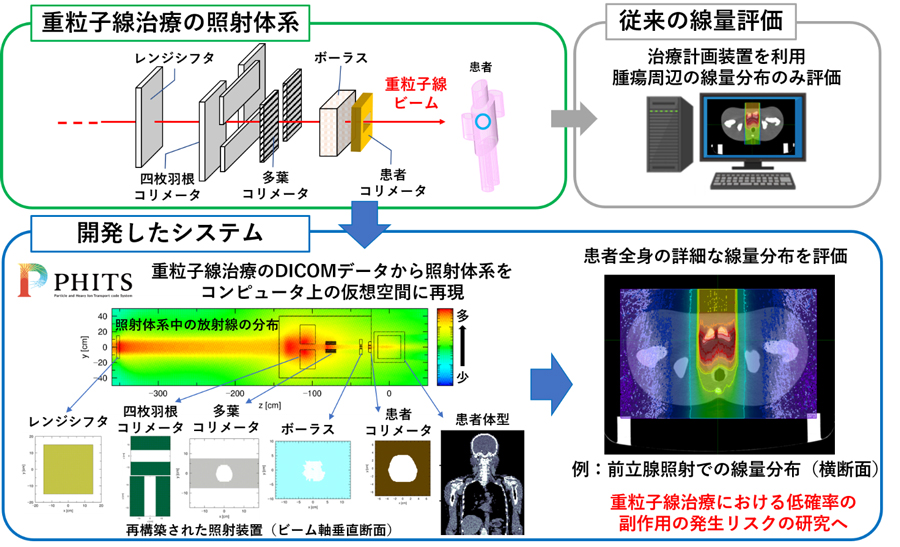
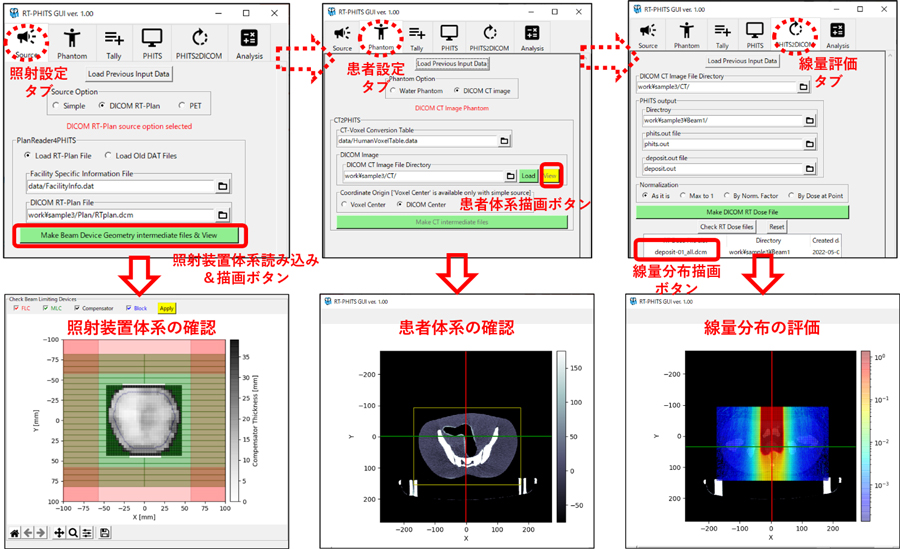
PHITSには、放射線治療のシミュレーションを支援する目的で、患者CTから画像全体の患者全身体系を構築11)し、患者体内での放射線の挙動を解析するパッケージ(RadioTherapy package based on PHITS: RT-PHITS)が用意されています。そこで、本研究ではこの機能に追加する形で、DICOMデータから照射体系の再現に必要なデータを抽出し、コンピュータ上の仮想空間に照射体系を自動的に構築する機能を開発しました。これらの機能を併せて使用することで、重粒子線治療の照射体系を構築し、過去の重粒子線治療をPHITSシミュレーションで忠実に再現することができます。この新たな機能を加えた重粒子線治療の線量評価システムをRT-PHITS for CIRT12)と呼びます。図2に開発したRT-PHITS for CIRTの概要を示します。RT-PHITS for CIRTは、PHITSの計算結果の線量分布をDICOMデータに変換する機能も有するので、一般の治療計画支援装置13)を用いて、患者CT画像に線量分布を重ねた描画や治療計画装置の線量分布との比較などの詳細解析ができます。また、RT-PHITS for CIRTでは独自のグラフィカルユーザーインターフェース(GUI)も有しており、直感的な操作による容易な設定や、視覚的な照射装置体系および患者体系の確認、そして線量分布の評価が可能です。(図3)
図2.開発した重粒子線治療時の患者全身の線量評価システム(RT-PHITS for CIRT)の概要
図3.RT-PHITS for CIRTのグラフィカルユーザーインターフェース
【人体模擬ファントムへの適用例】
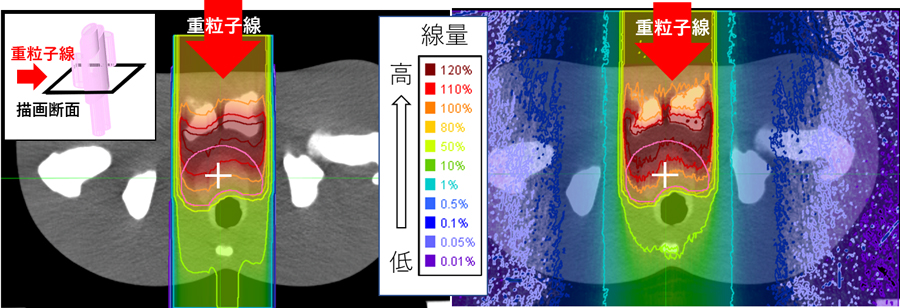
模擬的な治療計画として、重粒子線を人体模擬ファントム14)の前立腺に照射する症例を用意し、RT-PHITS for CIRTを用いて線量分布を計算しました(図4)。従来の線量計算(図4左)と本システム(図4右)の線量分布を比較した結果、アイソセンタ(照射中心)近傍では、従来の線量計算とPHITSで求めた分布は良く一致しますが、アイソセンタから離れた場所での分布では両者に違いが見られます。特にビームに垂直な方向の違いは大きく、本システムの結果ではアイソセンタから離れた領域でも低い線量値を示すのに対し、従来の線量計算ではアイソセンタから離れた場所で急激にゼロになります。この違いの要因は本システムでは従来の線量計算で無視されていた2次粒子の挙動を物理的に正しく扱い、治療部位から離れた領域に対しても正確に線量分布が計算できるためです。
図4.従来の線量計算方法(左)と本システム(右)で評価した人体模擬ファントム内の線量分布の比較例。“+”印 がアイソセンタ(100%)を示し、その周囲のピンク色で囲んだ領域が腫瘍領域となります。従来の線量計算方法では腫瘍領域周辺の分布しか評価できていないのに対し、本システムは全身の分布を評価できています。
【今後の展開】
今後は、本研究で開発したシステムを用いたシミュレーション解析による線量分布の再評価が、ブロードビーム法による治療の症例(世界最多)を対象に、量研で実施される予定です。さらに、線量評価結果を治療後の2次がん発生などの疫学データと組み合わせることで、重粒子線治療の2次がん発生率の低い理由や放射線治療における副作用の発生の仕組みの究明が可能です。これにより、治療計画時にこれまで不可能であった晩発の副作用の発生リスクの考慮が可能になり、副作用の発生リスクの小さな治療の実現につながることが期待されます。
また、本システムの改良をさらに進め、高速3次元スキャニング照射法15)による重粒子線治療(2011年より量研の前身である放射線医学総合研究所で開始)にも対応するようにシステムを拡張する予定です。なお、本研究で開発したRT-PHITS for CIRTは次期リリースのPHITS配布パッケージに内包する形で国内外への公開を予定しており、他の重粒子線治療施設での活用や新たな応用研究への発展が期待されます。
【論文情報】
雑誌名:Physics in Medicine and Biology
論文タイトル:Development of the DICOM-based Monte Carlo dose reconstruction system for a retrospective study on the secondary cancer risk in carbon ion radiotherapy
著者:T. Furuta, Y. Koba, S. Hashimoto, W. Chang, S. Yonai, S. Matsumoto, A. Ishikawa, and T. Sato
公表日:2022年7月4日
DOI:https://doi.org/10.1088/1361-6560/ac7998
【各機関の役割】
原子力機構:システム設計、システム開発、データ解析、論文執筆、統括
量研:システム設計、システム開発、データ解析
【助成金の情報】
本研究の一部は、日本学術振興会(JSPS)科学研究費補助金(21H02872)の研究助成を受けて行われました。
【用語解説】
1) 重粒子線治療
炭素イオンを光速の約70%まで加速し、患者の体外から腫瘍に向けて照射する放射線治療です。従来の放射線治療に比べて、放射線のエネルギーを腫瘍により集中させることができる特徴を持ちます。従来の放射線治療に比べて2~3倍程度がん細胞を死滅させる能力が高く、従来の放射線では効果が薄い難治がんにも有効という優れた特性を持ちます。1994年に量研の前身である放射線医学総合研究所で臨床研究が開始され、量研が世界をリードして行ってきた放射線治療です。これまでに量研では、1万人以上の患者の治療を実施してきました。
2)2次がん
最初のがんが治癒して5~10年後以降に、1次がんとは異なる種類(起源)の細胞ががんになる場合、2次がんといいます。2次がんの発生は、様々な因子が関わっており、放射線治療における正常組織の被ばくも2次がん発生の1つの要因になります。
3)重粒子線治療の2次がんの発生率は一般的な放射線治療(X線、ガンマ線)に比べて有意に低いとの報告
以下の論文で重粒子線による前立腺がんの治療結果では、一般的な放射線治療(X線、ガンマ線)に比べて2次がんの発生率が有意に低いとの報告が行われています。
Lancet Oncology, Volume 20, Issue 5, 2019, pp. 674-685.
DOI:http://dx.doi.org/10.1016/S1470-2045(18)30931-8
また、同内容は量研において2019年3月16日のプレスリリース「重粒子線治療では2次がんが増加しにくいことをあきらかに 前立腺癌を対象に他治療後の症例や同年代一般男性の罹患データと比較」で報告されています。
4) 照射体系
放射線治療で、患者の腫瘍領域に放射線を集中して照射するために設定する照射装置の配置や患者の位置などを含む3次元の体系です。重粒子線照射装置にはレンジシフタやコリメータなどの多くのパーツが配置されており、患者の腫瘍形状に適した照射が可能となっています。
5)モンテカルロ放射線挙動解析
個々の放射線の挙動を乱数により確率的に再現し、その平均的な振る舞いを推定する手法です。物質内での放射線挙動を第一原理的に再現するため、2次粒子の発生や挙動まで含めて精度の良い計算が実行できます。しかし、異なる乱数による試行を繰り返して統計的な精度を担保する必要があり、長い計算時間を必要とします。このため、通常の重粒子線治療の線量計算では使用されず、代わりに簡易的な手法による線量計算が採用されています。
6)PHITS
任意の3次元体系中の様々な放射線の挙動を最新の核データや核反応モデルを用いてシミュレーションする汎用のモンテカルロ放射線挙動解析コードです。放射線施設の設計、医学物理計算、放射線防護研究、宇宙線・地球惑星科学の放射線研究などの様々な応用研究で用いられ、工学、医学、理学の様々な分野で国内外7000名以上の研究者・技術者に利用されています。
7) 治療計画装置
照射目標である腫瘍領域に計画された線量を照射するための放射線の照射条件を決定し、治療計画を立案するソフトウェアを搭載したコンピュータです。
8)2次粒子
照射した重粒子線が物質中の原子核と衝突し、双方が複数の破砕片(フラグメント)に砕けることで生成される2次的な粒子のことです。
9)ブロードビーム法
加速器で高エネルギーに加速された直径1cm程度の細い炭素ビームを、患者の腫瘍の大きさに見合うまで拡大し、患者の腫瘍の形にコリメータで整形して照射する方法です。
10) DICOM
DICOM(Digital Imaging and COmmunications in Medicine)とは画像診断装置や医用画像を保管する装置、画像解析を行う装置間で医用画像デジタルデータを通信したり、保存したりする方法を定めた標準規格です。
11)患者CT画像から画像範囲内の患者全身体系を構築
重粒子線治療を行うための患者CT画像の情報から、患者体内の臓器・骨・筋肉などの形状・密度・組成などを推定してコンピュータ上の仮想空間に患者を再現させます。この構築の方法に関して本研究グループは以下の論文報告を行っています。
Journal of Radiation Research, 2021, pp.1-10
DOI: 10.1093/jrr/rrab028
12) CIRT
Carbon Ion RadioTherapyの省略で炭素線治療(重粒子線治療)の英語名です。
13) 治療計画支援装置
放射線治療の治療計画や線量評価を支援するため、DICOM規格のデータを基に画像の統合、輪郭描画、データ管理などを自動・半自動的に行うソフトウェアを搭載したコンピュータです。
14) 人体模擬ファントム
人体組織等価物質で構成した人体型の模型で、放射線の人体影響を模擬的に見積もるために使用されます。
15) 高速3次元スキャニング照射法
従来のブロードビーム法に代わり、スキャニング電磁石で重粒子線を平面方向に掃引しながら、加速器のエネルギーを変化させることで深さ方向位置も変化させて、標的に照射する方法です。レンジシフタやコリメータなどの照射装置の一部のパーツを減らすことができるため、ブロードビーム法よりも2次粒子の発生を少なくできると期待されています。