2022-12-08 筑波大学,東邦大学,日本医療研究開発機構
睡眠は誰にでも必要ですが、なぜ眠らなければならないのかは現在でも謎です。本研究チームは、この謎を解く鍵となる酵素(SIK3)に注目していました。この酵素は睡眠に関わる脳内の反応の連鎖を調節し、睡眠の質と量を調整する分子のシグナルを形成します。しかし、SIK3がどのような分子と連鎖を作ることで睡眠を制御しているのか、どの細胞を介して睡眠の量や質を決めているのかは分かっていませんでした。本研究では、その連鎖(分子シグナル)の詳細と、この分子シグナルが調節する遺伝子群を、世界で初めて明らかにしました。
また、睡眠の質は大脳皮質の興奮性ニューロン注1)が制御し、量は視床下部の興奮性ニューロンが制御することを見いだしました。ウイルスベクターを用いて、後天的に睡眠の量と質を変化させることで、この分子シグナルをさらに検証することにも成功しています。
睡眠は、心身の健康に不可欠であり、睡眠障害は精神疾患や糖尿病、心疾患、アルツハイマー病などの認知症のリスクを高め、日中の脳のパフォーマンスを低下させます。我が国では多くの国民が睡眠負債(睡眠不足に伴う心身の不調)を抱えていると言われており、睡眠の量と質を制御する仕組みの理解を通じて、新しい睡眠制御方法や睡眠障害治療法の開発に貢献することが期待されます。
研究代表者
筑波大学国際統合睡眠医科学研究機構(WPI-IIIS)
柳沢 正史 教授・機構長
東邦大学大学院医学研究科/筑波大学国際統合睡眠医科学研究機構
船戸 弘正 教授/客員教授
研究の背景
睡眠は健康に必須の要素であり、睡眠の不足は日中の脳のパフォーマンスを低下させ、気分障害、メタボリック症候群、認知症などのリスクを高めます。また、どの動物も眠ることから、睡眠が個体の生存に必要であることが分かっています。また、睡眠は時間だけではなく質も重要であり、浅い眠りでは起床後に熟眠感が得られず、日中の眠気を生じてミスや事故のリスクを高めます。しかし、睡眠の必要性や、睡眠の量と質を制御する仕組みは明らかではありません。本研究チームは、2016年にランダム点変異マウス注2)の睡眠スクリーニングに基づき、タンパク質リン酸化酵素注3)SIK3が、脳の睡眠を要求する度合い(睡眠圧)に関わる重要な分子であることを見いだしました。その後の研究から、SIK3はニューロンで働いて睡眠を制御することも示されていました。そこで、今回、順遺伝学注4)に加えてさまざまな手法を組み合わせて、SIK3がどのような分子カスケード注5)を形成して睡眠を制御しているのか(論文Aおよび論文B)、さらにどのニューロン集団によって睡眠の量と質が制御されるかを検討しました(論文A)。
研究内容と成果
本研究チームは、ランダム点突然変異マウスの脳波に基づく睡眠スクリーニングにより、通常よりも睡眠時間の長いマウス家系Sleepy2を樹立しました。このSleepy2変異家系ではヒストン脱アセチル化酵素注6)HDAC4遺伝子の変異があり、その発現が低下することが明らかになりました。HDAC4と相同性注7)の高いHDAC5の発現が低下したマウスも睡眠の増加を示しました。SIK3によってリン酸化されるHDAC4のセリン残基(S245)をアラニンに置換したところ、睡眠が大きく減少しました。このことから、SIK3はHDAC4をリン酸化することで睡眠を増大することが分かります。SIK3によりリン酸化を受けたHDAC4は細胞質にとどまるため、核内で遺伝子制御に関わるHDAC4が減少すると考えられます。実際に、マウスが眠る期間である明け方や、断眠後に核内のHDAC4が減少することから、SIK3はHDAC4の核移行を抑制し、睡眠が促進されることが示されました。さらに線虫においても、SIK3とHDAC4が睡眠を制御していることが示され、この分子シグナルが幅広い動物種で睡眠を制御していることが分かりました。
SIK3のリン酸化酵素活性はLKB1という別のタンパク質リン酸化酵素によって制御されるため、LKB1が減少する、もしくはSIK3キナーゼ領域にあるスレオニン残基(T221)をアラニン置換してLKB1によるリン酸化を受けないようにすると、SIK3のリン酸化酵素活性は低下します。実際に、ニューロン内のLKB1発現を低下させたマウスや、SIK3のT221をアラニンに置換したマウスは睡眠が減少しました。このことは、LKB1がSIK3の上流で睡眠制御に関与していることを示します。全体としてはLKB1-SIK3-HDAC4およびHDAC5が睡眠制御の分子シグナル伝達経路として機能していることが示されました。
それではこの分子シグナルはどの細胞で働いているのでしょうか。先行研究において、ニューロンにおけるSleepy(Slp)変異型SIK3発現によって睡眠の量と質が増大することが明らかになっています。しかし、脳は大脳、視床下部、脳幹などの部位によって、さまざまなタイプのニューロンから構成されているため、より具体的な部位やニューロンタイプを特定する必要があります。ニューロンは、神経伝達物質に基づいて分類されることが多く、代表的なものに、グルタミン酸を神経伝達物質とする興奮性ニューロンやGABAを神経伝達物質とする抑制性ニューロンがあります。DNA組み換え酵素であるCreを特定のニューロンタイプのみで発現する多数のマウス系統と交配させて睡眠を検討したところ、大脳皮質等の興奮性ニューロンでSlp変異型SIK3が発現すると、睡眠の質や深さの指標であるノンレム睡眠中の脳波の徐波成分注8)が増大しますが、睡眠量は変わらないことが明らかになりました。一方、視床下部でSlp変異型SIK3を発現させると、睡眠量は増加したものの、ノンレム睡眠中の脳波の徐波成分は変化しませんでした。Slp変異型SIK3は核内のHDAC4を減少させますが、興奮性ニューロンにおけるHDAC4を減少させると睡眠が増加しました。逆に、興奮性ニューロンでSIK3を減少させると、睡眠が質、量ともに減少します。以上の結果から、睡眠の質は大脳皮質の興奮性ニューロンが制御し、量は視床下部の興奮性ニューロンが制御することが示されました(参考図)。
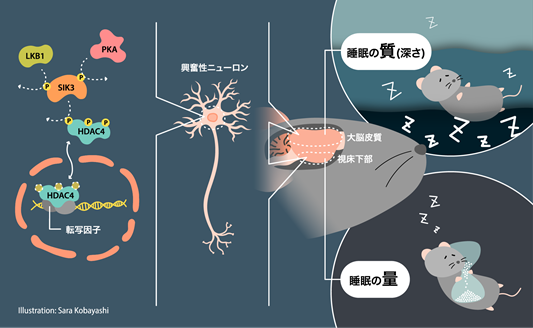
(参考図)睡眠の量と質を制御する分子シグナル興奮性ニューロン内におけるLKB1-SIK3-HDAC4の分子シグナル伝達経路(左)が、大脳皮質において睡眠の質を調節し、視床下部を介して睡眠の量を調整する(右)。
大脳皮質の興奮性ニューロンにおいて睡眠の質の調整に関与している遺伝子を同定するために、断眠後の野生型マウスの大脳皮質と、アデノ随伴ウイルスによってSlp変異型SIK3を発現させた大脳皮質を用いて、1細胞RNAシーケンシング注9)を行ったところ、断眠とSlp変異型SIK3発現に共通した変化として、興奮性ニューロンでのシナプス機能に関する遺伝子群の変化が認められました。このことは、SIK3シグナルによる興奮性ニューロンのシナプスレベルの変化が、睡眠の質の制御の背景にあることを示唆します。2018年に異なるアプローチで眠気の分子実体として同定したリン酸化タンパク質にも多くのシナプス関連分子が含まれていました。
また、アデノ随伴ウイルスやゲノム編集技術を用いて成体マウスのLKB1、SIK3、HDAC4/5を操作することで、睡眠の質や量を制御できることも分かりました。
今後の展開
本研究チームは、睡眠の必要性や恒常性に関する分子機構の全容を解明することを目指しており、睡眠の質と量を制御する仕組みや、このSIK3シグナルがどのようにニューロンレベルの性質を変化させ、睡眠覚醒状態の切り替えや維持を担うニューロンを介して、睡眠を制御しているのかを明らかにするべく、さらに研究を進めています。未解明な点が多い概日リズム注10)と睡眠との関係も今後の重要な課題です。SIK3シグナルは睡眠や覚醒を促す新規医薬の標的となるだけではなく、睡眠の質や量を人為的に変化させるためのハブとなる可能性があります。睡眠を操作できるようになることは、ヒトのパフォーマンスを高めるとともに、気分障害や認知症等の疾患の新しい治療介入法の開発につながります。
用語解説
- 注1) 興奮性ニューロン
- グルタミン酸を神経伝達物質とするニューロン。スパイン(興奮性ニューロンの樹状突起上に存在する突起様構造物)にあるグルタミン酸受容体を介して、スパインに接続するニューロンの働きを促進する。
- 注2) ランダム点変異マウス
- 薬剤の投与ことにより遺伝子に変異を持つマウス。どの遺伝子にどのような変異を持つかはランダムであり、マウスごとに異なる。
- 注3) リン酸化酵素
- アデノシン三リン酸(ATP)からリン酸基を基質となる分子に転移する酵素。キナーゼともいう。SIK3は蛋白質を基質とするプロテインキナーゼの一つである。
- 注4) 順遺伝学
- 個体ごとに評価可能な特徴に基づいて、その特徴をもたらしている遺伝子変異を同定する研究戦略のこと。本研究の場合は、睡眠が多いという特徴をもたらす遺伝子変異を探った。
- 注5) 分子カスケード
- 細胞内で生じたイベントが次のイベントを引き起こすような反応の連鎖を、分子カスケードやカスケードと呼ぶ。リン酸化酵素は基質をリン酸化することで、基質の性質を変え、この基質が次のイベントを起こす形でカスケードとなっている。
- 注6) ヒストン脱アセチル化酵素
- ヒストン(染色体を構成するタンパク質)の脱アセチル化を担う酵素。しかし、HDAC4やHDAC5は脱アセチル化活性が低いため、ヒストン修飾よりも転写因子等との結合を介して転写調節を実行する。
- 注7) 相同性
- この場合はHDAC4とHDAC5の遺伝子配列の似ている度合いを意味する。一般に、遺伝子の相同性が高いほど、機能的にも似た役割を果たすことが多い。
- 注8) 徐波成分
- 脳波はさまざまな波長の波に分解することができるが、比較的長い波長成分を徐波成分という。断眠後の睡眠や深い睡眠では徐波成分が増えることから睡眠の質や必要度の指標と考えられている。
- 注9) 1細胞RNAシーケンシング
- 1つ1つの細胞レベルで転写産物(RNA)を解析する手法。脳細胞タイプごとに転写産物の傾向を調べるなど、従来の手法では得られなかった情報を得ることができる。
- 注10) 概日リズム
- 睡眠覚醒など24時間周期で繰り返される生理現象のことであり、内在的に稼働する体内時計の制御を受けている。
研究資金
論文A
AMEDムーンショット型研究開発事業*、世界トップレベル研究拠点プログラム(WPI)、JSPS科研費、JST戦略的創造研究推進事業(CREST)、他の研究プロジェクトの一環として実施されました。
論文B
世界トップレベル研究拠点プログラム(WPI)、JSPS科研費、他の研究プロジェクトの一環として実施されました。
*AMEDムーンショット型研究開発事業は、我が国発の破壊的イノベーションを創出し、より大胆な発想に基づく挑戦的な研究開発を推進する国の大型プロジェクトです。AMEDはムーンショット目標7である、2040年までに、主要な疾患を予防・克服し100歳まで健康不安なく人生を楽しむためのサステイナブルな医療・介護システムの実現にむけ、研究開発を推進しています。このAMED事業において、柳沢教授は「睡眠と冬眠:2つの「眠り」の解明と操作が拓く新世代医療の展開」のプロジェクトマネージャーを務めています。
掲載論文
論文A
題名
- Kinase signalling in excitatory neurons regulates sleep quantity and depth.
(興奮性ニューロンにおけるキナーゼシグナルが睡眠の量と質を制御する) - 著者名
- Staci J. Kim, Noriko Hotta-Hirashima, Fuyuki Asano, Tomohiro Kitazono, Kanako Iwasaki, Shinya Nakata, Haruna Komiya, Nodoka Asama, Taeko Matsuoka, Tomoyuki Fujiyama, Aya Ikkyu, Miyo Kakizaki, Satomi Kanno, Jinhwan Choi, Deependra Kumar, Takumi Tsukamoto, Asmaa Elhosainy Mohamed Mahmoud, Seiya Mizuno, Shinichi Miyazaki, Yousuke Tsuneoka, Fumihiro Sugiyama, Satoru Takahashi, Yu Hayashi, Masafumi Muratani, Qinghua Liu, Chika Miyoshi, Masashi Yanagisawa, Hiromasa Funato
- 掲載誌
- Nature
- 掲載日
- 2022年12月7日
- DOI
- 10.1038/s41586-022-05450-1
論文B
題名
- A signaling pathway for transcriptional regulation of sleep amount in mice.
(マウスの睡眠量を調整するシグナルパスウェイと転写制御) - 著者名
- Rui Zhou, Guodong Wang, Qi Li, Fanxi Meng, Can Liu, Rui Gan, Dapeng Ju, Meimei Liao, Junjie Xu, Di Sang, Xue Gao, Shuang Zhou, Kejia Wu, Quanzhi Sun, Ying Guo, Chongyang Wu, Zhiyu Chen, Lin Chen, Bihan Shi, Haiyan Wang, Xia Wang, Huaiye Li, Tao Cai, Bin Li, Fengchao Wang, Hiromasa Funato, Masashi Yanagisawa, Eric Erquan Zhang, Qinghua Liu
- 掲載誌
- Nature
- 掲載日
- 2022年12月7日
- DOI
- 10.1038/s41586-022-05510-6
お問合わせ先
研究に関すること
柳沢 正史(やなぎさわ まさし)
筑波大学国際統合睡眠医科学研究機構(WPI-IIIS) 機構長・教授
船戸 弘正(ふなと ひろまさ)
東邦大学大学院医学研究科 教授
筑波大学国際統合睡眠医科学研究機構(WPI-IIIS) 客員教授
取材・報道に関すること
筑波大学国際統合睡眠医科学研究機構(WPI-IIIS)
東邦大学 法人本部経営企画部
AMED事業に関すること
日本医療研究開発機構(AMED)
研究開発統括推進室 基金事業課(ムーンショット事務局)

