2023-04-17 オークリッジ国立研究所(ORNL)
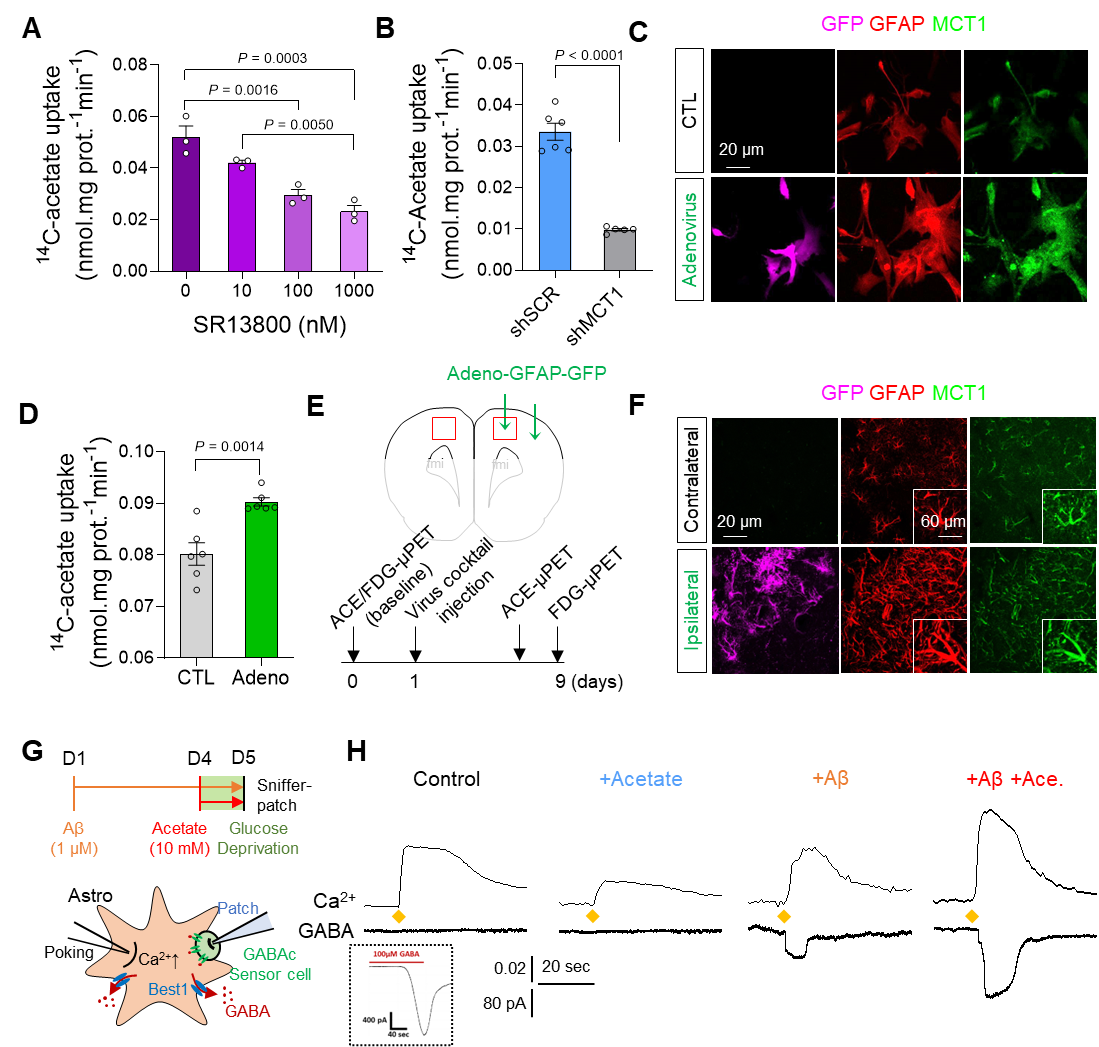
研究者たちは、PANと呼ばれるタンパク質ドメインが、植物だけでなく人間のNRP1受容体タンパク質にも存在することを発見した。NRP1はACE-2受容体よりも研究が少ないが、この研究は将来の治療対象としての可能性を示している。
研究者たちは、NRP1のPANドメインに含まれるシステイン残基と呼ばれるアミノ酸を変異させることで、SARS-CoV-2ウイルスが細胞に侵入するのを防いだという。また、PANとがん腫瘍の成長の関係性も示された。
<関連情報>
- https://www.ornl.gov/news/protein-domain-common-plants-and-animals-plays-role-covid-19-infection
- https://www.sciencedirect.com/science/article/pii/S2589004223003516?via%3Dihub
NRP1の新規相互作用部位を変異させると、SARS-CoV-2スパイクタンパク質の内在化が低下する。 Mutating novel interaction sites in NRP1 reduces SARS-CoV-2 spike protein internalization
Debjani Pal, Kuntal De, Timothy B. Yates, Jaydeep Kolape, Wellington Muchero
iScience Published: February 25, 2023
DOI:https://doi.org/10.1016/j.isci.2023.106274

Highlights
•Vestigial PAN domain of NRP1 is essential for its function and stability
•Two novel cysteines identified in NRP1 directly impact SARS-CoV-2 binding
•Mutated PAN domain reduces spike protein abundance in cells for viral variants
•Mutations in PAN domain modulate pERK signaling and signature gene expression
Summary
The global pandemic of coronavirus disease 2019 caused by severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) virus has become a severe global health problem because of its rapid spread. Both Ace2 and NRP1 provide initial viral binding sites for SARS-CoV-2. Here, we show that cysteine residues located in the vestigial plasminogen-apple-nematode (PAN) domain of NRP1 are necessary for SARS-CoV-2 spike protein internalization. Mutating novel cysteine residues in the PAN altered NRP1 stability and downstream activation of extracellular signal-regulated kinase (ERK) signaling pathway and impaired its interaction with the spike protein. This resulted in a significant reduction in spike protein abundance in Vero-E6 cells for the original, alpha, and delta SARS-CoV-2 variants even in the presence of the Ace2. Moreover, mutating these cysteine residues in NRP1 significantly lowered its association with Plexin-A1. As the spike protein is a critical component for targeted therapy, our biochemical study may represent a distinct mechanism to develop a path for future therapeutic discovery.