2023-05-24 帝京大学,国立がん研究センター,科学技術振興機構
発表のポイント
- 大腸がん組織の中では抗がん剤感受性を示す細胞と抵抗性を示す細胞が混在していますが、オートファジーの活性化が増殖の遅い抗がん剤抵抗性細胞の生成に繋がることを発見しました。
- 大腸がんのオートファジー活性化には転写因子PROX1の誘導が関与しますが、PROX1は細胞の増殖を促進するmTORC1キナーゼの働きを抑えます。一方、mTORC1の抑制はPROX1活性の上昇をもたらします。このように抗がん剤抵抗性細胞はPROX1、mTORC1を介したフィードバック制御により維持されることを明らかにしました。
- 既存の抗がん剤とオートファジー阻害剤の併用により、大腸がん細胞の増殖を相乗的に阻害することを見出しました。
- 今後、この研究成果に基づき、オートファジー経路の阻害による新しい大腸がん治療法の開発が期待されます。
概要
帝京大学先端総合研究機構の岡本康司教授らは、国立がん研究センター研究所の浜本隆二分野長・金子修三ユニット長らとの共同研究で、大腸がんの抗がん剤抵抗性注1)の維持に働く新しい分子メカニズムを発見しました。
がん治療において、抗がん剤治療後も生き残る抵抗性細胞はがんの再発を引き起こすため、その分子メカニズムを解明し、抵抗性細胞に対する治療法を発見することが強く望まれていました。
本研究グループは、大腸がん患者由来オルガノイド注2)やマウス移植腫瘍を用いて、オートファジー注3)の活性化がPROX1注4)陽性の抗がん剤抵抗性細胞を誘導することを発見しました。また、PROX1はmTORC1注5)を介したフィードバック制御により、抗がん剤抵抗性細胞の特性維持に働くという新しい分子機構を明らかにしました。さらに、既存の抗がん剤とオートファジー阻害剤を併用することにより、大腸がんを相乗的に阻害することを見出しました。
本研究成果により、今後はオートファジー経路を標的とした新規阻害剤の開発、および大腸がんに対する新しい治療法の発展が期待されます。
本研究成果は、2023年5月23日(米国東部時間)に米国科学誌「Cell Reports」のオンライン版に掲載されました。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
研究領域:「多細胞間での時空間的相互作用の理解を目指した定量的解析基盤の創出」
(研究総括:松田道行)
研究課題:「マルチオミクス1細胞解析による難治がん組織空間の数理的再構成」
(グラント番号JPMJCR2122)
研究代表者:帝京大学先端総合研究機構教授 岡本康司
研究期間:2021(令和3)年10月~2027(令和9)年3月
背景
国民の二人に一人が「がん」に罹患する現代において、がんを根治する革新的な治療法の開発が待ち望まれています。がんの内科的治療において、抗がん剤等に対する耐性の獲得は、がんの再発や転移に繋がるため、がん患者の予後と深く関連しています。そのため、抗がん剤抵抗性が生じる分子メカニズムの解明および有効な治療標的の発見が強く望まれていました。
これまでに岡本教授らの研究グループでは、大腸がん手術検体よりオルガノイド形成等による がん三次元培養細胞系を樹立し、その中に存在する大腸がん幹細胞注6)を対象とした研究を行ってきました。その結果、NOX1オキシダーゼによる活性酸素種の生産に起因するmTORC1キナーゼの活性化が大腸がん幹細胞の増殖に重要であることを報告しました注7)。また、オルガノイドやマウス移植腫瘍を用いた解析により、大腸がん組織には増殖型のがん幹細胞と休止型(増殖の極めて遅い状態)のがん幹細胞が混在することがわかりました(図1)。さらに、休止型がん幹細胞が抗がん剤に強い抵抗性を示すこと、転写因子であるPROX1が休止型がん幹細胞の抗がん剤抵抗性に重要であることを報告しました注8)。
そこで本研究では、PROX1陽性休止型がん幹細胞がどのように抗がん剤抵抗性を獲得・維持するのか、その分子メカニズムを解明することを目的としました。
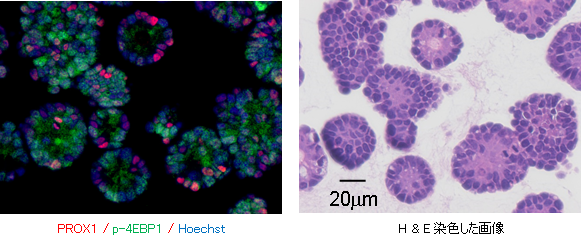
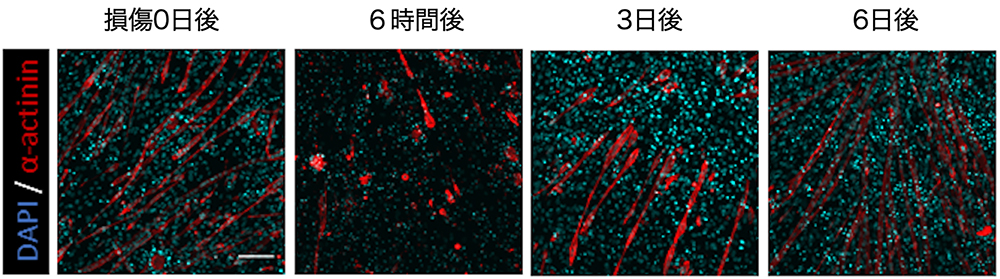
図1 大腸がんオルガノイドの免疫染色画像
休止型がん幹細胞(PROX1陽性)と増殖型細胞(p-4EBP1陽性)が混在する。
研究の内容
本グループでは、大腸がん患者由来オルガノイドやマウス移植腫瘍を用いて、抗がん剤抵抗性を誘導する分子機構を解析しました。一般的に細胞中でmTORC1を阻害するとオートファジーが活性化されることが知られていますが、mTORC1阻害剤(Torin1、Everolimus等)により抗がん剤抵抗性細胞のマーカーであるPROX1の発現が誘導されることを確認しました。一方、ChIP-seq解析注9)等の研究手法を用いた結果、誘導されたPROX1はNOX1-mTORC1経路を抑制することにより、PROX1高発現を維持し抗がん剤抵抗性に寄与することが明らかになりました(図2)。さらに、既存の抗がん剤とオートファジー阻害剤の併用により、大腸がん細胞の増殖を相乗的に阻害することを見出しました(図3)。
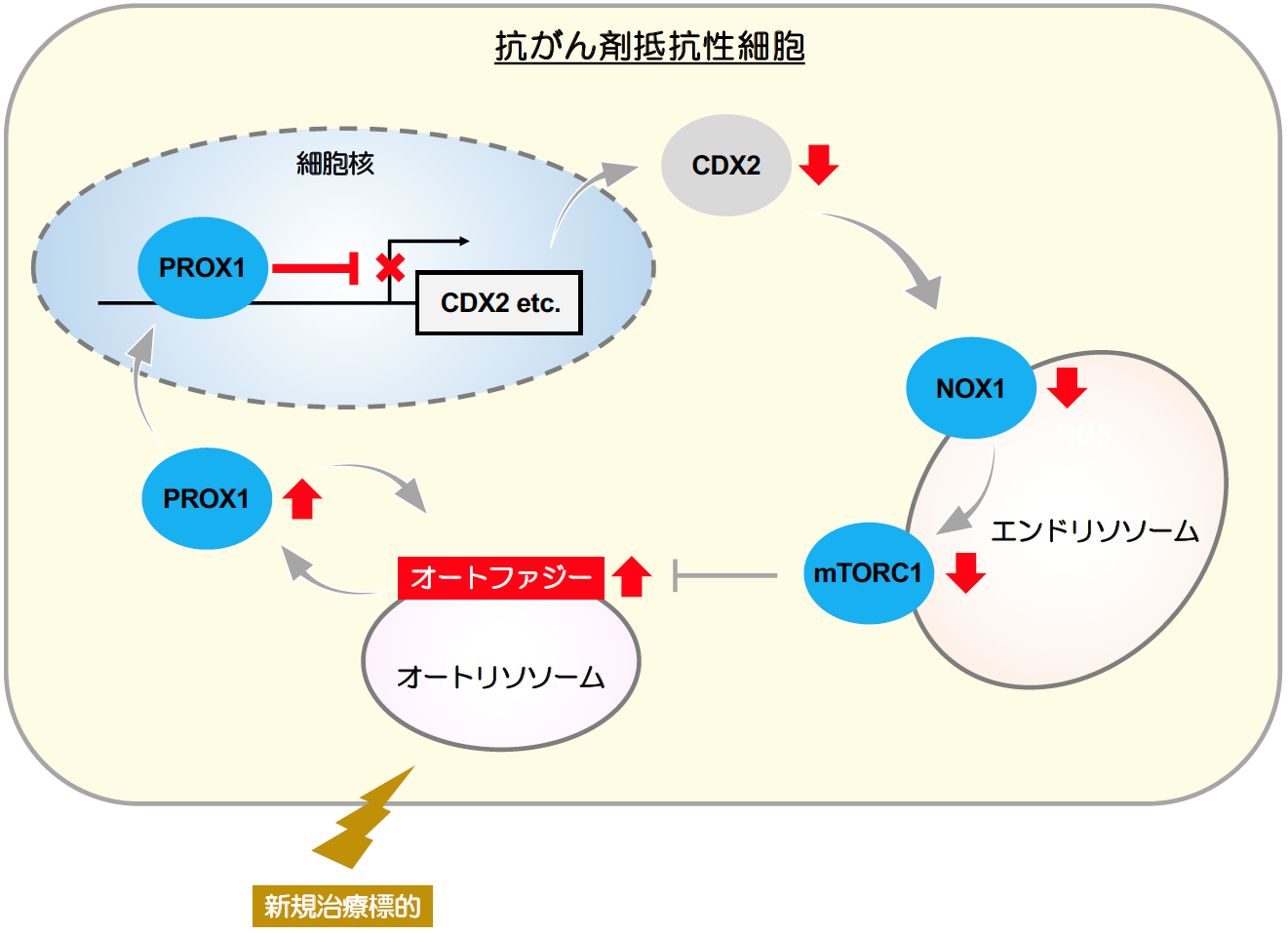
図2 抗がん剤抵抗性獲得の分子メカニズム
様々な刺激によるオートファジー活性化により、PROX1発現が誘導される。
誘導されたPROX1は転写制御因子CDX2を介してNOX1-mTORC1経路を抑制する。
mTORC1の抑制はPROX1高発現を促し、抵抗性維持のフィードバック制御回路が形成される。
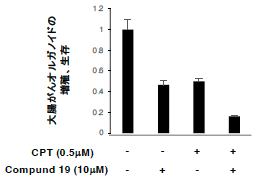
図3 抗がん剤とオートファジー阻害剤の併用による大腸がん細胞の相乗抑制効果
オートファジー阻害剤(Compound 19)と標準抗がん剤であるCamptothecin(CPT)を同時に投与したところ、
大腸がんオルガノイド細胞の増殖、生存が相乗的に抑制された。
オートファジー阻害剤と標準抗がん剤の併用により、がん細胞の増殖を相乗的に阻害できる。
今後の展開
本研究成果により、抗がん剤抵抗性に関与するオートファジー制御分子の同定やオートファジー経路を標的とした新しい種類の抗がん剤の開発、大腸がんに対する新しい治療法への展開が期待されます。
用語解説
注1)抗がん剤抵抗性
がん細胞が抗がん剤に抵抗性を示すこと。治療の初めから効かない場合と治療を続けるうちに 効かなくなる場合があるが、がんの根治を阻む主要な原因と考えられる。
注2)オルガノイド
細胞外マトリクス等の生体間質組織の存在下で形成される細胞構造体。幹細胞や前駆細胞、分化細胞等からなる元の臓器の細胞組成を反映すると考えられる。生体組織の高次構造や細胞間相互作用の研究等に利用される。
注3)オートファジー
細胞内のタンパク質をリソソームで分解するための仕組みの一つ。細胞内での異常タンパクの蓄積の抑制や、低栄養環境におけるタンパク質のリサイクル等を行うことで生体の恒常性維持に関与する。
注4)PROX1
発生過程で重要な役割を果たすと考えられる転写制御因子。発生以外に癌化への関連も報告されている。
注5)mTORC1
主要な増殖制御因子として働くことが知られているキナーゼ複合体。細胞内の栄養素、エネルギー、酸化還元状態のセンサーとして働き、タンパク質合成、細胞の成長を促進する一方、オートファジーを抑制することが知られている。
注6)がん幹細胞
腫瘍組織内に存在し、正常組織における幹細胞と同様に自己複製能や分化能等の幹細胞性を有する細胞群。がんの発生や抗がん剤抵抗性等に深く関与すると考えられている。
注7)Ohata et al., 2019, Cell Reports, vol.28, 1282-1295
DOI: 10.1016/j.celrep.2019.06.085
注8)Shiokawa et al., 2020, Cancer Res., vol.80, 4451-4464
DOI: 10.1158/0008-5472.CAN-20-0378
注9)ChIP-seq解析
ChIP-seq(Chromatin Immunoprecipitation Sequencing)解析は、ゲノム全体でタンパク質とDNAの相互作用を研究するための実験手法の一つ。ChIP-seq解析は、主に転写因子やヒストン修飾のようなクロマチンタンパク質が結合している特定のDNA領域を同定するのに用いられる。
論文掲載
本研究成果は、米国科学誌「Cell Reports」のオンライン版に掲載されました。
タイトル
“PROX1 induction by autolysosomal activity stabilizes the persister-like state of colon cancer via feedback repression of the NOX1-mTORC1 pathway”
著者
Hirokazu Ohata*, Daisuke Shiokawa*, Hiroaki Sakai, Yusuke Kanda, Yoshie Okimoto, Syuzo Kaneko, Ryuji Hamamoto, Hitoshi Nakagama, Koji Okamoto (*共同第一著者)
DOI
10.1016/j.celrep.2023.112519
URL
https://www.sciencedirect.com/science/article/pii/S2211124723005302?via%3Dihub
掲載日
2023年5月23日(米国東部時間)
お問い合わせ先
研究に関するお問い合わせ
学校法人帝京大学
先端総合研究機構教授 岡本康司
JST事業に関するお問い合わせ
国立研究開発法人科学技術振興機構
戦略研究推進部ライフイノベーショングループ 保田睦子
報道関係からのお問い合わせ
学校法人帝京大学 本部広報課
国立研究開発法人国立がん研究センター 企画戦略局 広報企画室
国立研究開発法人科学技術振興機構 広報課