2024-03-13 理化学研究所
理化学研究所(理研)環境資源科学研究センター 天然物生合成研究ユニットの高橋 俊二 ユニットリーダー、坂井 克行 特別研究員、化合物リソース開発研究ユニットの二村 友史 上級研究員、長田 裕之 ユニットリーダー、分子構造解析ユニットの野川 俊彦 技師、越野 広雪 ユニットリーダーの研究グループは、kinanthraquinone(KQ)[1]生合成遺伝子クラスターを異種発現[2]させた放線菌[3]Streptomyces lividans TK23を用いて抗マラリア活性を有する新規化合物kinanthraquinone D(KQD)の単離および生合成経路の解明に成功しました。
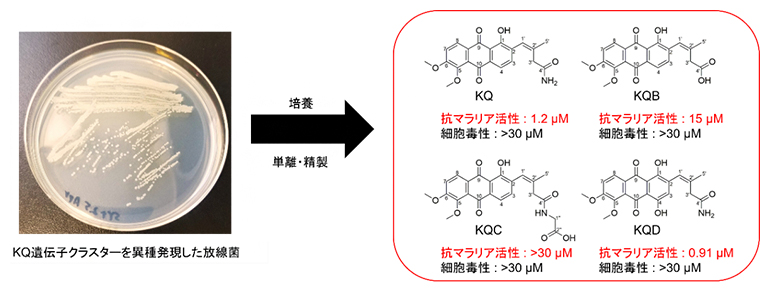
今回、研究グループは、幅広い生物活性を有するアンスラキノン化合物に着目し、KQ生合成遺伝子クラスターを異種発現させた放線菌S. lividans TK23を大量培養することによって、既知化合物であるKQ、kinathraquinone B(KQB)に加えて、二つの新規化合物であるkinanthraquinone C(KQC)とKQDの取得に成功しました。前駆体の投与実験により、KQCとKQDはそれぞれKQBとKQから、S. lividans TK23の内在性酵素により生合成されました。得られたKQ類縁体の生物活性を調べた結果、KQDはマラリア原虫の生育を阻害することが明らかになり、IC50値(50%阻害濃度)[4]は0.91マイクロモーラー(μM、1μMは100万分の1モーラー、1M=1mol/L)であることが分かりました。また、構造活性相関研究から、抗マラリア活性には、側鎖のカルボキサミド基[5]が重要であることを突き止めました。
本研究成果から、放線菌の異種発現系を用いることによって、効率的な新規天然化合物の取得や新たな抗マラリア薬の開発が期待されます。
本研究は、科学雑誌『Journal of Natural Products』オンライン版(2月27日付)に掲載されました。
新規KQ類縁体の構造と構造活性相関
背景
微生物の二次代謝産物は創薬において非常に重要な役割を果たしています。特に放線菌はさまざまな化学構造の有用化合物を生産し、人々の暮らしを豊かにしてきました。
アンスラキノン骨格を持つ化合物は、側鎖や置換基の多様性から抗菌活性、抗マラリア活性や抗がん活性など幅広い生物活性を有する重要な天然化合物です。
現在、既存の薬剤が効かない細菌やマラリアの出現が大きな社会問題となっています。そこで、私たちは放線菌Streptomyces sp. SN-593株が生産するユニークな側鎖を持つアンスラキノン化合物kinanthraquinone(KQ)に着目し、KQ生合成遺伝子クラスターを異種発現したS. lividans TK23株から、アンスラキノン骨格を持つ、新規化合物の取得を目指しました。
研究手法と成果
研究グループは、KQ生合成遺伝子クラスターを異種発現したS. lividans TK23を培養し、それが未知のアンスラキノン化合物を生産していることを、超高速液体クロマトグラフ質量分析装置(UHPLC-MS)[6]による解析で確認しました。この未知のアンスラキノン化合物を取得するために、上記放線菌を大量に培養しました。その後、酢酸エチルを用いた溶媒抽出、シリカゲルカラムクロマトグラフィー、分取高速液体クロマトグラフィー(PHPLC)[7]によりKQ類縁体を精製しました。その結果、既知化合物のKQおよびkinanthraquinone B(KQB)に加え、目的物である新規アンスラキノン化合物kinanthraquinone C(KQC)とkinanthraquinone D(KQD)を取得しました。新規化合物の化学構造は、高分解能質量分析や核磁気共鳴により得られたデータを解析することで決定しました。
新規化合物KQCおよびKQDがどのようにS. lividans TK23内で生合成されるのか明らかにするため、前駆体の投与実験を行いました。KQ生合成遺伝子クラスターを導入していないS. lividans TK23にKQを添加・培養した結果、24時間以内にKQはKQDへ変換されました。同様にKQBを添加するとKQBは24時間以内にKQCへ変換されました。この結果から、新規化合物のKQCとKQDの生合成は、KQ生合成遺伝子クラスターに由来する酵素ではなく、異種発現ホストとして活用したS. lividans TK23の内在性酵素により行われることが明らかになりました(図1)。
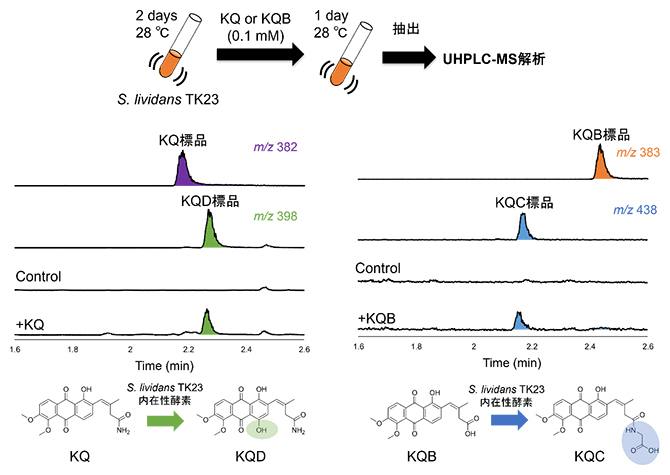
図1 前駆体投与による新規KQ類縁体への生物変換
KQ生合成遺伝子クラスターを持たないS. lividans TK23に対し、ジメチルスルホキシド(DMSO)=Control、または前駆体のKQおよびKQBを添加した後、変換産物をUHPLC-MSで解析した。KQからKQD、KQBからKQCへの変換が確認されたことから、KQCおよびKQDはS. lividans TK23の内在性酵素により生合成されることが判明した。「m/z」は質量分析の結果で、イオン化した化合物の分子量を表すときに使う。その横の数値はマスクロマトグラムが検出している質量を示している。
得られたKQ類縁体のマラリア原虫に対する生育阻害活性を調べました。KQ、KQBおよびKQDは、マラリア原虫に対してIC50値がそれぞれ1.2、15、0.91μMで生育阻害活性を示しました。また、各化合物はヒト培養細胞を使った細胞毒性試験で、細胞毒性を示しませんでした。従って、KQ類縁体は新たなマラリア薬のシード化合物になり得ることが期待されます。加えて、各類縁体の構造活性相関から、抗マラリア原虫活性にはカルボキサミド基が重要であることが分かり、将来のマラリア薬開発に応用されることが期待されます。(図2)
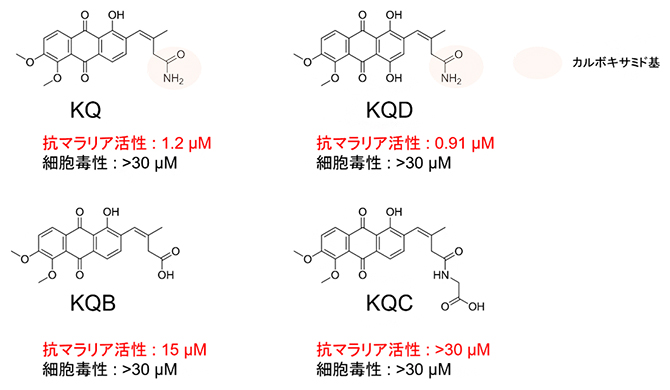
図2 KQ類縁体の構造活性相関
KQおよびKQDの抗マラリア活性がKQBおよびKQCよりも10倍以上強いことから、側鎖のカルボキサミド基が抗マラリア活性に関して非常に重要であることが分かった。いずれの化合物も細胞毒性は低い。
今後の期待
本研究では、放線菌の異種発現系を用いて、新規アンスラキノン化合物を探索し、抗マラリア活性を持つ新規化合物KQDの取得に成功しました。KQ類縁体の構造活性相関解析で、カルボキサミド基が抗マラリア活性に重要であると判明したことは、今後の薬剤開発の重要な知見の一つになります。KQ類縁体はヒト培養細胞に対する毒性が低く、マラリア薬開発に向けた良いシード化合物になると期待されます。
本研究で取得した新規化合物は、S. lividans TK23の内在性酵素により、生合成されることが明らかになりました。今後、S. lividans TK23内の変換酵素を明らかにすることで、アンスラキノン化合物の水酸化反応や、アミド化反応を酵素により行うことが可能になり、多様なアンスラキノン化合物の取得につながると期待できます。
本研究成果は、国際連合が定めた17項目の「持続可能な開発目標(SDGs)[8]」のうち、「3.すべての人に健康と福祉を」に貢献するものです。
補足説明
1.kinanthraquinone(KQ)
2019年に放線菌Streptomyces sp. SN-593から取得されたアンスラキノン化合物。
2.異種発現
ある細菌などが保有している目的遺伝子を遺伝子操作が確立した別の宿主に移し、酵素の発現により、目的の代謝産物やタンパクを生産させる方法。
3.放線菌
土壌中など自然界に広く存在するグラム陽性の真正細菌であり、複雑な構造を持つ二次代謝産物を生産する。人類は、それらの中から、医薬、農薬、動物薬などの生理活性を持つ物質を利用してきた。現在も医薬探索源として重要視されている。
4.IC50値(50%阻害濃度)
細菌や細胞などの生育を50%阻害する薬物の濃度。この値が小さいほど強い効果を持つことを示す。
5.カルボキサミド基
官能基の一種で、化学構造式は-R-C(=O)-NH2。
6.超高速液体クロマトグラフ質量分析装置(UHPLC-MS)
高速液体クロマトグラフィー(HPLC)の分離能、速度、感度が大幅に向上した解析装置。さらに、UHPLCユニットに質量分析(MS)装置が組み合わされている。UHPLCユニットでは化学的特性の違い、MSユニットでは質量の違いを基に化合物を分離できる。そのため、複雑な混合物の中から目的化合物を素早く解析することが可能。UHPLC-MSはultra-high performance liquid chromatography – mass spectrometryの略。
7.分取高速液体クロマトグラフィー(PHPLC)
化学的特性の違いを用いて、高速液体クロマトグラフィー(HPLC)により、目的の化合物を取得する方法。天然物の化合物単離の最終精製によく使用されている。PHPLCはpreparative high performance liquid chromatographyの略。
8.持続可能な開発目標(SDGs)
2015年9月の国連サミットで加盟国の全会一致で採択された「持続可能な開発のための2030アジェンダ」にて記載された、2016年から2030年までの15年間で達成する国際目標。持続可能な世界を実現するための17のゴール、169のターゲットから構成され、発展途上国のみならず、先進国自身が取り組むユニバーサル(普遍的)なものであり、日本としても積極的に取り組んでいる(外務省ホームページから一部改変して転載)。SDGsはSustainable Development Goalsの略。
研究支援
本研究は、日本学術振興会科学研究費助成事業基盤研究(A)「天然化合物の多様性拡張を志向した生合成分子基盤の解明(研究代表者:高橋俊二)」、同学術変革領域研究(A)「AIを活用した未知の二次代謝生合成酵素の機能解明と分子間相互作用の精密解析(研究代表者:高橋俊二)」による助成を受けて行われました。
原論文情報
Katsuyuki, Sakai; Yushi, Futamura; Toshihiko, Nogawa; Yuzhu, Zhao; Hiroyuki, Koshino; Hiroyuki, Osada; Shunji, Takahashi, “Production of kinanthraquinone D with anti-malarial activity by heterologous gene expression and biotransformation in Streptomyces lividans TK23”, Journal of Natural Products, 10.1021/acs.jnatprod.3c01076
発表者
理化学研究所
環境資源科学研究センター 天然物生合成研究ユニット
ユニットリーダー 高橋 俊二(タカハシ・シュンジ)
特別研究員 坂井 克行(サカイ・カツユキ)
化合物リソース開発研究ユニット
ユニットリーダー 長田 裕之(オサダ・ヒロユキ)
上級研究員 二村 友史(フタムラ・ユウシ)
分子構造解析ユニット
ユニットリーダー 越野 広雪(コシノ・ヒロユキ)
技師 野川 俊彦(ノガワ・トシヒコ)
報道担当
理化学研究所 広報室 報道担当