2024-03-29 ライス大学
<関連情報>
- https://news.rice.edu/news/2024/rice-study-identifies-protein-responsible-gas-vesicle-clustering-bacteria
- https://www.nature.com/articles/s41564-024-01648-3
細菌におけるガス小胞クラスター形成を制御するGvpUの相転移 Phase transition of GvpU regulates gas vesicle clustering in bacteria
Zongru Li,Qionghua Shen,Emery T. Usher,Andrew P. Anderson,Manuel Iburg,Richard Lin,Brandon Zimmer,Matthew D. Meyer,Alex S. Holehouse,Lingchong You,Ashutosh Chilkoti,Yifan Dai & George J. Lu
Nature Microbiology Published:29 March 2024
DOI:https://doi.org/10.1038/s41564-024-01648-3
Abstract
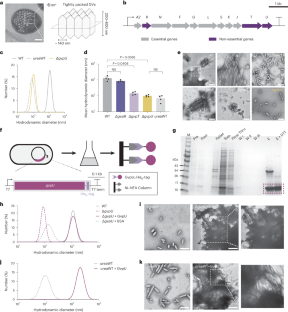
Gas vesicles (GVs) are microbial protein organelles that support cellular buoyancy. GV engineering has multiple applications, including reporter gene imaging, acoustic control and payload delivery. GVs often cluster into a honeycomb pattern to minimize occupancy of the cytosol. The underlying molecular mechanism and the influence on cellular physiology remain unknown. Using genetic, biochemical and imaging approaches, here we identify GvpU from Priestia megaterium as a protein that regulates GV clustering in vitro and upon expression in Escherichia coli. GvpU binds to the C-terminal tail of the core GV shell protein and undergoes a phase transition to form clusters in subsaturated solution. These properties of GvpU tune GV clustering and directly modulate bacterial fitness. GV variants can be designed with controllable sensitivity to GvpU-mediated clustering, enabling design of genetically tunable biosensors. Our findings elucidate the molecular mechanisms and functional roles of GV clustering, enabling its programmability for biomedical applications.


