2024-08-02 東京大学,奈良先端科学技術大学院大学,理化学研究所
発表のポイント
◆陸上植物の水輸送を担う道管の機能が、タンパク質翻訳後修飾の1つであるタンパク質ユビキチン化によって制御されることを発見しました。
◆タンパク質ユビキチン化制御のターゲットの1つが、道管細胞が分化する際のマスター制御因子であるVND7であり、ユビキチン化によるVND7活性調節の可能性を示しました。
◆本研究によって、植物の水利用効率の向上や、環境調和型の効果的な穀物やバイオマスの増産に関する技術開発の促進が期待されます。
分化誘導した道管細胞
発表概要
東京大学大学院新領域創成科学研究科の大谷美沙都教授、奈良先端科学技術大学院大学先端科学技術研究科の出村拓教授、マックスプランク植物育種学研究所(ドイツ)の中神弘史グループリーダーらの研究グループは、シロイヌナズナ(注1)を材料とした研究から、タンパク質翻訳後修飾(注2)の1つであるユビキチン化(注3)が、水輸送を担う道管(注4)の機能制御の鍵を握ることを明らかにしました。本研究グループは、道管細胞が分化する過程において多くのタンパク質がユビキチン化されており、その1つが道管細胞分化のマスタースイッチである転写因子(注5)VND7であることを明らかにしました。タンパク質翻訳後修飾は、生物が外的環境に応答してタンパク質機能を調節する重要なメカニズムです。本研究成果によって、植物の水利用効率(注6)の向上や環境に調和した穀物・バイオマス増産技術の開発が進むことが期待されます。
本研究成果は米国の植物生理学会の学会誌であるPlant Cell誌オンラインサイトに8月2日付で掲載されました。
発表内容
道管の機能性は植物の水利用効率を決定し、植物の成長や発生に直接的に影響するため、穀物やバイオマス増産を目指して、道管細胞分化やその機能性制御の分子機構の解明が精力的に行われてきました。その成果の1つが、道管細胞分化を制御する転写制御ネットワークの解明です。しかしながら、この転写制御ネットワークを通して、どのように環境に合わせた道管形成が行われているのかについては不明な点が多く残されています。
本研究グループは、道管細胞分化を制御する新規因子の同定を目指して、シロイヌナズナを材料とした分子遺伝学的解析を行いました。道管細胞分化のマスター転写制御因子VND7を利用した誘導的な道管細胞分化系ラインを変異原処理(注7)し、道管細胞分化が起こらない複数のseiv変異体を得ました(図1A)。このうち4つのseiv変異体では、タンパク質ユビキチン化に関わる遺伝子にアミノ酸置換を伴う1塩基置換が起こっていること(図1B)が分かりました。これらの変異体では道管輸送能力の低下が観察され(図1C)、タンパク質ユビキチン化が道管の機能制御に重要であることが示されました。
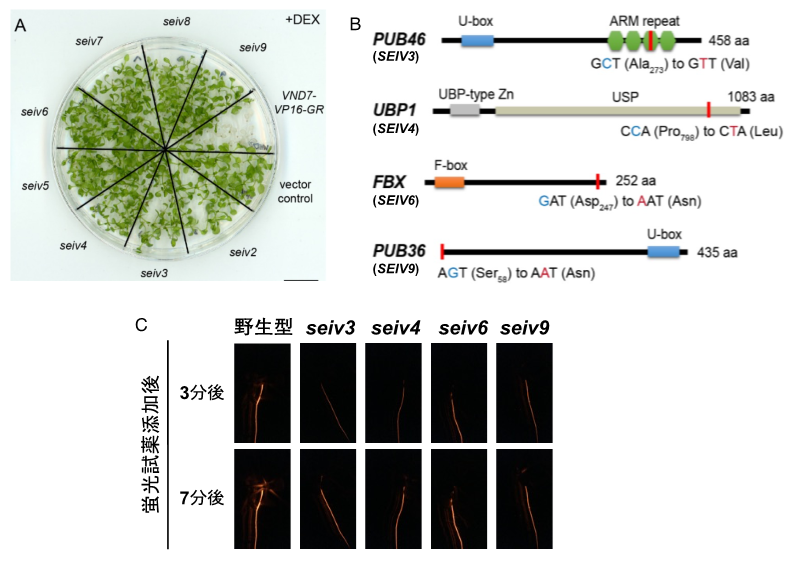
図1:新たに単離したseiv変異体の表現型と責任遺伝子
(A) 誘導的道管細胞分化系ラインVND7-VP16-GRでは、デキサメタゾン(DEX)添加処理によって道管細胞分化が誘導され、全身的に道管細胞が作られるため、白色化して枯死する。これに対してseiv変異体では、こうした道管細胞分化が抑制されておりDEX処理後も生存し続ける。
(B) 今回責任遺伝子として同定された4つのSEIV遺伝子。いずれもタンパク質ユビキチン化に関連する遺伝子内に変異が見つかった。
(C) seiv変異体の根における道管輸送能力テスト。蛍光試薬ローダミンを添加し、蛍光シグナルの変化を蛍光実体顕微鏡で観察した。seiv変異体では野生型に比べて、蛍光シグナル輸送が遅れさらにシグナル強度も低いことから、道管輸送能力が低下していることが分かる。
続いて、道管細胞分化誘導中の植物についてトランスクリプトーム解析(注8)、プロテオーム解析(注9)、ユビキトーム解析(注10)を行ったところ、タンパク質の量的変動に先立ってタンパク質ユビキチン化の状態が大きく変化していることが分かりました(図2A)。さらに転写制御を受けずユビキチン化制御を受けるタンパク質群が見つかりました(図2Bのグループ2および4)。この中には細胞壁(注11)の生合成に関わる酵素が多く含まれていたことから、タンパク質ユビキチン化は細胞壁制御を介して道管機能調節に寄与する可能性が示されました。加えて、タンパク質ユビキチン化制御はseiv変異体では大きくかく乱されていました。
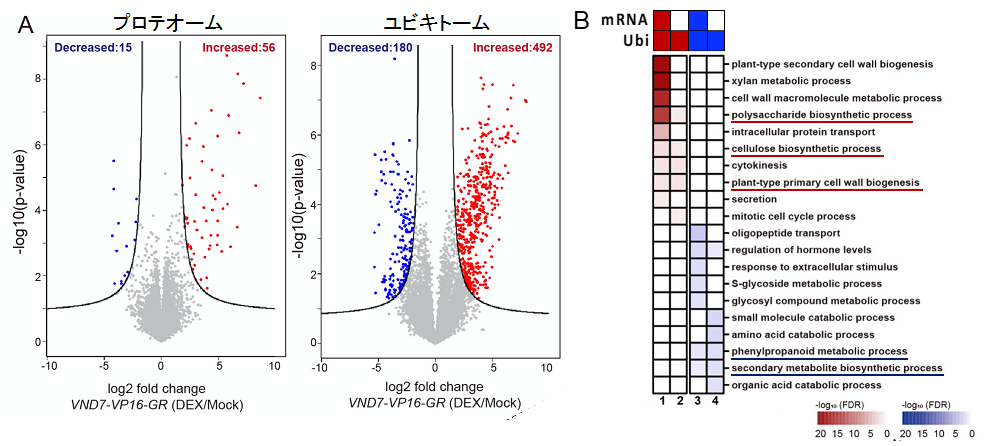
図2:道管細胞分化におけるタンパク質レベルとタンパク質ユビキチン化レベルの変化
(A) 誘導的道管細胞分化系ラインVND7-VP16-GRにおけるDEX誘導6時間後のタンパク質レベル(プロテオーム、左)およびタンパク質ユビキチン化レベル(ユビキトーム、右)の様子。対照区(Mock処理)との相対値として変化量を表した。プロテオームデータ(左)の増減数に比べて、ユビキトーム(右)の増減数が大きいことが分かる。
(B) 転写物量(mRNA量)およびタンパク質ユビキチン化レベルの変動によるユビキチン化ターゲットタンパク質のグループ分け。転写物量とは独立にユビキチン化レベルが増減するグループ2およびグループ4には、下線を引いたように多くの細胞壁生合成関連タンパク質が含まれていた。
興味深いことに、道管細胞分化マスター転写制御因子VND7自身がユビキチン化制御を受けていることを見出しました(図3A)。さらに、アミノ酸置換実験によって、道管細胞分化時にのみユビキチン化される94番目のリシンが、VND7の転写活性化活性に重要であることが分かりました(図3B)。また、seiv変異体ではこの94番目のリシンのユビキチン化制御が異常となっていたことから、seiv変異体ではVND7を十分に活性化できないために、図1Aで示すような道管細胞分化誘導阻害が起こると考えられます。
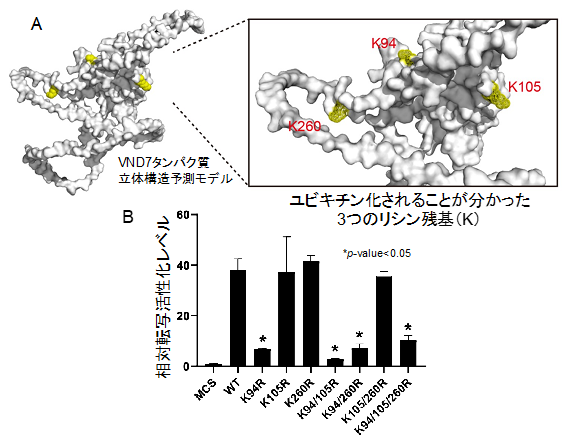
図3:道管細胞分化マスター転写制御因子VND7はユビキチン化ターゲットである
(A) AlphaFoldによるVND7タンパク質の立体構造予測モデル。VND7内に存在するリシン(K)のうち、K94、K105、およびK260がユビキチン化されることが分かった。
(B) ユビキチン化される3つのリシン残基を、1つずつ、あるいは2ないし3つ同時にアルギニンに置換したユビキチン化阻害型VND7について、転写活性化能を調べ、野生型(WT)VND7と比較したところ、K94を置換したときにのみ、大きく転写活性化活性が低下することが分かった。
本研究の成果によって、陸上植物はタンパク質ユビキチン化によって、VND7をはじめとする道管細胞の分化を制御するタンパク質の機能を積極的に調節し、環境に適した道管機能を達成しているという新しいモデルが導かれました。
<研究助成>
本研究は科研費(課題番号:JP18H05484、JP18H05489、JP20H03271、JP20H05405、JP21H05652、JP22H02649、JP23H02496、JP23K23912)、JST ERATO(課題番号:JPMJER1602)、JST ASPIRE(課題番号:JPMJAP2306)、公益財団法人旭硝子財団、公益財団法人G-7奨学財団および東京大学WINGS-PESの支援を受けて行われました。
発表者・研究者等情報
東京大学大学院新領域創成科学研究科 先端生命科学専攻
Ya Ma(ヤ マ)博士課程
大谷 美沙都 教授 兼:奈良先端科学技術大学院大学客員教授/理化学研究所客員研究員
奈良先端科学技術大学院大学先端科学技術研究科 バイオサイエンス領域
Pawittra Phookaew(パウィットラ プーカウ)博士課程
鈴木 崇臣 修士課程
佐野 亮輔 博士研究員
出村 拓 教授 兼:理化学研究所客員主管研究員
マックスプランク植物育種学研究所
Sara Christina Stolze(サラ クリスティーナ スュトルツ)シニアエンジニア
Anne Harzen(アナ ハーゼン)テクニカルスタッフ
中神 弘史 グループリーダー
論文情報
雑誌名:The Plant Cell
題 名:Active protein ubiquitination regulates xylem vessel functionality
著者名:Pawittra Phookaew#, Ya Ma#, Takaomi Suzuki, Sara Christina Stolze, Anne Harzen, Ryosuke Sano, Hirofumi Nakagami, Taku Demura, Misato Ohtani*
(#共同筆頭著者、*責任著者)
DOI:10.1093/plcell/koae221
URL:https://www.doi.org/10.1093/plcell/koae221
用語解説
(注1)シロイヌナズナ
植物分子遺伝学・分子生物学にもっともよく使われるモデル植物の1つ。植物の中でもっとも初期にゲノム情報が解読された。個体が小さい・ゲノムサイズが小さい・実験室で生育可能である・一世代あたりの時間が短いといった研究上の利点がある。
(注2)タンパク質翻訳後修飾
生合成されたタンパク質に起こる化学的修飾のこと。代表的なものとしてリン酸化、糖鎖付加、脂質付加、メチル化、アセチル化、ユビキチン化、SUMO化などが知られている。多くのタンパク質では、こうした各種翻訳後修飾を経て、その機能が調節されている。
(注3)ユビキチン化
タンパク質翻訳後修飾の一種。ユビキチンはアミノ酸 76 個からなる進化的保存性の高いポリペプチドであり、ターゲットタンパク質のリシン残基に共有結合によって付加される。選択的プロテアソーム分解目印としてのユビキチン化の例が有名だが、近年、ユビキチン化はタンパク質分解だけでなく、タンパク質輸送制御や活性制御など、多岐にわたる役割があることが明らかになっている。
(注4)道管
被子植物の木部を形成する通道組織のこと。水や栄養を土壌から吸い上げ、全身に運ぶ水輸送組織として機能する。細胞径の比較的大きい死細胞である道管細胞(管状要素ともいう)が長く連なった管状組織であり、陸上植物の水輸送細胞の中で最も進化した形だと考えられている。
(注5)転写因子
DNAに結合して転写(mRNA生合成)を制御するタンパク質のこと。転写を正に制御するものや負に制御するもの、また特定DNA認識配列に結合するものや認識配列特異性が低いものがある。
(注6)植物の水利用効率
植物が使った水の量に対してどのくらいバイオマスを生産したかを示す指標。光合成を考える場合には、光合成によるCO2吸収速度と水の蒸散速度の比として表すこともある。干ばつ、塩類化、地下水の枯渇、貯水量の不足によって世界的に水資源危機が危惧されており、いかに植物の水利用効率を上げ、できるだけ少ない水で持続的な食糧確保を可能にするかは、重要な課題である。
(注7)変異原処理
突然変異体を人為的に生み出す方法の1つ。変異原とはゲノム配列(DNA配列)に突然変異を引き起こす化学物質や放射線のことを言い、適切な条件で生物試料(今回の場合はシロイヌナズナ種子)を変異原処理することでランダムにゲノム配列に変異を挿入し、突然変異体を取得する。
(注8)トランスクリプトーム解析
細胞や組織、生体といったサンプル対象に含まれる転写物(transcript)、すなわちRNAの総体をトランスクリプトームと呼び、トランスクリプトームを網羅的に解析することをトランスクリプトーム解析という。現在もっともよく行われるのが、超並列シーケンサーを用いたRNA-seqと呼ばれる解析法であり、サンプルに含まれているRNA配列の網羅的データから遺伝子発現量を定量化する。
(注9)プロテオーム解析
細胞や組織、生体といったサンプル対象に含まれるタンパク質の総体をプロテオームと呼び、プロテオームを網羅的に解析することをプロテオーム解析という。抽出したタンパク質サンプルを断片化し得られたペプチド断片について質量分析器で解析し、得られた分子量からアミノ酸配列を同定することで、タンパク質存在量を網羅的に定量化する。
(注10)ユビキトーム解析
ユビキチン化タンパク質を網羅的に解析するプロテオーム解析の一種。ユビキチン化タンパク質をポリユビキチン鎖特異的抗体等で単離・濃縮してプロテオーム解析を行うことで、ユビキチン化されたタンパク質の定量的情報を得ることができる。
(注11)細胞壁
植物細胞の最外殻に存在するセルロース微繊維とマトリックス多糖類を主成分とする構造体のこと。細胞分裂の時に作られる一次細胞壁と、特定の細胞でのみ形成される二次細胞壁があり、道管は二次細胞壁を発達させる。細胞の形態や伸展性、また力学的・化学的強度を決定する重要な構造である。
お問い合わせ
新領域創成科学研究科 広報室