2024-01-24 理化学研究所,東北大学
理化学研究所(理研)生命機能科学研究センター 形態形成シグナル研究チームの関根 清薫 学振特別研究員RPD(研究当時、現 東北大学 大学院生命科学研究科 助教)、林 茂生 チームリーダー、フィジカルバイオロジー研究チームの多羅間 充輔 基礎科学特別研究員(研究当時)、柴田 達夫 チームリーダーらの研究チームは、生物の管状組織を支えるリング状の細胞骨格[1]が作り出される仕組みを解明しました。
本研究成果は、気管[2]や血管などの管状組織がいかに形作られるかという生物共通の謎の解明に貢献し、人工血管作製などへの医療応用が期待されます。
研究チームは、ショウジョウバエ胚[3]に直径数マイクロメートルの気管が形成される際、リング状の細胞骨格が等間隔に並ぶ蛇腹に似た細胞骨格パターンが現れることに注目しました。最先端の顕微鏡でその過程を観察したところ、細胞骨格を構成するアクチン[4]が、ナノスケールの集合体(ナノクラスター)を形成し、それらが融合することでパターンが作られることを発見しました。この過程に必要な分子を特定し、それらの性質を反映させたシミュレーションをコンピューターで行ったところ、細胞骨格パターン形成の全ての過程を再現できました。これらの発見から、管状組織を支える細胞骨格は、ナノクラスターの自発的な動きから生み出される(自己組織化[5])という結論に至りました。これは、生体内に見られるさまざまな太さの管状組織形成に柔軟に対応できるシンプルかつ優れた仕組みであると考えられます。
本研究は、科学雑誌『Nature Communications』オンライン版(1月24日付:日本時間1月24日)に掲載されました。
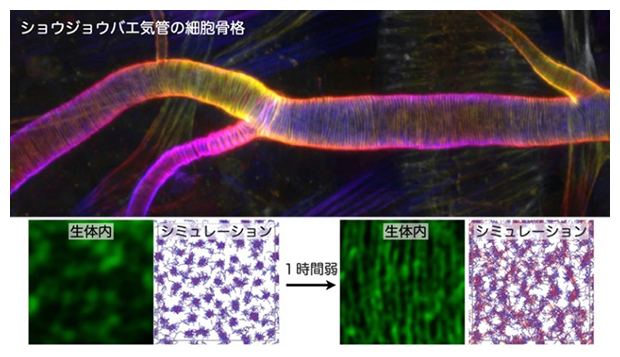
ショウジョウバエの気管の細胞骨格が形成される過程の高解像顕微鏡観察とシミュレーション
背景
近年、培養細胞から人工血管などの管状組織を試験管内で作り出し、医療に役立てる試みが活発に行われています。しかし現状では、作り出せる管状構造の径や長さには限界があり、さらに細胞を立体的に配置するための人工的な足場も必要です。そこで、生物の体内ではいかに細胞同士の関わり合いによって管状組織が自己組織的に形成されているのか、その理解が求められていました。
生物の作り出す管状組織に目を向けると、ほ乳類の血管や昆虫の気管、植物の道管などさまざまな管状組織において、細胞骨格が「周方向かつ等間隔」に並ぶ、蛇腹に似たパターンが広く見られます。例えば昆虫のショウジョウバエでは、気管が作られる際に内腔(ないくう)が膨張しますが、それと同時にこの「周方向かつ等間隔」の細胞骨格パターンが生じることが報告されています(図1)。この細胞骨格パターンは、管状組織を形成する鍵となると考えられますが、パターン形成の分子メカニズムは明らかになっていませんでした。
細胞骨格はその名の通り、細胞の骨組みとなることで、細胞の形の維持や変形を担います。細胞骨格を構成するタンパク質の一種であるアクチンは、細胞にかかる張力や圧力に応答して、その集合パターンを変化させることが知られています。管が膨張するとき、管を構成する細胞の細胞膜を周方向に強く引っ張る力がかかります。この張力をアクチンが感じ取ることができれば、周方向のパターニングが可能と考えられますが、顕微鏡の解像度の問題から、生体内でのアクチンの微細な動きを捉えることは難しく、研究が遅れていました。
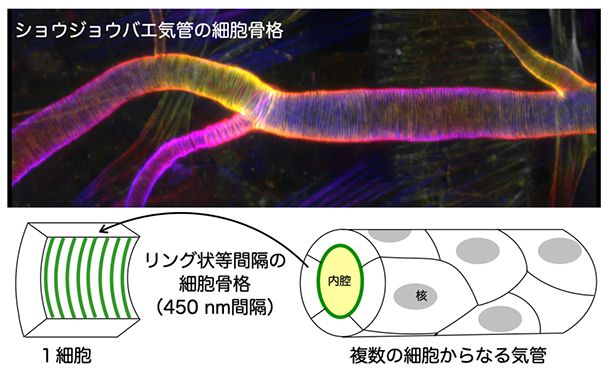
図1 気管を支える細胞骨格パターン
ショウジョウバエ胚の気管に作られる細胞骨格パターンの写真(上)と模式図(下)。それぞれの細胞で周方向に形成されたアクチン細胞骨格が管の長軸方向に等間隔でストライプ状に並び(左下図の緑線)、隣同士の細胞の骨格がつながることで内腔を囲むようなリング状になる(右下図の内腔を囲む緑線)。
研究手法と成果
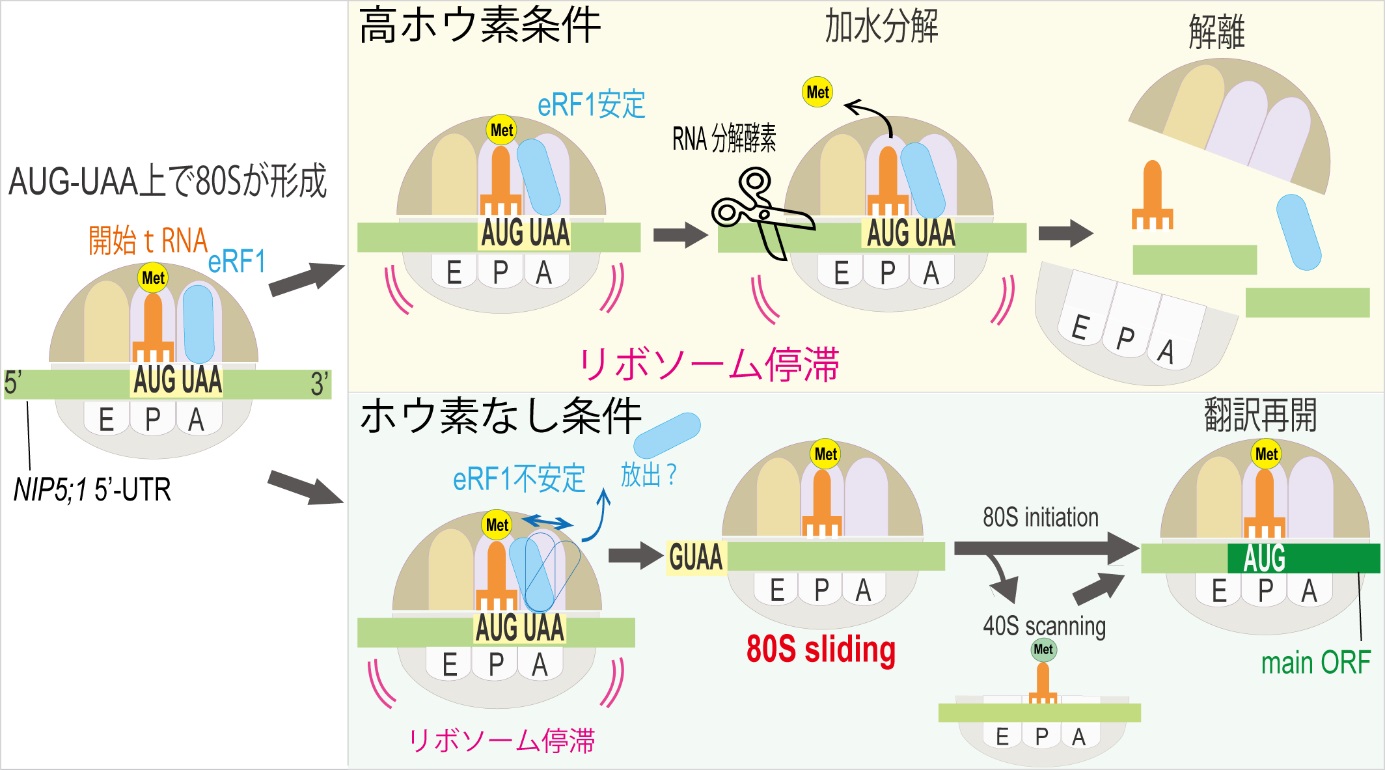
研究チームは、ショウジョウバエ胚の気管形成を最先端の顕微鏡技術を用いて高速・高解像度で連続撮影し、「周方向かつ等間隔」な細胞骨格パターンが現れる過程を詳細に観察しました。その結果、アクチンが数十~数百ナノメートル(nm、1nmは10億分の1メートル)の分子集合体(ナノクラスター)を無数に形成し、それらが周方向に融合していくことで、周方向にストライプ状に並んだ太い線状の構造が1時間弱で形成されることを発見しました(図2)。この観察から、個々のナノクラスターは細かく動きながら、管を構成する細胞の細胞膜にかかる張力に応答することで、周方向へ融合していると考えられました。
次に、ナノクラスターに含まれるアクチン以外の分子をショウジョウバエの遺伝学を利用したRNA干渉法[6]にて探索しました。その結果、①アクチン同士を架橋するクロスリンカー[7]、②アクチンを運ぶモータータンパク質[8]、そして③アクチン重合開始因子であるフォルミンタンパク質[9]、の三つが重要な構成分子であることを発見しました。特にフォルミンタンパク質はナノクラスターの周方向への融合に必須であり、管の細胞膜にかかる張力に応答する機構に関わることが示唆されました。
これら分子の性質を反映させた理論モデル(エージェント・ベース・モデル[10])を構築し、コンピューターでシミュレーションを行ったところ、アクチンとクロスリンカー(①)の相互作用でナノクラスターの形成が再現されました。さらにモータータンパク質(②)を加えるとナノクラスター同士の融合が起こりました。そして、フォルミンタンパク質(③)の働きを考慮するために、長軸方向よりも強い摩擦を、周方向のアクチンへ加えたところ、ナノクラスターが周方向へ融合することを示しました(図2)。このシミュレーションの結果から、アクチンと3種類の分子の相互作用により「周方向かつ等間隔」の細胞骨格パターンが自己組織化されることが分かりました。
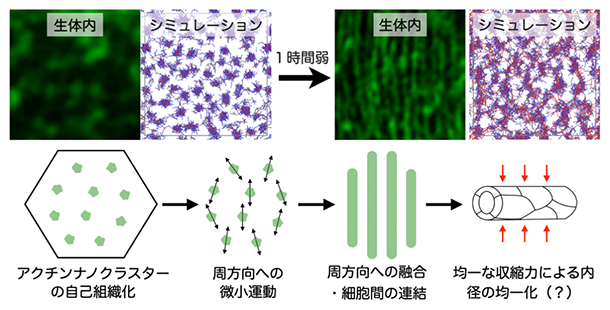
図2 アクチンナノクラスターから形成される「周方向かつ等間隔」の細胞骨格パターン
生体内(気管細胞内)のアクチン細胞骨格がナノクラスターから「周方向かつ等間隔(ストライプ状)」の細胞骨格パターンになる様子と、それを再現したシミュレーション画像。ナノクラスターの自発的な微小運動と融合により、管状組織を支える特徴的な細胞骨格が形成されると考えられる。
以上の成果により、特定の分子集合体であるナノクラスターがそれぞれ自発的に振る舞うことで、管状組織に見られる「周方向かつ等間隔」の細胞骨格パターンが生み出されることが示されました。発生の過程で管状組織が形成される際や、管状組織が成長に伴って内腔が膨張するとき、管の表面には長軸方向よりも周方向に優位な張力がかかります。その張力に個々のナノクラスターが応答して1時間弱という短時間で作り出される細胞骨格パターンが、管自身を安定化させていることが分かりました。管という3次元構造の性質をうまく利用した生物の仕組みは、生体内で多様な太さや長さの管状組織を作り出すことを可能にしているのではないかと考えられます。
今後の期待
本研究により、生物が体内で管状組織を支える仕組みの一端を明らかにしました。今後、血管など他の管構造や、心臓などより複雑な管状組織における細胞骨格のパターン形成において、ナノクラスターを基軸とした理解が進むと考えられます。これにより、生体内の管状組織の形成不全により生じる疾患の新たな治療法の開発や、人工血管など再生医療の技術発展にも大きく貢献することが期待されます。
補足説明
1.細胞骨格
細胞質内に張り巡らされたタンパク質繊維のネットワークで、細胞を内部から支える分子。さまざまなパターンのネットワークを形成することで細胞の形の維持や変形、細胞運動、細胞分裂、細胞内輸送など多くの動的なプロセスに関わっている。
2.気管
昆虫など陸上節足動物におけるガス交換の器官。体の隅々まで酸素を供給するためさまざまな太さで枝分かれした管状組織が体中に張り巡らされている。
3.ショウジョウバエ胚
遺伝学の発達した実験動物ショウジョウバエの発生の初期段階。受精卵から幼虫になるまで約1日かかり、透明で動かないため顕微鏡観察に向いている。長さ約0.5mm。
4.アクチン
重合して繊維状の構造を作るタンパク質。単量体をG-アクチン、重合体をF-アクチンと区別して呼ぶ場合がある。細胞骨格として機能するとともに、運動、収縮をつかさどる。アクチン同士が重合、または脱重合することにより、細胞の形態や運動が制御される。
5.自己組織化
秩序や構造が、構成要素の相互作用によって自発的にでき上がること。
6.RNA干渉法
2本鎖RNAによって配列特異的にRNAが分解される現象をRNA干渉と呼ぶ。この現象に基づいて、短い2本鎖RNAを細胞に導入し、任意の遺伝子の機能を阻害する実験手法をRNA干渉法(RNAi法)という。
7.クロスリンカー
タンパク質やDNA等の生体分子と結合し、架橋することで分子集合体の形成を促す分子の総称。この研究では、繊維状のアクチン同士を架橋するクロスリンカーが、ナノクラスターの形成に必要とされることが明らかとなった。
8.モータータンパク質
細胞内でアデノシン三リン酸(ATP)の分解で生じる化学エネルギーなどを用いて、力学的な仕事をするタンパク質の総称。本研究においてナノクラスターの構成分子として同定されたモータータンパク質は、非筋細胞ミオシンⅡであった。
9.フォルミンタンパク質
動物・植物を含め真核生物に広く保存された、アクチン重合促進因子として機能するタンパク質ファミリー。本研究においてナノクラスターの構成分子として同定されたフォルミンタンパク質は、DAAM(disheveled associated activator of morphogenesis)であった。
10.エージェント・ベース・モデル
システムを構成する要素の単純な動きから、複雑な挙動が生み出される現象をコンピューターで再現するモデルの一つ。
研究チーム
理化学研究所 生命機能科学研究センター
形態形成シグナル研究チーム
学振特別研究員RPD(研究当時)関根 清薫(セキネ・サヤカ)
(現 東北大学 大学院生命科学研究科 助教)
チームリーダー 林 茂生(ハヤシ・シゲオ)
テクニカルスタッフⅠ 和田 宝成(ワダ・ホウセイ)
テクニカルスタッフⅠ(研究当時)Mustafa M Sami(ムスタファ・M・サミ)
フィジカルバイオロジー研究チーム
基礎科学特別研究員(研究当時)多羅間 充輔(タラマ・ミツスケ)
(現 九州大学 理学研究院 助教)
チームリーダー 柴田 達夫(シバタ・タツオ)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、日本学術振興会(JSPS)科学研究費助成事業若手研究「細胞膜張力がアクチンのパターン制御を通して管状組織の機械的強度を調節する(研究代表者:関根清薫)」「細胞骨格と細胞の協同的パターン形成と機能発現のアクティブマター物理学(研究代表者:多羅間充輔)」「細胞の自律運動と協同的集団運動のアクティブマター物理学(研究代表者:多羅間充輔)」、同特別研究員研究奨励費「管状組織における等間隔アクチンリングによる分泌領域のパターン化機構解明(研究代表者:関根清薫)」、同基盤研究(A)「シグナルと力のゆらぎが上皮組織の可塑性を支配するしくみ(研究代表者:林茂生)」、同基盤研究(C)「アクチン微小集合体を起点とした組織スケールの均一性獲得原理の解明(研究代表者:関根清薫)」、内藤記念女性研究者研究助成金「管状組織における筋原繊維様の張力システム(研究代表者:関根清薫)」による助成を受けて行われました。
原論文情報
Sayaka Sekine, Mitsusuke Tarama, Housei Wada, Mustafa M Sami, Tatsuo Shibata, and Shigeo Hayashi, “Emergence of periodic circumferential actin cables from the anisotropic fusion of actin nanoclusters during tubulogenesis”, Nature Communications, 10.1038/s41467-023-44684-z
発表者
理化学研究所
生命機能科学研究センター 形態形成シグナル研究チーム
学振特別研究員RPD(研究当時)関根 清薫(セキネ・サヤカ)
(現 東北大学 大学院生命科学研究科 助教)
チームリーダー 林 茂生(ハヤシ・シゲオ)
フィジカルバイオロジー研究チーム
基礎科学特別研究員(研究当時)多羅間 充輔(タラマ・ミツスケ)
チームリーダー 柴田 達夫(シバタ・タツオ)
報道担当
理化学研究所 広報室 報道担当
東北大学 大学院生命科学研究科 広報室