女性ホルモンのエストロゲンが強いDNA切断作用を発揮する
2018-10-23 京都大学,アメリカ国立衛生研究所
笹沼博之 医学研究科准教授、津田雅貴 同助教(現・広島大学助教)、森本俊 医学部生、武田俊一 医学研究科教授、戸井雅和 同教授、Andre Nussenzweig アメリカ国立衛生研究所博士らの研究グループは、遺伝性乳がん卵巣がん症候群の発症メカニズムを明らかにしました。
本研究成果は、2018年10月下旬に、「米国科学アカデミー紀要」(PNAS)のオンライン版に掲載されます。
研究者からのコメント
生理濃度の女性ホルモンが強い変異原性を持つという、私たちの研究は、非常識な仮説を主張しても非難されることのない京大の自由な校風と、森本俊学部生の頑張りで、最終的に成果をあげることができました。また、共同研究者の武田教授は、本庶佑 特別教授の門下生です。教室員一同、本庶先生が言われる「論文を批判的に読む、Natureなどの有名誌に掲載されたことを鵜呑みにしてはいけない」を論文の輪読会で実践しようと努力しています。
概要
BRCA1遺伝子の変異を持つ女性は、遺伝性乳がん卵巣がん症候群として、乳がんや卵巣がんが起こりやすいことが知られています。しかし、なぜ他の臓器のがんではなく、乳腺や卵巣が発がんしやすいかは不明でした。
本研究グループは、BRCA1遺伝子を無くした乳がん細胞とマウス乳腺において、女性ホルモンであるエストロゲンに対する反応を調べました。その結果、妊娠中の血中濃度のエストロゲンに曝露された細胞の染色体DNAには、DNA切断が多く起こっていることを発見しました。また、エストロゲンによる切断の作用機序や、BRCA1タンパクがどのような分子機構によって切断の蓄積を防止するかについて解明しました。
エストロゲンは、従来、正常乳腺細胞や乳がん細胞の増殖促進作用が知られていましたが、X放射線のように、染色体DNAを切断する作用は知られていませんでした。つまり、エストロゲンとX放射線は全く違った作用機序で発がんを促進すると考えられてきました。しかし、本研究は、BRCA1タンパクが機能しなくなると、エストロゲンが増殖刺激と染色体DNA切断の両方の機序によって、相乗的に乳がんと卵巣がんの発症を促進することを明らかにしました。本研究成果は、遺伝性乳がん卵巣がん症候群の発症予測法の開発に貢献する成果です。
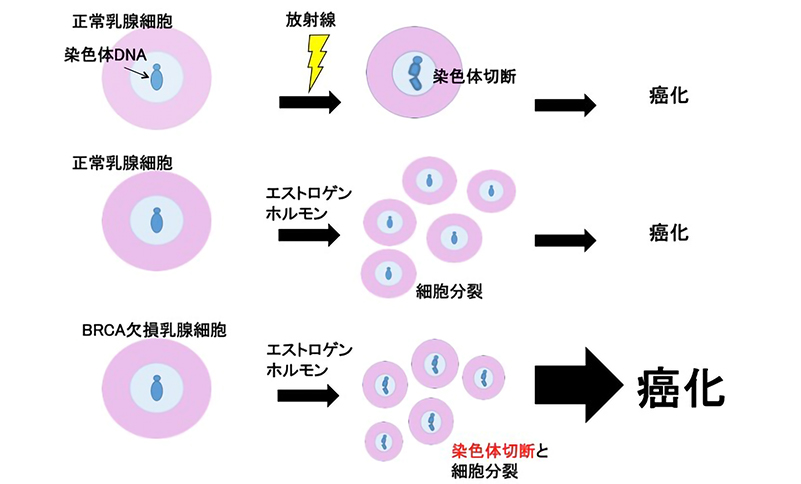
図:エストロゲンホルモンがBRCA欠損乳腺細胞で癌化を起こすしくみ
詳しい研究内容について
女性ホルモンのエストロゲンが強い DNA 切断作用を発揮する ―遺伝性乳がん卵巣がん症候群の発症メカニズムを解明―
概要
京都大学大学院医学研究科 放射線遺伝学研究室の笹沼博之 准教授、津田雅貴 同助教(研究当時、現:広 島大学大学院理学研究科助教)、森本俊 同医学部 6 回生は、武田俊一 同教授、同研究科 乳腺外科学研究室 戸井雅和 教授、アメリカ国立衛生研究所のがんゲノム部門長 Andre Nussenzweig 博士らと共に、遺伝性乳 がん卵巣がん症候群の発症メカニズムを明らかにしました。 本研究成果は、2018 年 10 月下旬に「米国科学アカデミー紀要」(Proceeding of National Academy of Sciences)のオンライン版に掲載されます。
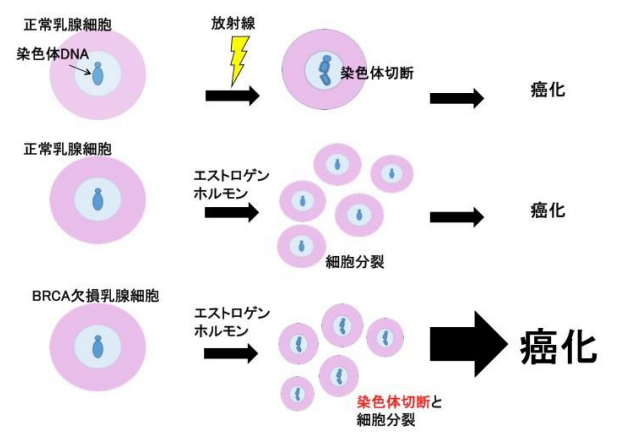
図1 エストロゲンホルモンが BRCA 欠損乳腺細胞で癌化を起こすしくみ
放射線は染色体 DNA を切断することによって発がんを促進する(上段)のに対し、エストロゲンは細胞増殖促進作 用によって発がんを促進します(中段)。
本研究では BRCA1 欠損乳腺細胞を調べることによって、エストロゲン が、X 放射線(上段)と同様に、染色体切断作用があることを見つけました(下段)。BRCA1 が欠損すると、エス トロゲンは増殖促進作用と染色体切断作用の相乗効果によって、乳腺細胞の癌化の確率を大きく増加します。 女性ホルモンのエストロゲンが強い DNA 切断作用を発揮する ―遺伝性乳がん卵巣がん症候群の発症メカニズムを解明― 概要 京都大学大学院医学研究科 放射線遺伝学研究室の笹沼博之 准教授、津田雅貴 同助教(研究当時、現:広 島大学大学院理学研究科助教)、森本俊 同医学部 6 回生は、武田俊一 同教授、同研究科 乳腺外科学研究室 戸井雅和 教授、アメリカ国立衛生研究所のがんゲノム部門長 Andre Nussenzweig 博士らと共に、遺伝性乳 がん卵巣がん症候群の発症メカニズムを明らかにしました。 本研究成果は、2018 年 10 月下旬に「米国科学アカデミー紀要」(Proceeding of National Academy of Sciences)のオンライン版に掲載されます。
BRCA1 遺伝子の変異を持つ女性は、乳がんや卵巣がんが起こりやすいことが知られています(遺伝性乳が ん卵巣がん症候群)。その為に、米国の女優アンジェリーナ・ジョリーさんは 39 歳の時に健康な乳房と卵 巣・卵管を切除しました。しかし、なぜ他の臓器のがんではなく、乳腺や卵巣が発がんしやすいかは不明で した。
本研究グループは、BRCA1 遺伝子を無くした乳がん細胞とマウス乳腺において、女性ホルモンであるエス トロゲンに対する反応を調べました。その結果、妊娠中の血中濃度のエストロゲンに曝露された細胞の染色 体 DNA には、DNA 切断がたくさん起こっていることを発見しました(図1)。また、エストロゲンによる 切断の作用機序(図2の①⇄②→③)や、BRCA1 タンパクがどのような分子機構によって切断の蓄積を防止す るか(図2の③→④)も解明しました。
エストロゲンは、従来、正常乳腺細胞や乳がん細胞の増殖促進作用が知られていましたが、X 放射線のよ うに、染色体 DNA を切断する作用は知られていませんでした(図1、上段)。すなわち、エストロゲンと X 放射線は全く違った作用機序で発がんを促進する(図1、上段と中段)と考えられてきました。本研究成果 は、BRCA1 タンパクが機能しなくなると、エストロゲンが増殖刺激と染色体 DNA 切断の両方の機序によっ て、相乗的に乳がんと卵巣がんの発症を促進することを明らかにしました(図1、下段)。
1.背景
BRCA1 遺伝子は、1990 年代に家族性乳がん卵巣がんの原因遺伝子として同定されました。BRCA1 遺伝子 機能が損なわれている人の乳がん発症リスクは、30 歳から増加し、損なわれていない人に比べ 6-12 倍高く なります(HBOC コンソーシアムのホームページより)。BRCA1 遺伝子の既知機能は、相同 DNA 組換えと 呼ばれる、切断された染色体 DNA を再結合する機構の促進です。相同 DNA 組換えは、全ての増殖細胞にお いて DNA 複製中に重要な働きをするため、なぜ BRCA1 遺伝子の変異が乳がんと卵巣がんを選択的に引き起 こすのかは不明でした。
2.研究手法・成果
本研究グループは、BRCA1 遺伝子欠損乳がん細 胞を作製しました。その細胞に生理的濃度のエス トロゲンに曝露したところ、たくさんの染色体 DNA 切断が蓄積することを見つけました。BRCA1 遺伝子欠損マウスの乳腺でも同様の蓄積を見つけ ました。
この DNA 切断は、トポイソメラーゼ2 (Top2)が原因でした。Top2 は、染色体 DNA の 切断と再結合を繰返し(図2の①⇄②)、絡んだ2 本の DNA の絡みを解消します。 このような絡み の解消は、エストロゲンが乳腺や卵巣において遺 伝子をスイッチ ON するときに高頻度に起こるこ とが知られています。以前の本研究グループの研 究は、Top2 は触媒反応中に頻繁に再結合に失敗す る(図2の②→③)ことを見つけました(参考文 献、Mol Cell 2016)。
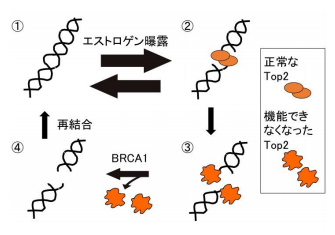
図2 乳腺や卵巣がエストロゲン刺激を受けると、染色体 DNA においてトポイソメラーゼ2(Top2)が活発に触媒反 応を始める(①⇄②)。エストロゲンは、Top2 によって染色 体 DNA を病的に切断する事がある (②→③)。その切断のす みやかな再結合には BRCA1 が必要である(③→④)。
再結合に失敗した Top2 は切断端に共有結合したままになっています(図2の③)。本研究の発見は、 BRCA1タンパクが、共有結合したままの Top2 を除去する反応を促進していることです(図2の③→④)。 すなわち、BRCA1タンパクは相同 DNA 組換え経路によって DNA 切断を再結合するだけでなく、その経路 とは全く別に、図2の③→④のステップで機能していることが解明できました。BRCA1遺伝子が欠損する と、この③→④ステップの機能が低下するために、エストロゲンに曝露された乳腺や卵巣は、放射線被曝し 続けた細胞のように染色体 DNA 切断を蓄積します。
以上の研究成果から、BRCA1遺伝子が欠損すると乳腺や卵巣に選択的に発がんが増えるのは、これらの臓 器のみエストロゲンが強い変異誘発物質としても作用するからだということが分かりました。
3.波及効果、今後の予定
現在、遺伝子診断で問題になっている点は、BRCA1 遺伝子のほとんどの変異を占める点変異について、各 点変異が発がん頻度を実際に増加するのか否か正確に予測できないことです。不明であるが故に、健康な乳 房と卵巣・卵管を切除すべきか否かを、点変異が見つかった女性については判断できません。本研究グルー プは、BRCA1 タンパクが乳腺・卵巣特異的に発がんを抑制する分子機構(図2の③→④)について解明でき ました。次の研究として、各変異が BRCA1 タンパクの発がん抑制機能をどれぐらい損ねるか否かを包括的 に解析する研究を始めています。具体的には、各点変異が BRCA1 タンパクの、図2③→④に示した機能を どの程度低下させるかを正確に判定しようとしています。正確に判定できるようになれば、発症の確率のみ ならず、発症年齢のおおよその予測も可能になるでしょう。発症が50歳以降になりそうだという予測がで きるようになれば、BRCA1 遺伝子の変異が見つかった若い女性に対し、出産してから健康な乳房と卵巣・卵 管を切除する手術を受けることを奨めることが可能になります。
4.研究プロジェクトについて
本研究は、科研費基盤 S(研究代表者、武田俊一)、JSPS 研究拠点形成事業(研究代表者、武田俊一)、基盤 B(研究代表者、笹沼博之)、新学術システムがん(研究代表者、笹沼博之) 、武田財団(研究代表者、笹沼博 之)、三菱財団(研究代表者、笹沼博之)の研究支援を受けて実施されました。
<論文タイトルと著者>
タイトル:BRCA1 ensures genome integrity by eliminating estrogen-induced pathological Topoisomerase II-DNA complexes(BRCA1 は、エストロゲン誘導性病的 Top2-DNA 複合体を除去することでゲ ノム安定性を維持する)
著 者:笹沼博之*、津田雅貴*、森本俊*、Liton Kumar Saha, Md. Maminur Rahman、清岡祐介、藤池春 奈、Andrew D. Cherniack、伊東潤二、Elsa Callen Moreu、戸井雅和、中田慎一郎、田中尚、筒 井研、山田真太郎、Andre Nussenzweig、武田俊一(*均等貢献の筆頭著者)
掲 載 誌:Proceeding of National Academy of Sciences
著 者:Nguyen Ngoc Hoa、清水翼、Zhong Wei Zhou, Zhao-Qi Wang、Rajashree A. Deshpande、 Tanya T. Paull、 Salma Akter、津田雅貴、古田良平、筒井研、武田俊一、笹沼博之
掲 載 誌:Molecular Cell 64(3):580-592、DOI: doi.org/10.1016/j.molcel.2016.10.011


