2025-02-25 東京大学,科学技術振興機構
発表概要
発表のポイント
- がんタンパク質DEKが、ゲノムDNAの構造(クロマチン)を変化させ、遺伝子の発現を抑える構造を作り出すことを発見しました。
- クライオ電子顕微鏡解析を用いて、DEKがクロマチン構造を変化させるメカニズムを明らかにしました。
- DEKやクロマチンを標的としたがん治療薬の開発への貢献が期待されます。
がんタンパク質DEKはヘテロクロマチン構造を作り出す
発表内容
東京大学定量生命科学研究所の鯨井智也 助教、越後谷健太 特任研究員、岸雄介 准教授、胡桃坂仁志 教授、同大学大学院薬学系研究科の後藤由季子 教授らによる研究グループは、がんタンパク質DEKが、ゲノムDNAに結合する機構を発見し、ゲノムDNA構造の変換を通じて、遺伝子の発現を抑制的に制御することを明らかにしました。
研究の背景
がんタンパク質DEKはもともと、急性骨髄性白血病で生じる遺伝子の異常から発見されました。DEKは、肝臓がんや卵巣がん、乳がんなどのさまざまながん組織において過剰に存在することが知られており、DEKを過剰に含むがん細胞を持つ患者は治療の予後が悪いことが報告されています。このようながん細胞でDEKを抑制すると、化学療法の効果が上昇しがん細胞の増殖率が低下することから、DEKはがん治療のターゲットとなる可能性が考えられています。しかし、DEKの持つ機能の詳細は不明でした。ヒトを含む真核生物のゲノムDNAは、ヒストンタンパク質に巻き付いてヌクレオソーム(注1)と呼ばれる構造体が連なったクロマチン構造(注2)を形成しています。DEKはクロマチンに豊富に存在しているタンパク質ですが、どのようにしてクロマチンに結合し、機能を発揮するのかは分かっていませんでした。
研究内容
本研究では、DEKがヌクレオソームに結合することを発見しました。クロマチン構造は、遺伝子の発現が活発なユークロマチン(注3)と不活発なヘテロクロマチン(注4)に分類され、この構造変換によってさまざまな遺伝子のON・OFFが決められています(図1)。
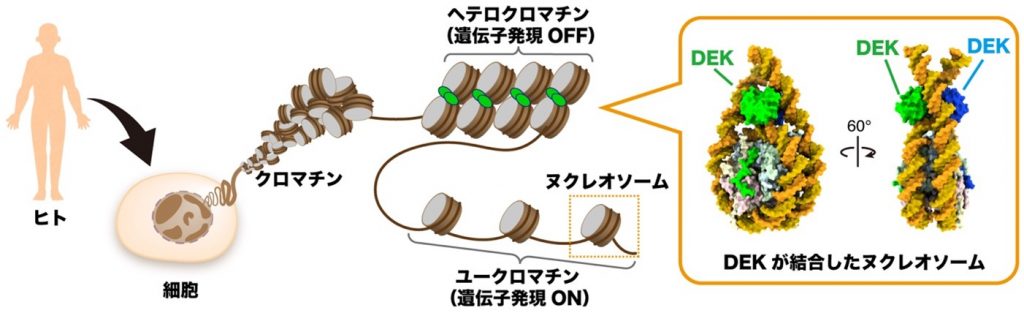
図1:がんタンパク質DEKはヘテロクロマチン構造を作り出す
まず、DEKの機能解明のためにゲノム解析(注5)を行った結果、DEKがヘテロクロマチン構造の目印であるヒストンのメチル化修飾(H3K27me3)(注6)と共局在することを見出しました。試験管内で再構成したクロマチンとメチル化酵素(ポリコーム抑制複合体PRC2)を用いたヒストンのメチル化実験を行ったところ、DEKによりメチル化の効率が上昇することを発見しました。
次に、DEKがクロマチン構造に与える影響を明らかにするため、クライオ電子顕微鏡解析(注7)を用いてヌクレオソームとDEKの複合体の立体構造を決定しました。その結果、2分子のDEKがヌクレオソームに結合し、ヌクレオソームをつなぐリンカーDNA(注8)を特殊な向きに固定していることが明らかになりました(図2)。
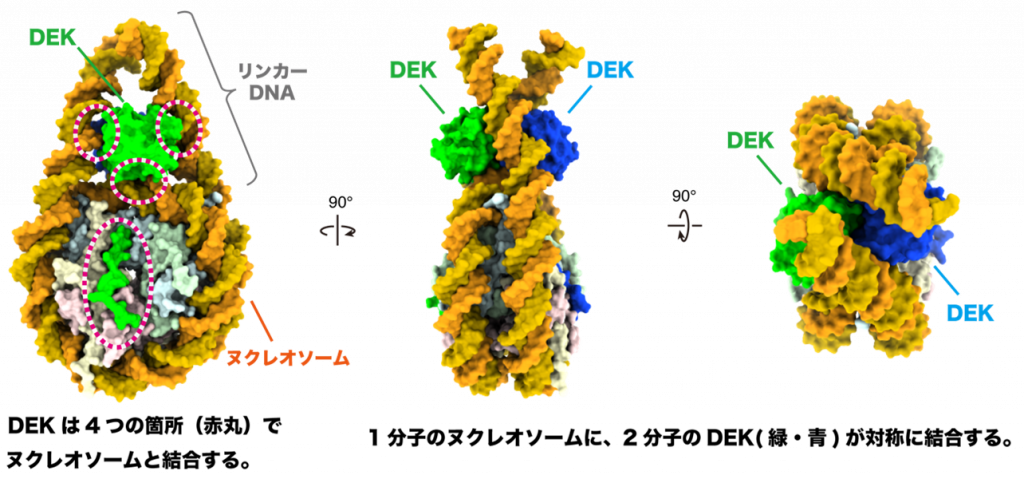
図2:DEKが結合したヌクレオソームの立体構造
さらに、原子間力顕微鏡(注9)を用いた観察により、DEKの結合によってクロマチンが凝縮することを発見しました。これらの結果から、DEKがクロマチンに結合して直接その構造を凝縮させ、ヒストンのメチル化を促進することによって、遺伝子発現に抑制的なクロマチン構造を形成させることが明らかとなりました(図3)。
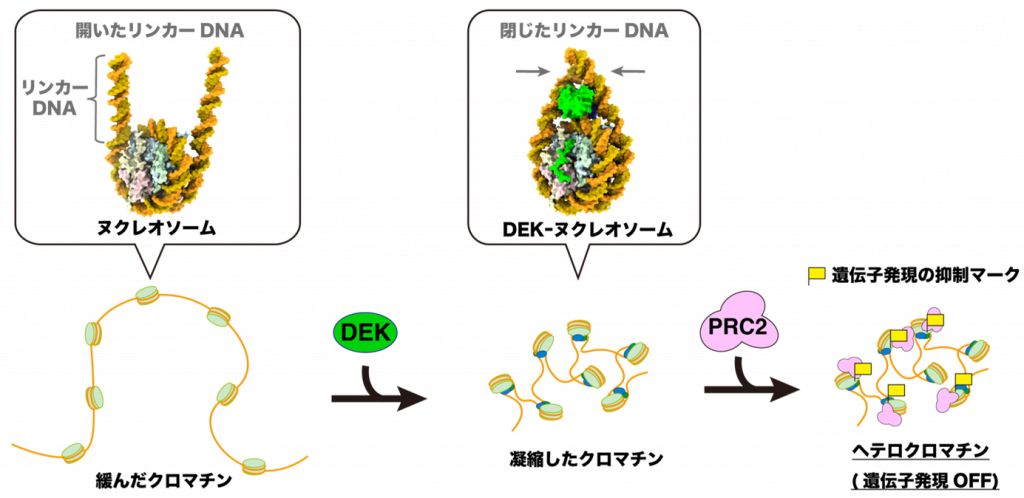
図3:DEKが遺伝子の発現を抑制するメカニズム
今後の展望
本研究によって、がんタンパク質DEKが遺伝子発現に抑制的なクロマチンの構造を形成することがはじめて明らかとなりました。このことから、DEKが過剰発現しているがん細胞ではクロマチン構造の制御に異常が生じ、がん細胞特有の遺伝子発現制御が引き起こされている可能性が考えられます。本知見をもとに、DEKやクロマチンを標的とした新たな治療法の確立につながることが期待されます。
発表者・研究者等情報
東京大学定量生命科学研究所 先端定量生命科学研究部門
クロマチン構造機能研究分野
鯨井 智也 助教
越後谷 健太 特任研究員
胡桃坂 仁志 教授
分子神経生物学研究分野
岸 雄介 准教授
東京大学大学院薬学系研究科 分子生物学教室
後藤 由季子 教授
研究助成
本研究は、日本学術振興会(JSPS)の科研費(課題番号:JP20H05690、JP22K15033、JP23K17392、JP23H05475、JP24H02328、JP22KJ0871、JP22K06098、JP23H04214、JP24K02020、JP16H06279、JP22K06183、JP22H00431、JP22H04925(PAGS))、科学技術振興機構(JST)の戦略的創造研究推進事業ERATO(課題番号:JPMJER1901)およびCREST(課題番号:JPMJCR24T3)、日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)(課題番号:JP23gm1310004)および生命科学・創薬研究支援基盤事業(BINDS)(課題番号:JP24ama121009、JP24ama121002)の支援により実施されました。
用語解説
(注1)ヌクレオソーム
4種類のヒストンタンパク質H2A、H2B、H3、H4からなる複合体にDNAが巻き付いた構造体です。このヌクレオソームがいくつも連なる数珠状構造を骨格としてクロマチン構造が形成されています。
(注2)クロマチン構造
ヒトをはじめとする生物のゲノムDNAは、 ヒストンタンパク質に巻き付いて細胞の核内に収納されており、数珠状の構造を取っています。この数珠状の構造には多様なタンパク質が結合しており、その巨大な複合体を「クロマチン」と呼びます。クロマチン構造は長大なDNAを効率よく収納するだけでなく、その構造の変換を通して遺伝子の働きを制御しています。
(注3)ユークロマチン
クロマチンのうち、比較的ゆるんだ状態のクロマチン構造を指します。ユークロマチンではDNAが核内のタンパク質によってアクセスされやすい状態となっていて、遺伝子の発現が活発な領域に多くみられます。
(注4)ヘテロクロマチン
クロマチンのうち、凝縮した状態のクロマチン構造を指します。ヘテロクロマチンではアクセスできるDNAの領域が限定されているため、遺伝子の発現が不活発になっています。
(注5)ゲノム解析
生物のゲノム配列を網羅的に解析し、それぞれの配列にどのような特徴があるのかを調べる手法です。注目している因子のゲノム配列中での結合場所や、遺伝子の発現量などを明らかにすることができます。
(注6)ヒストンのメチル化修飾(H3K27me3)
ヌクレオソームを構成するヒストンタンパク質に対する翻訳後修飾の一つを指します。ヒストンの翻訳後修飾によって、クロマチンの構造や機能がさまざまに変化することが知られていて、ヒストンH3の27番目のトリメチル化(H3K27me3)は、ヘテロクロマチンの形成に関与しています。
(注7)クライオ電子顕微鏡
タンパク質などの試料を非結晶の氷の中に閉じ込め、極低温下で電子線を用いて高解像度の画像を取得する装置です。コンピューターによる画像処理と組み合わせることによって、さらに高解像度の立体構造を決定することができます。
(注8)リンカーDNA
クロマチン構造中で、隣り合うヌクレオソームをつないでいるDNAを指します。リンカーDNAによってヌクレオソーム同士の位置関係が決められるため、リンカーDNAの向きの違いはクロマチン構造の制御に影響を与えます。
(注9)原子間力顕微鏡
試料の表面の構造をナノスケールで観察するための装置です。非常に細い針でタンパク質表面の凹凸を調べることで、その構造を解析することができます。
雑誌名等
雑誌名:Nature Structural & Molecular Biology
題 名:Structural insights into how DEK nucleosome binding facilitates H3K27 trimethylation in chromatin
著者名:Tomoya Kujirai(鯨井智也), Kenta Echigoya(越後谷健太), Yusuke Kishi(岸雄介), Mai Saeki(佐伯麻衣), Tomoko Ito(伊藤友子), Junko Kato(加藤淳子), Lumi Negishi(根岸瑠美), Hiroshi Kimura(木村宏), Hiroshi Masumoto(増本博司), Yoshimasa Takizawa(滝沢由政), Yukiko Gotoh(後藤由季子)*, Hitoshi Kurumizaka(胡桃坂仁志)* 【*:責任著者】
DOI: 10.1038/s41594-025-01493-w
URL: https://www.nature.com/articles/s41594-025-01493-w
問い合わせ先
東京大学定量生命科学研究所
教授 胡桃坂 仁志(くるみざか ひとし)
東京大学定量生命科学研究所 総務チーム
東京大学大学院薬学系研究科 庶務チーム
科学技術振興機構 広報課
(JST事業に関すること)
科学技術振興機構 研究プロジェクト推進部 ICT/ライフイノベーショングループ
今林 文枝(いまばやし ふみえ)