気道難治性疾患の原因究明の足がかりに
2021-07-08 京都大学大学院医学研究科,日本医療研究開発機構
概要
線毛上皮細胞は、呼吸のための空気の通り道である気道に侵入した病原体や異物を粘液と共に一方向性に除去する肺の必須機能を担っていますが、そのための細胞間の線毛協調運動注1)を培養皿内で生体内と同様に再現することは困難でした。京都大学大学院医学研究科 呼吸器疾患創薬講座 後藤慎平特定准教授、同医学部附属病院呼吸器内科 曽根尚之医員、小西聡史客員研究員(当時・現Duke大学)、同白眉センター・工学研究科 鳥澤勇介特定准教授(当時・現株式会社ヘリオス)、帝京大学先端総合研究機構・大阪大学大学院生命機能研究科 月田早智子教授らは、マイクロ流体気道チップ注2)とヒトiPS細胞から分化誘導した気道上皮シート注3)を組み合わせて細胞間の線毛協調運動を生体内に近い形で再現して機能評価する技術の開発に成功しました。さらに、京都大学呼吸器内科、同呼吸器外科、三重大学耳鼻咽喉・頭頸部外科、富山大学小児科との共同研究で、線毛運動に関連する遺伝子変異によって引き起こされる難病である線毛機能不全症候群注4)について、生体内に近い形でのモデル開発に成功しました。線毛機能不全症は非常に多彩な遺伝子変異によって引き起こされることが分かっており、そのことが診断を難しくしている原因の1つでしたが、今回の研究成果により、患者さんの末梢血からiPS細胞を樹立して、気道上皮細胞に分化させることで、診断に役立つ可能性が見出され、病態を詳しく解析する事が可能となりました。線毛機能不全症の原因かどうか分からない未知の遺伝子変異でも遺伝子修復をした細胞と比べれば、因果関係を証明することができ、治療につながる開発を進めることも可能になります。
本成果は2021年7月7日(米国東部標準時間)に国際学術誌「Science Translational Medicine」にオンライン掲載されました。
 研究の概略図
研究の概略図
背景
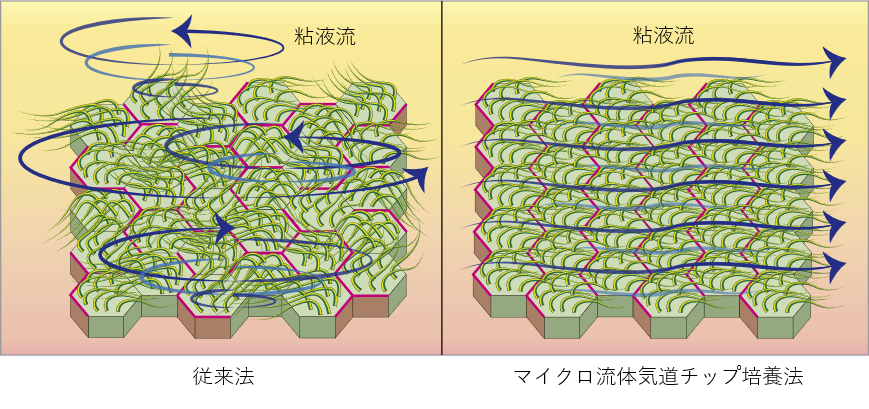
線毛上皮細胞は上気道・下気道に侵入した病原体や異物を一方向性に除去する機能を担っていますが、その機能を発揮する為には線毛上皮細胞間での協調的な線毛振動注5)が必要となります。この線毛振動が減弱したり協調運動が乱れたりすると、病原体や粘液が適切に排泄されず繰り返す肺炎や気管支拡張症の原因となります。本研究プロジェクトは2016年にヒトiPS細胞から肺前駆細胞を単離して、三次元培養と気液界面培養注6)を行うことで気道上皮細胞を作製することに成功しましたが(参考文献1)、この技術では線毛上皮細胞の一細胞レベルでの機能は再現できても、多細胞間の協調運動を構築する事はできませんでした。そこでヒトの生体内により近い状態での培養が可能なマイクロ流体気道チップを用いて、多細胞間の線毛運動を協調させることで生体内に近い細胞モデルを構築して難病の研究に役立てられるのではないかと考えました。
今回紹介する線毛機能不全症候群は線毛上皮細胞の機能異常により引き起こされる遺伝性疾患です。診断は一般的に難しく、遺伝子検査の他、鼻腔内NO検査注7)、電子顕微鏡検査、高速ビデオ顕微鏡検査を組み合わせることで診断にたどり着きますが、約30%の症例が未診断のままとされています。現在判明しているだけでも原因遺伝子は40種類以上が報告されており、さらに遺伝子変異の種類によって線毛運動の減弱や協調運動の消失といった様々な異常パターンが報告されてきました。細胞を詳しく調べて、正しく診断できるようにするためには患者さん由来の細胞が不可欠ですが、侵襲性を伴う検査の繰り返しは極力回避する必要もありました。臨床現場ではこのような難病の疑いのある患者さんを診る機会がしばしばあり、検査や治療手段への限界もあったことから、なんとかして研究を進めなければと思いました。そこで、患者さん由来の線毛上皮細胞を繰り返し安定して得られる手段として末梢血から樹立可能なiPS細胞に着目し、線毛機能不全症候群の診断や病態の理解に役立つ研究を目指しました。
研究手法・成果
i.気道上皮細胞シート内で細胞同士の線毛運動を協調させることが可能に
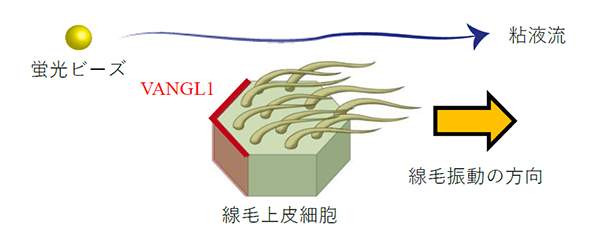
マイクロ流体気道チップ技術を用いて、一定の液流負荷をかけながら気道上皮細胞への分化誘導を試みたところ、液流負荷の方向に合わせて異なる線毛上皮細胞同士の線毛振動の方向がそろい、一方向性の粘液流が形成されました。線毛振動の根本側に発現することが知られている代表的な平面内細胞極性注8)コア蛋白質の一つであるVANGL1注9)蛋白質を、液流負荷をかけて分化誘導した気道上皮細胞シートで染色したところ、線毛振動の方向性と対応した粘液流の向きと反対側の細胞境界に整列して染まることを見出しました。さらにこのVANGL1遺伝子を欠損したiPS細胞を作製してみると同じく代表的な平面内細胞極性を支えるVANGL2遺伝子の発現も大きく障害され、線毛の正常な動きも障害されることが分かりました。
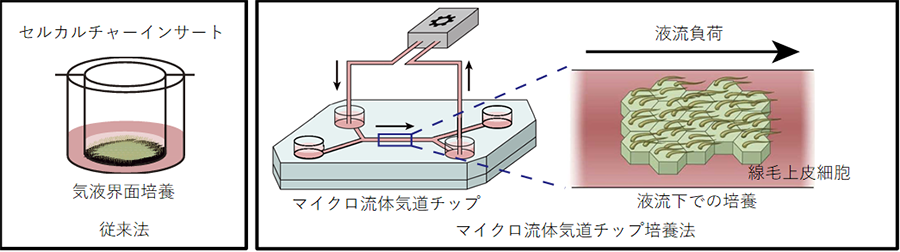 図1.マイクロ流体気道チップ技術を用いた培養方法の概念図
図1.マイクロ流体気道チップ技術を用いた培養方法の概念図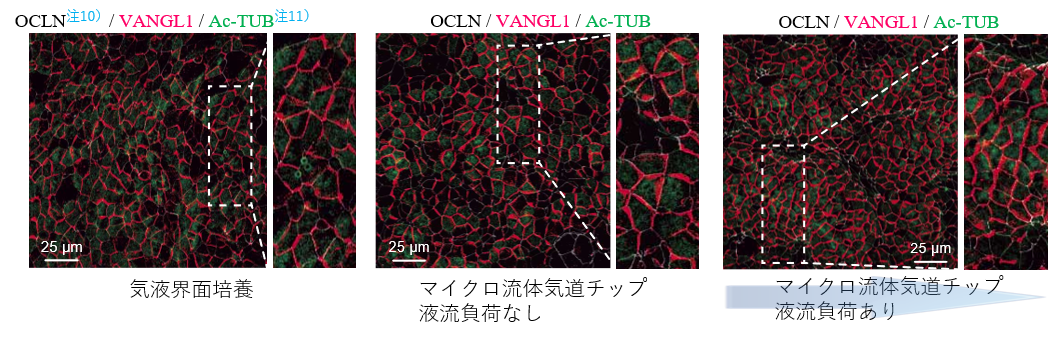 図2.液流負荷の有無による細胞間の平面内細胞極性の変化(左:従来法、中央:液流なし、右:液流あり)マイクロ流体気道チップ上で液流負荷(液流負荷の方向は青矢印の方向)を行うと、代表的な平面内細胞極性のマーカーであるVANGL1(赤色)の発現方向が揃う傾向を認めた。
図2.液流負荷の有無による細胞間の平面内細胞極性の変化(左:従来法、中央:液流なし、右:液流あり)マイクロ流体気道チップ上で液流負荷(液流負荷の方向は青矢印の方向)を行うと、代表的な平面内細胞極性のマーカーであるVANGL1(赤色)の発現方向が揃う傾向を認めた。 図3.液流負荷の有無による線毛協調運動を粘液流で評価(左:従来法、中央:液流なし、右:液流あり)マイクロ流体気道チップ上で液流負荷(液流負荷の方向は青矢印の方向)をかけた後では、液流負荷をかけていた方向に粘液に見立てた蛍光ビーズ(黄色の軌跡)が流れることを確認できた。
図3.液流負荷の有無による線毛協調運動を粘液流で評価(左:従来法、中央:液流なし、右:液流あり)マイクロ流体気道チップ上で液流負荷(液流負荷の方向は青矢印の方向)をかけた後では、液流負荷をかけていた方向に粘液に見立てた蛍光ビーズ(黄色の軌跡)が流れることを確認できた。
ii.液流をかけると空気と接しなくても気道上皮細胞への分化が促進されることを発見
気道上皮細胞への分化誘導には従来から空気と接しながら培養する気液界面培養を行う手法が取られてきましたが、この方法では細胞間の線毛協調運動を実現することは困難でした。気道上皮細胞の分化過程で空気と接しない培地に浸かった状態での液流負荷を行ったところ、液流負荷をかけない場合に比べて線毛上皮細胞が多く分化誘導されることに気づきました。線毛上皮細胞は胎児の頃から備わっていますが、この頃の胎児は気管が羊水で満ちた状態で呼吸様運動注12)をしています。この時の気管内の液流の流れは線毛上皮細胞への分化促進にも役立っているのかもしれません。
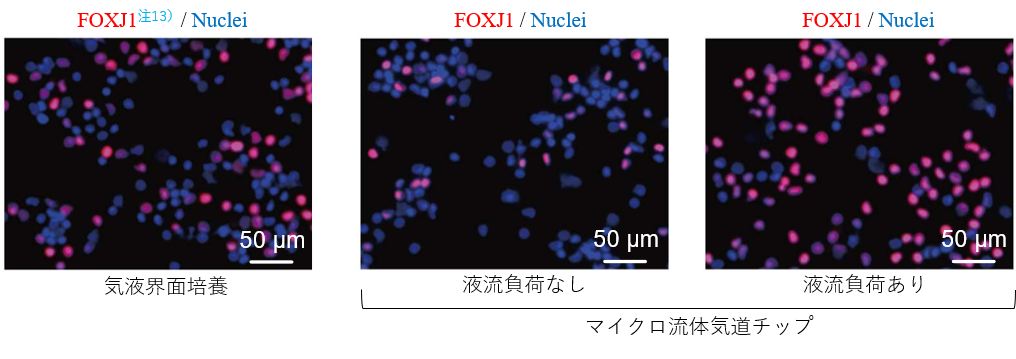 図4.液流負荷の有無による線毛上皮細胞へ分化効率の変化(左:従来法、中央:液流なし、右:液流あり)液流負荷により、線毛上皮細胞に分化した事を示すFOXJ1(赤色)の陽性率が上昇することを発見した。
図4.液流負荷の有無による線毛上皮細胞へ分化効率の変化(左:従来法、中央:液流なし、右:液流あり)液流負荷により、線毛上皮細胞に分化した事を示すFOXJ1(赤色)の陽性率が上昇することを発見した。
iii.線毛機能不全症候群の原因遺伝子変異を持つ様々なiPS細胞を用いて線毛機能異常を培養皿内で再現
線毛機能不全症候群患者からそれぞれ樹立したiPS細胞(疾患特異的iPS細胞)と、その原因と考えられる各2つずつある遺伝子変異(HEATR2, DNAH11)のそれぞれの変異についてCRISPR-Cas9注14)を用いたゲノム編集で修復した細胞(遺伝子修復iPS細胞)を作製して、遺伝子修復前後を比較できるようにしました。また、線毛機能不全症候群の原因として知られている代表的な遺伝子であるDNAAF2, DNAH11, RSPH4Aをそれぞれ欠損させたiPS細胞(ノックアウトiPS細胞)を作製し、健常者由来のiPS細胞と比較できるようにしました。これらのiPS細胞は一度樹立しておくと、いずれも永久的に増やして保存しておくことができます。そして、必要時にそれぞれのiPS細胞から気道上皮細胞を分化誘導すれば、細胞の病態を繰り返し詳しく調べて今後の研究に役立てられるようになりました。その結果、線毛機能を詳しく解析してみると、これまで個々の原因遺伝子で散発的に報告されてきた様々な線毛運動の異常は、培養皿内でも意図的に再現することができました。
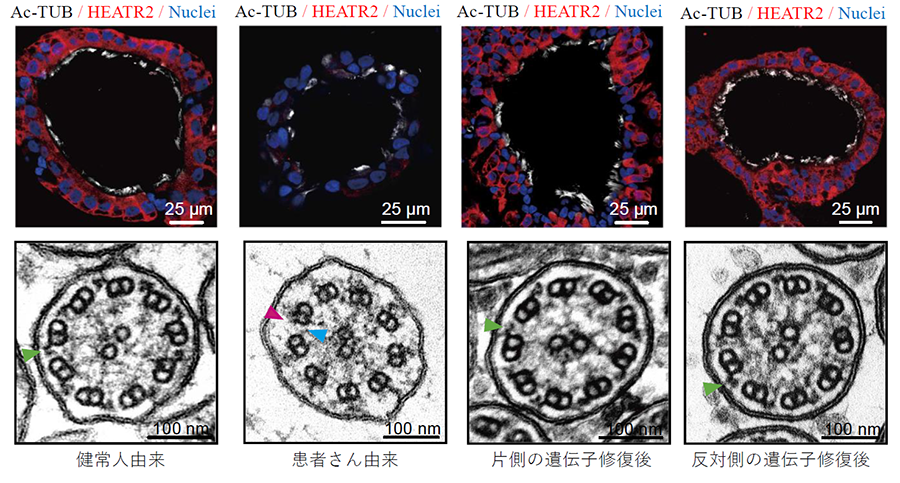 図5 疾患特異的iPS細胞を用いて再現できた線毛機能不全症候群の遺伝子修復前後の気道上皮細胞
図5 疾患特異的iPS細胞を用いて再現できた線毛機能不全症候群の遺伝子修復前後の気道上皮細胞
(上段:免疫染色像、下段:電子顕微鏡像。緑矢印は外腕ダイニン注15)を示し、赤と青矢印は内腕・外腕ダイニンの欠損を示す)HEATR2が原因遺伝子と疑われた症例の疾患特異的iPS細胞とHEATR2の両側対立遺伝子注16)の遺伝子変異をそれぞれ修復し気道上皮細胞に分化誘導したところ、HEATR2の既報と一致する細胞や線毛の異常が確認でき、遺伝子修復によりその異常が正常に戻ることを確認した。
iv.線毛機能不全症候群の疾患特異的iPS細胞でも分化誘導した気道上皮細胞は液流を感知して向きを揃えた
これまで線毛協調運動には線毛の振動そのものが必要と考えられてきましたが、線毛機能不全症候群の患者さんから同意を得て作製したiPS細胞(疾患特異的iPS細胞)を、液流負荷をかけながら気道上皮細胞に分化誘導したところ、液流負荷の方向に一致して線毛運動の方向性の目安となる平面内細胞極性蛋白質VANGL1が配向する事を発見しました。これは線毛運動がなくても細胞同士が協調できる可能性を示唆しており、細胞同士を協調させるメカニズムの解明に役立つ可能性があります。
波及効果、今後の予定
これまで原因遺伝子変異が不明で、診断が困難であった線毛機能不全症候群の正確な診断や新しい治療法の開発に役立てられる可能性があります。特に、iPS細胞を利用すると大気汚染や喫煙といった二次性の線毛異常の影響の可能性をなるべく除外した状態で評価することが可能となります。また、ヒトiPS細胞とマイクロ流体気道チップを組み合わせたことで、気道上皮細胞の分化誘導では空気に接しなくても培地に流れをかけることで効率よく、細胞間の線毛協調運動を備えた線毛上皮細胞が分化できるようになりました。その仕組みを応用すれば、生体内と同じくらいに機能性を高めた気道上皮細胞シートの作成にも役立てられ、これらの知見は将来的な気道の再生医療にも役立つことが期待されます。
研究プロジェクトについて
本研究は、下記機関より資金的支援を受けて実施されました。
日本医療研究開発機構 再生医療実現拠点ネットワークプログラム・難治性疾患実用化研究事業・橋渡し研究戦略的推進プログラム、日本学術振興会・文部科学省 科学研究費補助金、科学技術振興機構(JST)戦略的創造研究推進事業CREST、杏林製薬株式会社
本研究の共同研究は下記研究室の協力を得て実施されました。
- 京都大学白眉センター・大学院工学研究科 鳥澤勇介特定准教授
- 帝京大学先端総合研究機構・大阪大学大学院院生命機能研究科 月田早智子教授
- 京都大学大学院医学研究科 呼吸器内科学 平井豊博教授
- 京都大学大学院医学研究科 形態形成機構学 萩原正敏教授
- 京都大学大学院医学研究科 呼吸器外科学 伊達洋至教授
- 名古屋大学大学院医学系研究科 呼吸器外科学 芳川豊史教授
- 三重大学大学院医学系研究科 耳鼻咽喉・頭頸部外科 竹内万彦教授
- 富山大学医学部小児科学教室 足立雄一教授
用語説明
- 注1.線毛協調運動
- 異なる線毛上皮細胞間での同調した線毛運動のことで、一方向性の粘液流の形成には必須の機能である。
- 注2.マイクロ流体気道チップ
- 半導体製造技術を用いて微細な流路を樹脂などの基盤に形成することで、通常の細胞培養では困難な液流や呼吸様運動等の生体内の環境を再現できるようにした細胞培養用のチップ。
- 注3.気道上皮シート
- 気道上皮細胞を多数集めて平面に薄く広げるように配列させたシート。
- 注4.線毛機能不全症候群
- 先天的に線毛運動に関連する遺伝子変異によって線毛運動が障害され、中耳、耳管、鼻、副鼻腔、咽頭を含めた呼吸器系の易感染性を呈する疾患。
- 注5.線毛振動
- 粘液流の形成に必要な線毛上皮細胞の線毛運動のこと。
- 注6.気液界面培養
- セルカルチャーインサートの多孔メンブレン上に細胞を播種し、細胞の上側を気相、メンブレンの下側を液相とする培養法。呼吸器系や皮膚、角膜等の外気と接触している器官の細胞の培養に用いられている。
- 注7.鼻腔内NO検査
- 鼻腔内から排出される一酸化窒素を測定する検査。線毛機能不全症候群では低値を示すことが多い。
- 注8.平面内細胞極性
- 上皮組織では細胞はシート状に配置されており、頂部と基底部からなる頂底極性を保っているが、さらに頂底極性に直交する形で、同一シート内で発達する細胞極性。
- 注9.VANGL1
- 平面内細胞極性の形成に関与する代表的な蛋白質。線毛上皮細胞においては線毛振動の方向と反対側に発現することが知られている。
- 注10.OCLN
- 細胞間接着に働くタイトジャンクションを構成する膜タンパク。本研究では一つ一つの細胞境界を明確化する為に使用。
- 注11.Ac-TUB
- アセチル化により安定化した微小管で、線毛上皮細胞の線毛部分によく染まる分子マーカー。
- 注12.胎児呼吸様運動
- 胎児は胎盤と臍帯を通して酸素の補給を行うため、肺呼吸はしていないが、妊娠28週頃から、羊水を飲んでは肺の中で溜めて吐き出す呼吸の練習のような運動を行っている。
- 注13.FOXJ1
- 線毛上皮細胞に分化を調節する転写因子。代表的な線毛上皮細胞の分子マーカー。
- 注14.CRISPR-Cas9
- CRISPRとはClustered Regularly Interspaced Short Palindromic Repeatの略で、もともと細菌類が持つファージなどに対する獲得免疫機構の一つ。このCRISPRが特徴を持った標的DNAを認識する仕組みを利用して、Cas9(CRISPR associated)タンパク質と組み合わせることで目的とする遺伝子をゲノム編集できるように応用した技術。
- 注15.外腕/内腕ダイニン
- 微小管上を移動するモータータンパク質分子の一つ。線毛のダイニンは微小管上の結合位置によって外腕ダイニンと内腕ダイニンに区分される。
- 注16.対立遺伝子
- 子供は父親と母親から同じ遺伝子セットを持つ染色体を1組ずつ受け継ぐ。両親から受け継いだ1対の遺伝子セットを対立遺伝子と呼ぶ。
参考文献
Konishi S, et al (2016). Directed induction of functional multi-ciliated cells in proximal airway epithelial spheroids from human pluripotent stem cells. Stem Cell Reports, 6(1), 18-25.
論文タイトルと著者
- タイトル
- Multicellular Modeling of Ciliopathy by Combining iPS cells and Microfluidic Airway-on-a-chip Technology(iPS細胞とマイクロ流体気道チップ技術を組み合わせた多細胞での線毛病モデルの構築)
- 著者
- Naoyuki Sone, Satoshi Konishi, Koichi Igura, Koji Tamai, Satoshi Ikeo, Yohei Korogi, Shuhei Kanagaki, Toshinori Namba, Yuki Yamamoto, Yifei Xu, Kazuhiko Takeuchi, Yuichi Adachi, Toyofumi F. Chen-Yoshikawa, Hiroshi Date, Masatoshi Hagiwara, Sachiko Tsukita, Toyohiro Hirai, Yu-suke Torisawa, Shimpei Gotoh
- 掲載誌
- Science Translational Medicine
- DOI
- 10.1126/scitranslmed.abb1298
お問い合わせ先
研究に関するお問い合わせ先
後藤 慎平(ごとう しんぺい)
京都大学大学院医学研究科 呼吸器疾患創薬講座・呼吸器内科学 特定准教授
報道・取材に関するお問い合わせ
京都大学 総務部広報課国際広報室
AMED事業に関する問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
再生・細胞医療・遺伝子治療事業部 再生医療研究開発課
再生医療実現拠点ネットワークプログラム