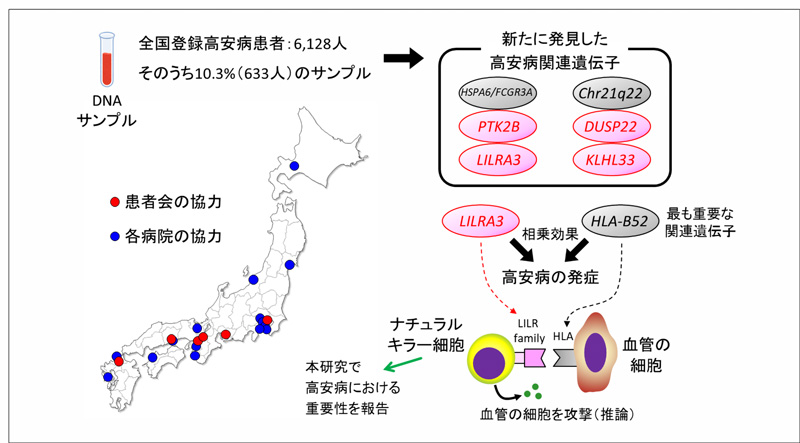
膵癌のサブタイプ特異的な新規治療法の開発に期待
2018-12-18 国立大学法人 東京医科歯科大学,国立研究開発法人 日本医療研究開発機構
ポイント
- 近年、癌のサブタイプ*1に応じた治療の最適化が期待されていますが、難治性癌の1つである膵癌では未だ確立されていません。
- 本研究ではヒストン修飾遺伝子KDM6Aの不活化サブタイプの膵癌が予後不良であることを明らかにし、ヒストンアセチル化酵素p300とKDM6Aの複合体形成不全によって、癌悪性化にいたる機序を世界で初めて明らかにしました。
- KDM6A不活化によるヒストンアセチル化低下は脱アセチル化酵素(HDAC)阻害薬の使用により回復することを証明し、膵癌移植腫瘍モデルにおいてHDAC阻害剤投与により腫瘍抑制されることを明らかにしました。
- 本研究成果により、予後不良なKDM6A不活化膵癌サブタイプにおける特異的治療としてHDAC阻害薬を用いた治療の有効性が示唆され、今後の臨床応用が期待されます。
東京医科歯科大学大学院 医歯学総合研究科 分子腫瘍医学分野の田中真二教授、島田周助教、秋山好光講師、渡辺秀一大学院生の研究グループは、同ウイルス制御学の山岡昇司教授、同肝胆膵外科学の田邉稔教授との共同研究で、予後不良な膵癌サブタイプの特徴であるKDM6A不活化が癌悪性化を起こす機序を世界で初めて明らかにしました。この研究は国立研究開発法人日本医療研究開発機構(AMED)「次世代がん医療創生研究事業」(P-CREATE)、文部科学省科学研究費補助金、高松宮妃癌研究基金研究助成金等のもとにおこなわれたもので、その研究成果は、国際科学誌International Journal of Cancer(インターナショナルジャーナルオブキャンサー)に2018年12月17日にオンライン版で発表されました。
研究の背景
近年、癌のサブタイプ*1に応じた治療の最適化が様々な癌腫で進められています。しかしながら典型的な難治性癌の1つである膵癌では、未だ確立されていません。最近、国際共同プロジェクトによる大規模統合解析の結果をもとに、膵癌におけるサブタイプ分類が提唱され(Bailey et al. Nature 2016)、最も予後不良なサブタイプの特徴としてKDM6A不活化変異が報告されました。KDM6Aはヒストン修飾因子*2の1つであり、ヒストンアセチル化酵素p300*3と複合体を形成して遺伝子の発現を制御することが報告されていますが(Wang et al. Mol Cell 2017)、ヒト膵癌における臨床的意義や機能については不明でした。
研究成果の概要
本研究ではまず、Cancer Genome Atlas Networkにより公共データベースに登録された膵癌147症例を再解析し、既報(Collisson et al. Nat Med2011)と同様に膵癌が3つのサブタイプに分類されることを確認しました。このとき、予後不良なサブタイプは全体の30%を占め、これらの症例ではKDM6Aの発現低下とともにKDM6Aのアレル欠失が集積していました。樹立された膵癌細胞株のデータベースにおいてもKDM6Aの発現低下とアレル欠失が相関していたことからKDM6A不活化は全体の数%にしかみられない変異によってのみ起こるのではなく、アレル欠失による発現低下を機序としているものが多く含まれている可能性が示唆されました。この知見をもとにヒト膵癌の臨床症例を解析したところ、全症例の25%でKDM6Aが発現しない(陰性)症例がみとめられ、これらは有意に予後不良であることを見出しました(図1)。
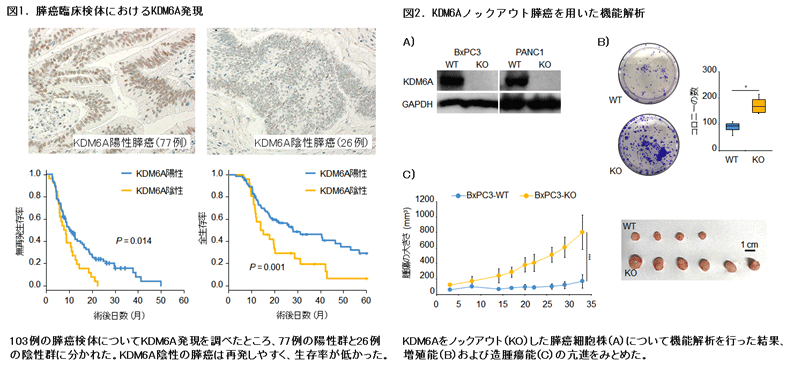
続いて膵癌におけるKDM6A不活化の生物学的意義を調べるため、ゲノム編集法および誘導発現法を用いてヒト膵癌細胞でKDM6A発現を操作した細胞株を作成しました。KDM6Aをノックアウトした膵癌細胞では増殖能、遊走能、浸潤能および造腫瘍能の亢進をみとめた一方、KDM6Aを強制発現するとそれらの低下をみとめました(図2)。
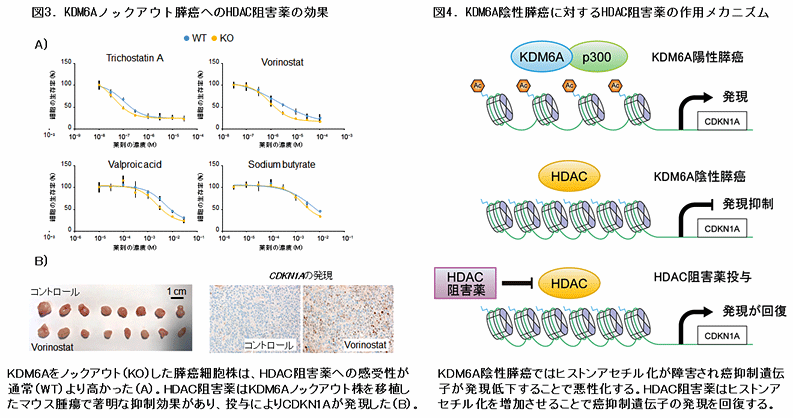
さらに膵癌細胞においてKDM6Aとヒストンアセチル化酵素p300の共局在および相互作用が示され、ヒストンH3リジン27のアセチル化(H3K27ac)*4を促すことが示唆されました。KDM6Aノックアウト膵癌細胞株における網羅的遺伝子発現解析の結果、CDKN1A*5をはじめとする癌抑制因子群の遺伝子発現が抑制されていました。CDKN1A遺伝子についてヒストン修飾因子の解析を行ったところプロモーター領域でH3K27acの低下をみとめた一方、強制発現株ではH3K27acの上昇および発現亢進をみとめました。ヒストン脱アセチル化酵素(HDAC)阻害薬*6を投与したところ、KDM6Aノックアウト株では薬剤感受性が有意に亢進しており、CDKN1Aのプロモーター領域でのH3K27acの回復と発現上昇をみとめました。また、KDM6Aノックアウト膵癌の移植腫瘍モデルにおいて、HDAC阻害剤投与によりCDKN1A発現上昇と腫瘍抑制をみとめました(図3)。
これらの結果から、KDM6A不活化がヒストンアセチル化酵素p300との複合体形成不全から癌抑制遺伝子のプロモーター領域におけるヒストンアセチル化の低下と発現低下をきたし、癌悪性化にいたるという機序が明らかになり、KDM6A不活化膵癌サブタイプにおける特異的治療としてHDAC阻害薬を用いた治療の有効性が示唆されました(図4)。
研究成果の意義
本研究は膵癌において3割程度を占める予後不良サブタイプをターゲットとしたサブタイプ特異的治療の可能性を提示しました。今後、サブタイプを考慮した臨床試験の構築などを通して難治癌である膵癌に対して新たな治療戦略が開発されることが期待されます。
用語解説
- *1 癌のサブタイプ
- 近年、大規模な癌ゲノム解析の結果が報告され、同一臓器から発生し病理学的にも同じ癌と分類されるものの中にも遺伝子変異や発現のプロファイルの異なるグループ(サブタイプ)が存在することが知られるようになった。これらのサブタイプは臨床経過や治療への反応性が異なる場合があることが報告されている。
- *2ヒストン修飾因子
- ヒストンはDNAに結合するたんぱく質であり、長いDNA分子を折り畳んで核内に収納する役割をもつ。ヒストンたんぱく質はメチル化やアセチル化といった化学修飾を受けており、遺伝子発現の制御に関わっている。ヒストン修飾因子はこれらを調節するはたらきをもつ蛋白である。近年では複数の蛋白が複合体を形成し協調して作用していることが明らかになっている。
- *3p300
- 遺伝子の転写が開始する時に働く転写因子複合体を構成する蛋白の1つであり、ヒストンのアセチル化を起こすヒストンアセチル基転移酵素である。
- *4ヒストンH3リジン27のアセチル化(H3K27ac)
- ヒストンは構造的にH2A・H2B・H3・H4が2分子ずつ集まった8量体として形成され、ヒストンH3のリジン残基のアセチル化(H3K27ac)は遺伝子の活性化に関連しているとされる代表的な化学修飾である。H3K27acが多いヒストンの領域はDNAが弛緩した状態となり、遺伝子発現を行うための転写因子の結合が起こりやすい状態になっていると考えられている。
- *5CDKN1A
- サイクリン依存性キナーゼ阻害因子の1つ。細胞周期の進行を抑制する遺伝子として報告されている。
- *6ヒストン脱アセチル化酵素(HDAC)阻害薬
- ヒストンの脱アセチル化を起こす酵素を阻害することによりヒストンのアセチル化を保持することで作用する薬剤。Vorinostatは癌を対象として開発されたHDAC阻害薬であり、本邦でも皮膚T細胞リンパ腫に対して保険適応が認められている。
問い合わせ先
研究に関すること
東京医科歯科大学大学院医歯学総合研究科
分子腫瘍医学分野 島田 周(シマダ シュウ)
田中 真二(タナカ シンジ)
報道に関すること
東京医科歯科大学 総務秘書課広報係
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 がん研究課