2018-01-08 東京大学,日本医療研究開発機構
発表者
富田 泰輔(東京大学大学院薬学系研究科薬学専攻 教授)
木棚 究(東京大学薬学部 特別研究員)
建部 卓也(元 東京大学大学院薬学系研究科薬学専攻 大学院生/現 帝京平成大学薬学部 助教)
堀 由起子(東京大学大学院薬学系研究科薬学専攻 助教
発表のポイント
- アルツハイマー病原因タンパク質アミロイドβの脳内存在量および蓄積速度を規定する新規酵素KLK7を同定し、その活性化メカニズムを解明した。
- 脳における非神経細胞であるグリア細胞の一つ、アストロサイトがKLK7を介してアミロイドβ代謝及び蓄積に寄与していることを明らかにした。
- アストロサイトを創薬標的細胞とした新規アルツハイマー病治療・予防法、診断法の開発に繋がることが期待される。
発表概要
今回、東京大学大学院薬学系研究科の富田泰輔教授、木棚究特別研究員、建部卓也元大学院生らのグループは、アミロイドβを分解する新規酵素kallikrein-related peptidase 7(KLK7)を同定し、脳内ではアストロサイトが分泌していること、またアルツハイマー病患者脳ではその発現量が低下していること、さらに遺伝子をノックアウトしたモデルマウスにおいてはアミロイドの蓄積が亢進することを明らかにしました。加えて、アストロサイトにおけるグルタミン酸シグナル(注4)を抑制することでKLK7の発現量と分解活性を上昇させることができることを見出しました。
本研究成果はこれまでにアルツハイマー病発症機構において注目されてこなかったアストロサイトを標的とすることで新規治療・予防薬の開発につながることが期待されます。
発表内容
①研究の背景・先行研究における問題点
超高齢化社会を迎え、認知症の治療、予防そして診断法の確立は喫緊の課題となっています。認知症の半分以上はアルツハイマー病によって生じることが示されています。これまでの研究から、アルツハイマー病の原因として、神経細胞が分泌するアミロイドβと呼ばれるタンパク質が老人斑として蓄積し、神経細胞内に存在するタウ(注5)の異常凝集を引き起こして神経細胞死に至ることが考えられており、アミロイドβやタウを標的とした創薬が進められています。
一方近年、神経細胞以外の細胞が脳の生理機能に大きな役割を果たすことが示されつつあり、注目されています。アストロサイトは脳内の免疫や炎症を司るグリア細胞の一種であり、ヒトにおいては神経細胞よりも十倍以上存在することが知られています。アルツハイマー病患者脳においてはアストロサイトの異常活性化が認められていますが(図1)、これまでこの反応はアミロイドβやタウ蓄積、また神経細胞死に呼応して生じる、炎症性反応と理解され、アストロサイトがアルツハイマー病の病態形成そのものに深く関わっているとは考えられてきませんでした。
②研究内容
東京大学大学院薬学系研究科の富田泰輔教授らの研究グループでは、アストロサイトがアルツハイマー病におけるアミロイド病理に直接影響するかどうかの検討を行いました。その結果、アストロサイトの培養上清にアミロイドβを分解する活性が存在することを見出しました。そして薬理学的、遺伝学的な解析から、その責任酵素としてkallikrein-related peptidase 7(KLK7)と呼ばれる、分泌型のプロテアーゼ(注6)を同定しました。興味深いことに、日本人や欧米人のアルツハイマー病患者脳においてKLK7の発現量が半減していることが確認されたことから、KLK7はアルツハイマー病病態形成に関与していることが推測されました。そこでKlk7ノックアウトマウスを作出しアルツハイマー病モデルマウスと交配すると、脳内のアミロイドβ量が上昇し、またアミロイド斑の蓄積が加速することが確認されました(図2)。またKlk7をノックアウトしたモデルマウスではアストロサイトの異常活性化、タウの異常リン酸化や変性突起の出現など、アミロイド蓄積の下流で生じる病的現象も加速していることが認められ、KLK7はアルツハイマー病病態の規定因子であることが示されました。
同時に、アルツハイマー病モデルマウス脳内ではアミロイド蓄積病態の悪化に伴い、KLK7の発現量が増加していることが見出されました。興味深いことに、アストロサイトに一般的な炎症反応を引き起こすリポ多糖を処理してもKLK7発現量は増加しませんが、細胞外アミロイドβ量が増加するとKLK7発現が亢進します。したがってアストロサイトは細胞外のアミロイドβの増加を感知すると、その分解のためにKLK7発現を上昇させることが推測されました。一方でアルツハイマー病患者脳では何らかの理由でこの発現上昇が不可能となっていることが示唆されました。
KLK7タンパク質を脳内へ注入すると、アミロイドβ量の減少が認められたことから、KLK7の発現もしくは活性の上昇は抗アミロイドβ薬の開発に繋がることが期待されました。そしてアストロサイトにおけるKLK7発現量増加を引き起こす化合物として、現在認知症治療薬として認可されているメマンチン(注7)を同定しました。メマンチンは神経細胞においては神経伝達物質であるグルタミン酸を受容するNMDA受容体に対する拮抗薬です。しかしアストロサイトにおけるメマンチンの薬理作用については不明でした。そこでアストロサイトに対してグルタミン酸やNMDAを投与すると、KLK7の発現量が低下することを見出しました。つまり、アストロサイトにおけるKLK7発現量はグルタミン酸シグナルによって抑制されていると考えられました。
③社会的意義・今後の予定
今回の研究を通して、アルツハイマー病に対する創薬標的分子として、アストロサイトにおけるKLK7を同定することができました。特にその病的意義が不明であったアストロサイトが脳内アミロイドβ量や蓄積に積極的に関与していることが明らかとなり、神経が失われていくアルツハイマー病脳において残存しているアストロサイトを上手く活用する新しい可能性が提示されました。またアストロサイトにおけるKLK7発現量を制御するメカニズムとしてアミロイドβそのものやグルタミン酸シグナルを同定したことから、その細胞内シグナル伝達機構を解明することで新規治療薬・予防法の開発につながることが期待されます(図3)。
なお本研究は東京大学大学院医学系研究科、第一三共株式会社、新潟大学脳研究所、理化学研究所脳科学総合研究センターとの共同研究で行われました。また本研究は日本学術振興会・科学研究費補助金、文部科学省・科学研究費補助金、日本医療研究開発機構(AMED)・脳科学研究戦略推進プログラム、第一三共生命科学研究振興財団、小野医学研究財団、武田科学振興財団、細胞科学研究財団による支援のもとに実施されました。
発表雑誌
- 雑誌名:
- EMBO Molecular Medicine
- 論文タイトル:
- Loss of kallikrein-related peptidase 7 exacerbates amyloid pathology in Alzheimer disease model mice
- 著者:
- Kiwami Kidana, Takuya Tatebe, Kaori Ito, Norikazu Hara, Akiyoshi Kakita, Takashi Saito, Sho Takatori, Yasuyoshi Ouchi, Takeshi Ikeuchi, Mitsuhiro Makino, Takaomi C. Saido, Masahiro Akishita, Takeshi Iwatsubo, Yukiko Hori and Taisuke Tomita*
- DOI番号:
- 10.15252/emmm.201708184
- アブストラクトURL:
- http://embomolmed.embopress.org/cgi/doi/10.15252/emmm.201708184
問い合わせ先
研究に関すること
東京大学大学院薬学系研究科医療薬学専攻
教授 富田 泰輔(とみた たいすけ)
AMED事業に関すること
日本医療研究開発機構 脳と心の研究課
〒100-0004 東京都千代田区大手町1-7-1
用語解説
- 注1. アミロイドβ
- 40個前後のアミノ酸からなる小さなペプチドで通常は水に溶けていますが、アルツハイマー病患者脳においては異常凝集し、老人斑として蓄積しています。家族性アルツハイマー病原因遺伝子変異はほぼ全てアミロイドβの産生量や凝集性を増加させること、一方で認知機能が正常な高齢長寿者において見出された遺伝子変異では産生量が低下することなどから、その脳内濃度の上昇がアルツハイマー病発症を引き起こすことが示唆されています。
- 注2. グリア細胞
- 神経系を構成する細胞のうち、非神経細胞の総称です。ヒトの脳では神経細胞の十倍以上存在することが示唆されています。これまでは神経系における恒常性維持などに関わっていることが示されていましたが、近年グリア細胞も様々なシグナル伝達や脳機能に関わっていることが明らかとなり、注目されています。
- 注3. アストロサイト
- 星状膠細胞とも呼ばれ、星型の形態をとることが知られています。神経細胞同士を構造的に支える支持細胞としての役割を果たすと同時に、神経細胞間シナプスにおいては神経細胞と協調して各種神経伝達物質の放出や取り込みに関わります。また脳の血管に対して突起を延ばし、血液脳関門を構成しています。
- 注4. グルタミン酸シグナル
- グルタミン酸は興奮性神経伝達物質の一つであり、記憶や学習など脳の高次機能に重要であると考えられています。グルタミン酸受容体にはNMDA型、AMPA型、カイニン酸型、代謝型受容体の四種類が知られ、神経細胞同士のシナプス部に多く発現しています。そのシグナル伝達は神経細胞においては興奮性シナプス伝達に直接寄与することが知られていますが、アストロサイトにおける分子機構や意義については不明な点が多く残されています。
- 注5. タウ
- 細胞内の微小管に結合し安定化するタンパク質です。アルツハイマー病患者脳では神経細胞内に過剰なリン酸化を受けた状態で異常凝集し、神経原線維変化として蓄積しています。タウの蓄積はアミロイドβの蓄積によって促進され、神経細胞の機能障害や神経細胞死の原因となっていることが示唆されています。
- 注6. プロテアーゼ
- タンパク質のペプチド結合を切断し、タンパク質やペプチドを加水分解する酵素を指します。
- 注7. メマンチン
- メマンチンはNMDA受容体と結合し、そのシグナル伝達を阻害する作用を示します。神経細胞の過剰な興奮を抑制し、神経細胞死を抑制する効果が認められており、中等度から重度のアルツハイマー病型認知症の治療薬として使用されています。
添付資料
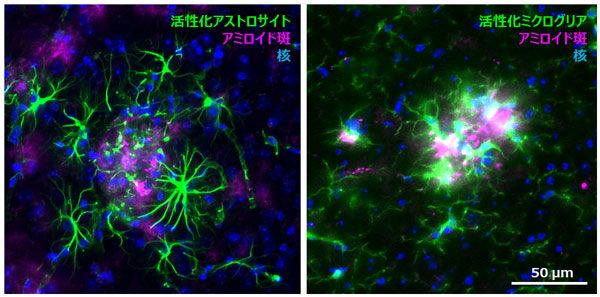
図1 アミロイド斑周囲におけるグリア細胞の異常活性化
アルツハイマー病モデルマウス脳において蓄積したアミロイドの周囲では、グリア細胞(アストロサイト、ミクログリア)の異常活性化が観察される。
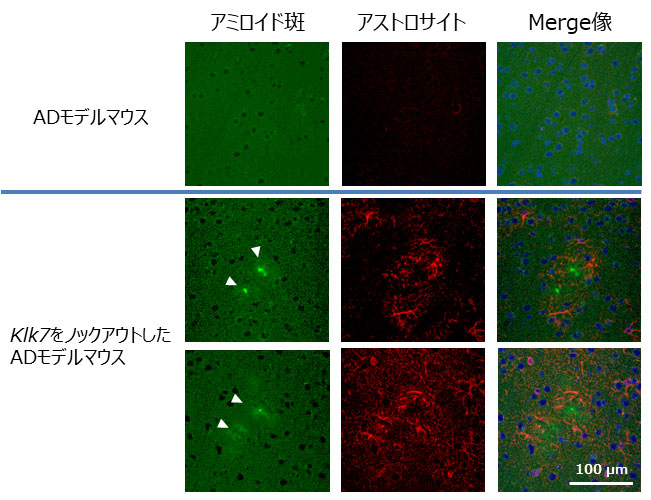
図2 Klk7ノックアウトによるアミロイド蓄積病態の悪化
Klk7を遺伝子ノックアウトしたアルツハイマー病モデルマウスでは、アミロイド斑の蓄積が亢進し、アストロサイトの異常活性化が認められる。
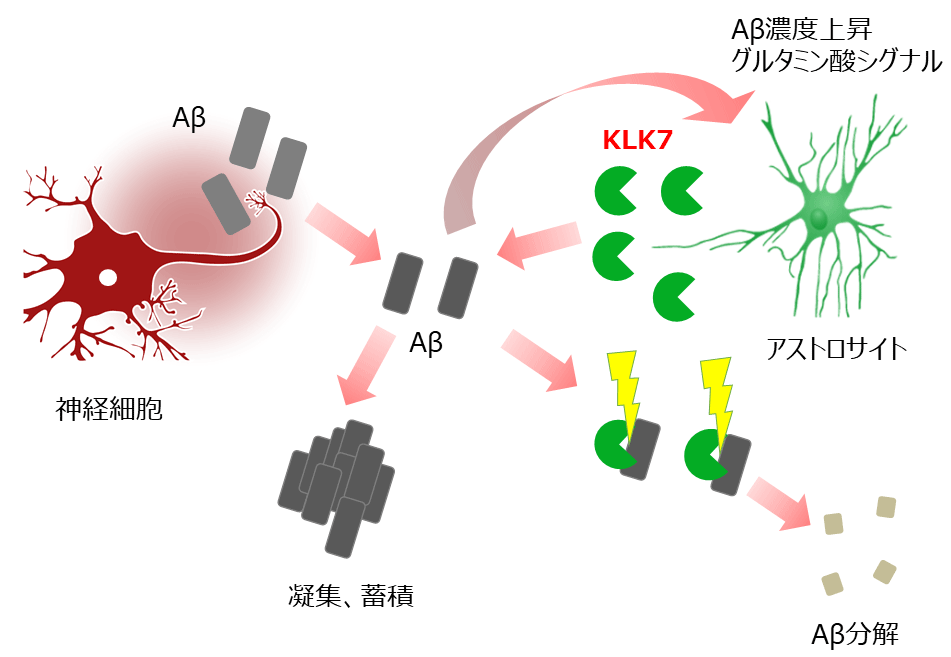
図3 本研究のまとめ
神経細胞で産生、分泌されたアミロイドβは細胞外に分泌される。その濃度が上昇すると凝集、蓄積してアルツハイマー病を引き起こす。アストロサイトは細胞外アミロイドβの量を感知する、もしくはグルタミン酸シグナルが抑制されるとアミロイドβ分解酵素KLK7を分泌する。