疲弊した免疫を回復する新規抗がん剤の開発に期待
2019-03-14 慶應義塾大学,日本医療研究開発機構
慶應義塾大学医学部微生物学・免疫学教室の吉村昭彦教授とアメリカ合衆国ラホヤ免疫アレルギー研究所のAnjana Rao教授らのグループは、マウスモデルを用いて、腫瘍内の免疫細胞(T細胞)を疲弊化する分子メカニズムを解明し、これを阻害することでより効果的ながん治療へ応用できることを証明しました。
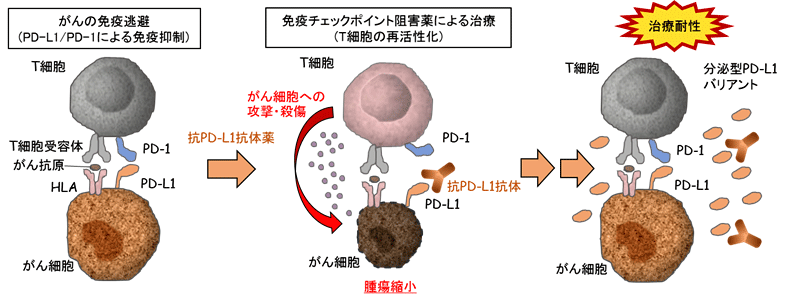
近年、オプジーボ(抗PD-1抗体)などのがん免疫療法が注目を集めています。免疫チェックポイント(注1)とは、主にT細胞に発現して過剰な免疫応答を抑制するシステムです。抗PD-1抗体は免疫チェックポイントを阻害してT細胞の活性化を亢進することでがんへの攻撃力を強めます。しかし、がん組織に集積しているT細胞の多くは何度も刺激を受けることで複数の免疫チェックポイント分子を高度に発現するために『疲弊』(注2)(図1参照)と呼ばれる機能不全状態に陥ることが知られています。完全に疲弊化に陥ったT細胞は、もはや抗PD-1抗体では再活性化することはできず、がん免疫療法の効果を著しく損なうと考えられています。
これまで、T細胞の疲弊化を生み出す分子メカニズムは全く不明でした。研究グループは疲弊化によって特異的に発現するNr4aという転写因子に注目しました。今回、本グループはNr4aがPD-1遺伝子のエンハンサーと呼ばれる領域(注3)に結合し、PD-1の発現を増大し安定化させることを発見しました。Nr4a遺伝子を欠損させることでT細胞は疲弊に陥ることなく長く活性化されました。さらに、マウス腫瘍モデルに野生型T細胞を投与しても90日後にはすべてがんによって死亡しましたが、Nr4aを欠損したT細胞を投与した場合は70%以上が生存しました。すなわち転写因子Nr4aが腫瘍内に集積するT細胞の『疲弊化』に中心的な役割を果たし、抗腫瘍効果に決定的に重要であることが明らかとなりました。Nr4a阻害剤の開発が効果的ながん免疫療法につながると期待されます。
本研究成果は2019年2月27日(グリニッジ標準時)に英科学雑誌『Nature』のオンライン速報版に公開されます。
研究のポイント
- 『疲弊化』したT細胞(注2)ではPD-1遺伝子のエンハンサー(注3)に転写因子Nr4aの結合がみられる。
- Nr4aを欠損させたT細胞は『疲弊化』しにくく、強い抗腫瘍活性を有する。
- Nr4a阻害剤はがん免疫を増強し抗腫瘍効果が期待できる。
研究の背景と概要
(1)背景
免疫細胞、特にT細胞は体内でウイルスや細菌などの病原体だけでなく、異常ながん細胞を排除するために非常に重要な細胞です。最近、抗PD-1抗体(オプジーボなど)のような薬剤で免疫チェックポイント (注1)を阻害することが、ある種のがん治療に有効であることに注目が集まっています。また、がん患者の腫瘍組織などから分離したがんに特異的なT細胞を試験管内で大量培養し、患者へ再び戻す細胞移入(投与)療法もきわめて有用な治療法であると考えられています。しかしながら、がん組織や試験管内で何度も刺激を受けることで、T細胞は『疲弊』と呼ばれる機能不全状態に陥ってしまいます。これが、がん免疫療法の治療効果を減弱させる要因のひとつであると考えられています。一旦疲弊状態に陥ったT細胞は、患者体内に戻してもがん細胞を攻撃する力が弱く、十分な治療効果を得ることができないと考えられています。
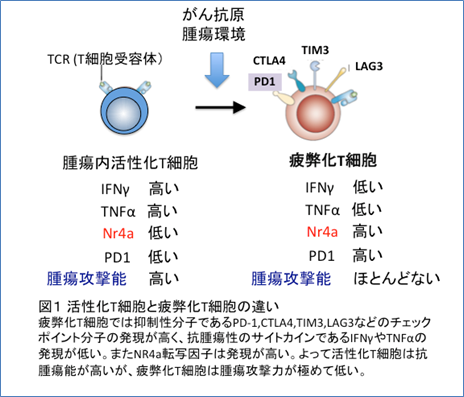
『疲弊』したT細胞の特徴は、PD-1やTim3といったT細胞の活性化を抑制する複数のチェックポイント分子を細胞表面に高度に発現することと、インターフェロン(IFN)γや腫瘍壊死因子(TNF)αといった抗腫瘍性サイトカイン (注4)の産生が低下することです(図1)。このような『疲弊』に陥ったT細胞にはもはや抗PD-1抗体は効果が無く、この状態から回復させることは難しいと考えられてきました。
しかし、T細胞の『疲弊』に関する分子機構はこれまで十分理解されていませんでした。効果的ながん免疫療法を確立するために、T細胞疲弊を起こすメカニズムを解明し『疲弊』を解除する方法を開発することが求められてきました。
(2)概要
T細胞の疲弊化は腫瘍を攻撃する力を弱め、がん免疫療法での大きな障害となると考えられています。研究グループはマウス腫瘍モデルを用いて、腫瘍内で疲弊化してしまったT細胞に特徴的な遺伝子の発現調節領域の性質を解析しました。その結果、疲弊化T細胞で発現が上昇する多くの遺伝子の調節領域には、Nr4a転写因子が結合するDNA配列が認められることが分かりました。特にPD-1遺伝子については、遺伝子の上流の領域にPD-1の発現を安定化させるエンハンサー (注3)と呼ばれる領域があり、ここにNr4aが結合し、転写効率をあげることが分かりました。Nr4aには3つの類似遺伝子があり、どれも似た機能があることが知られています。今回、腫瘍に集積する疲弊化したT細胞ではこの3つすべての遺伝子の発現が高まっていることが分かりました。また、刺激を受けていないT細胞にそれぞれのNr4a遺伝子を強制的に発現させると、疲弊したT細胞に似た特徴的な変化を誘導できることが分かりました。
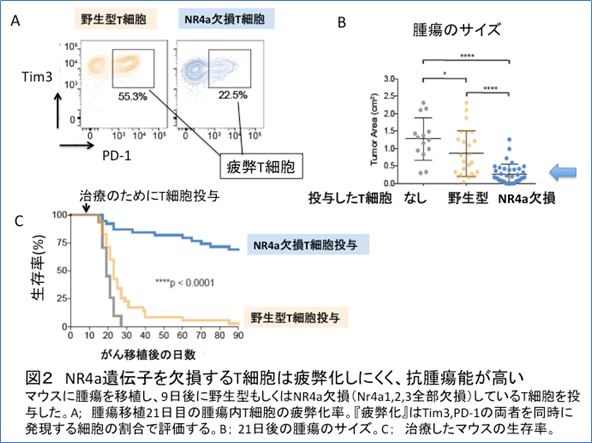
次に3つのNr4a遺伝子をすべて欠損するT細胞を用いて腫瘍マウスへの細胞移入実験を行いました。図2Aで示されるように、細胞表面のマーカーで評価したところ、通常のT細胞は腫瘍内で50%以上が疲弊化しましたが、Nr4a遺伝子をすべて欠損するT細胞では疲弊化はその半分以下でした。T細胞移入療法として、腫瘍に特異的なT細胞を腫瘍モデルマウスに投与すると、野生型T細胞でも若干の腫瘍の退縮効果はみられるものの(図2B)、延命効果は乏しくT細胞を投与して90日後には全例死亡しました(図2C)。しかし、Nr4a遺伝子を欠損するT細胞では腫瘍の退縮効果が強く、投与90日後でも70%以上のマウスが生存していました(図2B、2C)。すなわちNr4aがT細胞の『疲弊』にとって極めて重要な遺伝子であること、これを取り除くことで強力な抗がん作用が得られることが分かりました。
研究成果の意義と今後の展開
研究グループは先行研究で、Nr4a遺伝子が免疫を抑制する制御性T細胞 (注5)を生み出す重要な遺伝子であることを報告してきました(参考文献1)。さらに、Nr4aの活性を抑制する薬剤のスクリーニングを行い、カンプトテシン(CPT-11、イリノテカン)という抗がん剤がNr4aの転写活性を阻害することを発見し、さらにマウス腫瘍モデルにカンプトテシンを投与したところ、腫瘍攻撃性のT細胞を増やし腫瘍保護的な抑制性T細胞を減少させることを報告しています(参考文献2)。また、別のグループからはカンプトテシンと免疫チェックポイント阻害剤を併用すると抗がん効果が増強されることが報告されています(参考文献3)。これらの結果から、Nr4aを標的とする阻害剤はがん治療の新たな標的になりうることが示されました。
本研究成果は、T細胞疲弊の分子機構を解明したもので、この機構を阻害することでより効果的ながん治療法の開発につながるものと期待されます。次の課題は、実際にヒト腫瘍内のT細胞で同様の機構が認められるか、Nr4a阻害剤がヒト腫瘍でも効果があるかを確かめることです。カンプトテシン(イリノテカン)は多くのヒトのがんで使用されており免疫細胞を活性化することが報告されていることからも、今回発見されたメカニズムがヒトのがんにも共通したものであることが示唆されています。今後、Nr4aを標的とする特異的阻害剤が開発されれば、抗腫瘍効果をより高める新たながん治療薬となることが期待されます。
特記事項
本研究は、以下の事業・研究開発領域・研究開発課題の一環で行われました。
- 国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業
- ①研究開発領域名:「エピゲノム研究に基づく診断・治療へ向けた新技術の創出」
研究開発課題名:「T細胞のエピジェネティク改変による免疫疾患制御」
(研究開発代表者:吉村 昭彦)
謝辞用課題番号:JP18gm0510019
※本研究開発領域は、2015年4月の日本医療研究開発機構の発足に伴い、国立研究開発法人科学技術振興機構(JST)より移管されたものです。 - ②研究開発領域名:「全ライフコースを対象とした個体の機能低下機構の解明」
研究開発課題名:「T細胞の老化、疲弊による生体機能不全とその解除方法の開発」
(研究開発代表者:吉村 昭彦)
謝辞用課題番号:JP18gm1110009
論文
- 英文タイトル:
- Nr4a transcription factors limit CAR T cell function in solid tumors
- タイトル和訳:
- Nr4a転写因子は固形がんにおけるCAR-T療法を抑制する
- 著者名:
- Joyce Chen, Isaac F. López-Moyado, Hyungseok Seo, Chan-Wang J. Lio, Laura J. Hempleman, Takashi Sekiya, Akihiko Yoshimura, James P. Scott-Browne, & Anjana Rao
- 掲載誌:
- 「Nature」オンライン速報版
参考文献
- Nr4a receptors are essential for thymic regulatory T cell development and immune
homeostasis.
Sekiya T, Kashiwagi I, Yoshida R, Fukaya T, Morita R, Kimura A, Ichinose H, Metzger D, Chambon P, Yoshimura A.
Nat Immunol. 2013 Mar;14(3):230-7. - Inhibition of Nr4a Receptors Enhances Antitumor Immunity by Breaking Treg-Mediated Immune Tolerance.
Hibino S, Chikuma S, Kondo T, Ito M, Nakatsukasa H, Omata-Mise S, Yoshimura A.
Cancer Res. 2018 Jun 1;78(11):3027-3040. - Topoisomerase I inhibitor, irinotecan, depletes regulatory T cells and up-regulates MHC class I and PD-L1 expression, resulting in a supra-additive antitumor effect when combined with anti-PD-L1 antibodies.
Iwai T, Sugimoto M, Wakita D, Yorozu K, Kurasawa M, Yamamoto K.
Oncotarget. 2018 Jul 31;9(59):31411-31421.
用語解説
- (注1)免疫チェックポイント:
- 人間の体内では免疫系が病原体に感染した細胞やがん細胞を攻撃し、排除する。その一方で免疫機構には適正に免疫反応を終息させ正常な組織を攻撃しないように、過剰な応答を抑えるシステムが存在する。がん細胞は免疫細胞の攻撃から逃れるために、このシステムを悪用して免疫応答にブレーキをかける。免疫チェックポイントと呼ばれるたんぱく質は、このようなブレーキの役割を果たしており、その代表的なものがPD-1やCTLA4であるが、それ以外にも多数存在する。免疫チェックポイント分子は若い免疫細胞では発現しておらず、刺激を受け続けて疲弊化すると増加する。 PD-1やCTLA4の機能を抗体により阻害することで腫瘍内の免疫反応を増強するのが免疫チェックポイント阻害剤である。抗PD-1抗体の代表的なものがオプジーボであり、 昨年発見者の本庶佑教授がノーベル医学生理学賞を受賞した。
- (注2)T細胞の疲弊:
- T細胞は慢性的に活性化され続けると多数の免疫チェックポイント分子を高度に発現し、増殖できなくなったり、標的細胞を攻撃できなくなったりする。この現象を疲弊化という。疲弊状態に陥ったT細胞は、生体内に戻しても増殖能力やがんを攻撃する能力が弱く、高い治療効果を期待できない。免疫チェックポイント阻害剤は主に疲弊に陥る前段階のT細胞を再活性化するもので完全に疲弊したT細胞には効果が少ないことが知られている。
- (注3)エンハンサー:
- 遺伝子調節タンパク質(転写因子)と結合することで遺伝子の発現を調節するDNA上の特定の領域。mRNA合成(転写)を直接推進するプロモーターと呼ばれる領域と協同して作用を発現する。プロモーターは、通常遺伝子の上流に隣接して存在しているのに対して、エンハンサーは、遺伝子の上流、下流あるいは内部に存在する。時には遺伝子から遠く離れた場所に存在する。
- (注4)サイトカイン:
- 細胞から放出されるたんぱく質。免疫の調整、免疫応答の制御、炎症を引き起こすなど免疫系において多彩で重要な役割を持つ。T細胞が産生する抗がん作用をもつサイトカインとしてはインターフェロン(IFN)γや腫瘍壊死因子(TNF)αが重要である。
- (注5)制御性T細胞:
- 抗炎症性に作用し、過剰な免疫反応を抑制する機能を持つT細胞の一種。がん免疫においてはがん免疫を抑制するために腫瘍保護的に働く。
お問い合わせ先
本発表資料のお問い合わせ先
慶應義塾大学医学部
微生物学・免疫学教室
教授 吉村 昭彦(ヨシムラ アキヒコ)
本資料の発信元
慶應義塾大学
信濃町キャンパス総務課:鈴木・山崎
AMED事業に関するお問い合わせ先
国立研究開発法人 日本医療研究開発機構
基盤研究事業部 研究企画課