細胞培養ワクチンへの応用
2019-04-30 東京大学 医科学研究所,日本医療研究開発機構(AMED)
発表者
河岡 義裕(東京大学医科学研究所 感染・免疫部門ウイルス感染分野 教授)
発表のポイント
- インフルエンザウイルスの分離に広く利用されているMDCK細胞(注1)を用いて季節性インフルエンザウイルス(注2)を分離培養すると、変異が入り、その性状が変化するという問題があった。
- 変異が入ることなく季節性インフルエンザウイルスを効率よく分離培養できる培養細胞株hCKの開発に成功した。
- hCK細胞で分離培養した季節性インフルエンザウイルスを分析することで、ヒトの間で流行しているウイルスの性状変化を高い精度で監視することが可能になる。さらに、同細胞をワクチン製造に利用することで、培養細胞ワクチンを効率よく生産することが可能になる。
発表概要
東京大学医科学研究所ウイルス感染分野の河岡教授らは、変異が入ることなく季節性インフルエンザウイルスを効率よく分離培養できる培養細胞株の開発に成功しました。
季節性ウイルスは性状が頻繁に変わります。性状解析には臨床検体からのウイルス分離が不可欠ですが、インフルエンザウイルスの分離に広く利用されているMDCK細胞を用いて季節性ウイルスを分離培養すると、変異が入り性状が変化してしまうという問題がありました。
本研究グループは、MDCK細胞の遺伝子を改変することで、変異が入ることなく季節性ウイルスを効率よく分離培養できる培養細胞株hCKを開発しました。季節性ウイルスの一つであるA/H3N2流行株のhCK細胞における分離と増殖効率は、MDCKとAX4(注3)細胞に比べて顕著に高いことがわかりました。hCK細胞で分離したA/H3N2流行株の遺伝子には変異がほぼ認められなかったのに対し、MDCKとAX4細胞で分離した流行株には高い頻度で変異が見つかりました。さらに、A/H3N2流行株をhCK細胞で長期間継代しても変異が入らないこともわかりました。
本研究の成果によって、ヒトの間で流行している季節性インフルエンザウイルスの性状変化をより高い精度で監視することが可能になります。さらに、hCK細胞をワクチン製造に利用することで、従来の鶏卵ワクチンに比べ高い有効性が期待できる培養細胞ワクチン(注4)をより迅速に製造供給することが可能になります。
本研究成果は、2019年4月29日(米国東部夏時間 午前11時)、英国科学雑誌「Nature Microbiology」のオンライン速報版で公開されます。
なお本研究は、東京大学、横浜市衛生研究所、米国ウィスコンシン大学が共同で行ったものです。本研究成果は、日本医療研究開発機構(AMED)(平成27年度以降)革新的先端研究開発支援事業「インフルエンザ制圧を目指した革新的治療・予防法の研究・開発」、文部科学省新学術領域研究などの一環として得られました。
発表内容
①研究の背景・先行研究における問題点
冬季にヒトの間で流行する季節性インフルエンザウイルスは、その性状が頻繁に変わります。中でも季節性A/H3N2ウイルスは、A/H1N1pdmやB型ウイルスに比べて抗原性が変化しやすいため流行頻度が高く、時に大規模な流行を引き起こすことがあります。また、A/H3N2ウイルス感染は、入院やインフルエンザに関連した死亡の原因となることがあります。世界各国のサーベイランス機関は、毎冬流行する季節性ウイルスの抗原性状や抗インフルエンザ薬に対する感受性を把握し、その性状変化を監視するために、毎年膨大な数のウイルス株を分析しています。
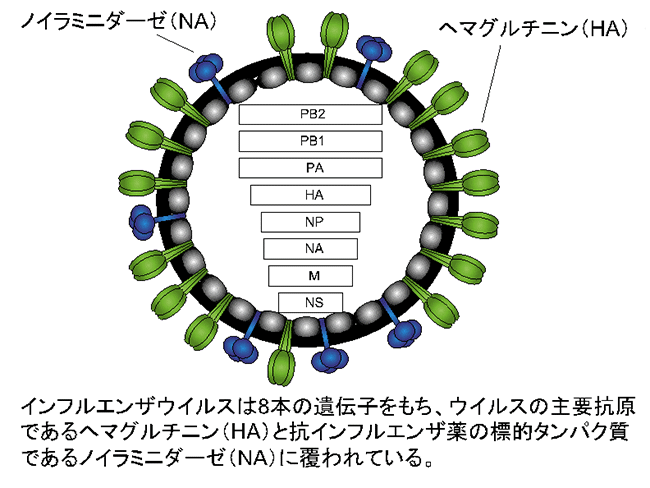
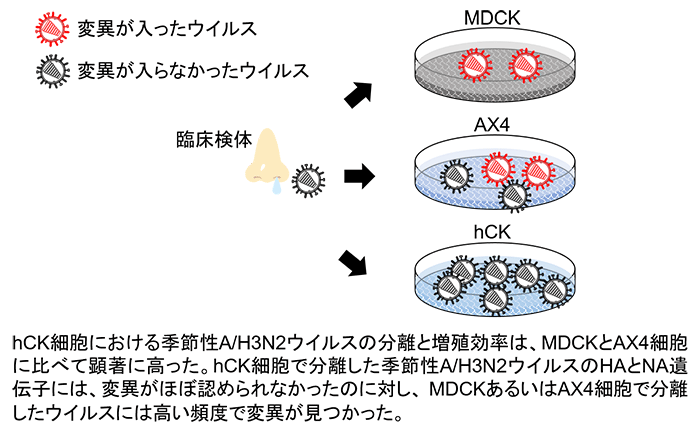
季節性ウイルス流行株の性状解析には、臨床検体からのウイルス分離が不可欠です。インフルエンザウイルスの分離培養にはイヌの腎臓由来であるMDCK細胞が広く使用されていますが、最近の季節性A/H3N2ウイルスはMDCK細胞ではよく増えないこと、さらに、同細胞でA/H3N2ウイルスを分離培養すると、ウイルスの主要抗原であるヘマグルチニン(HA、図1)や抗インフルエンザ薬の標的タンパク質であるノイラミニダーゼ(NA、図1)に変異が生じることが明らかにされています。したがって、このようなMDCK細胞への馴化に関わる変異をもったウイルスでは、正確に性状を分析することはできません。そのため、変異が入ることなく季節性ウイルス流行株を効率よく分離培養できる培養細胞株の開発が望まれています。
②研究内容
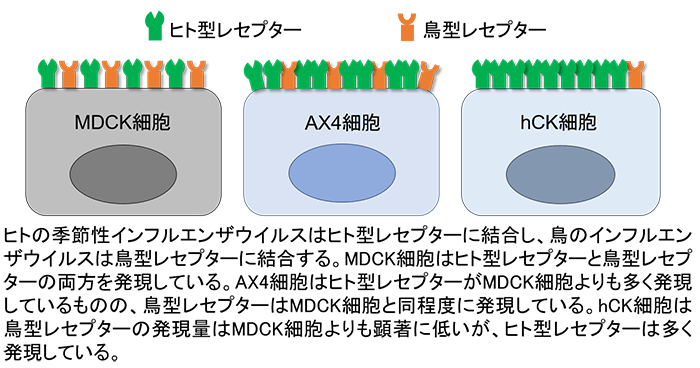
インフルエンザウイルスは、宿主細胞表面上のウイルス受容体(レセプター)に結合することで感染を開始します。ヒトの季節性インフルエンザウイルスはヒト型レセプターに、鳥のインフルエンザウイルスは鳥型レセプターにそれぞれ結合します。MDCK細胞はヒト型レセプターと鳥型レセプターの両方を発現しています。しかし、季節性ウイルスが感染増殖するヒト上気道では、ヒト型レセプターが主に発現していることがわかっています。そこで本研究グループはMDCK細胞における季節性ウイルスの増殖性を向上させるため、MDCK細胞の鳥型レセプター関連遺伝子に変異を導入し、さらにヒト型レセプター関連遺伝子を発現するプラスミド(注5)を導入したヒト化MDCK(hCK)細胞を作出しました。
はじめに、このヒト上気道のレセプター発現パターンを模範したhCK細胞におけるレセプター発現量を解析しました。その結果、hCK細胞は鳥型レセプターの発現量は元のMDCK細胞よりも顕著に低いが、ヒト型レセプターの発現量は高いことがわかりました(図2)。次に、hCK細胞の季節性ウイルス(A/H1N1pdm、A/H3N2、B型)感染に対する感受性をMDCK並びにAX4細胞と比較しました。hCK細胞におけるA/H1N1pdmとB型流行株の分離と増殖効率は、MDCK及びAX4細胞とほぼ同程度でした。しかし、A/H3N2流行株の分離と増殖効率は、MDCKとAX4細胞に比べて顕著に高いことがわかりました。hCK細胞で分離したA/H3N2流行株のHAとNA遺伝子には、変異がほぼ認められなかったのに対し、MDCKあるいはAX4細胞で分離した流行株には高い頻度で変異が見つかりました(図3)。また、A/H3N2流行株をhCK細胞で長期間継代しても変異が入らないこともわかりました。
③社会的意義・今後の予定 など
本研究で開発したhCK細胞で分離培養した季節性ウイルスを用いることによって、その抗原性状や抗インフルエンザ薬に対する感受性を正確に分析することが可能になります。すなわち、ヒトの間で流行しているウイルスの性状変化をより高い精度で監視することが可能になります。この成果は、季節性インフルエンザの流行拡大阻止や発症・重症化予防に貢献すると期待されます。
本研究グループは、臨床検体からの季節性ウイルス分離用細胞として、国立感染症研究所にhCK細胞を分与しました。本活動は、我が国のインフルエンザ対策の根幹をなすウイルス株サーベイランスに大きく貢献することが期待されます。
国内のワクチン製造会社は、培養細胞ワクチンの実用化に向けて準備を進めていますが、現状ではMDCK細胞におけるウイルスの増殖能の低さが原因で十分な供給量を確保できず苦慮しています。今回開発したhCK細胞を用いてワクチンを製造することで、十分な量の季節性インフルエンザワクチンを、より安価に供給することが可能になると期待されます。
発表雑誌
- 雑誌名:
- 「Nature Microbiology」4月29日オンライン版
- 論文タイトル:
- A humanized MDCK cell line for the efficient isolation and propagation of human influenza viruses
- 著者:
- 河岡義裕
- DOI番号:
- 10.1038/s41564-019-0433-6
用語解説
- (注1)MDCK細胞
- イヌ腎臓上皮細胞株Madin-Darby canine kidney cellの略称。
- (注2)季節性インフルエンザウイルス
- 2009年に出現したブタ由来ウイルス(A/H1N1pdm)の大流行に伴い、それまで流行していたソ連型ウイルス(A/H1N1)が消滅した。2019年4月現在、A/H1N1pdm、香港型A/H3N2、B型の3種類が季節性ウイルスとして流行している。
- (注3)AX4細胞
- 本研究グループが以前開発したヒト型レセプター関連遺伝子を発現するプラスミドを導入したMDCK細胞。AX4細胞はヒト型レセプターの発現量はMDCK細胞よりも高いものの、鳥型レセプターはMDCK細胞と同程度に発現している。
- (注4)細胞培養ワクチン
- 季節性インフルエンザワクチンは発育鶏卵で増やしたウイルスから製造されているが、鶏卵で季節性ウイルスを増やすとHAに変異が入り、その抗原性が大きく変化してしまう。ワクチン製造を培養細胞で行うことにより、卵馴化による抗原変異のリスクを軽減させることは可能であるが、季節性ウイルスは培養細胞での増殖能が低いことから、細胞培養ワクチンの生産性の低さが大きな問題となっている。
- (注5)プラスミド
- 細菌や酵母がもつ染色体DNAとは異なる独立した環状のDNA分子。目的遺伝子のDNA断片を組込んだプラスミドを培養細胞に導入すると、目的遺伝子が細胞内で強制的に発現される。
添付資料
問い合わせ先
研究に関するお問い合わせ
東京大学医科学研究所 感染・免疫部門ウイルス感染分野
教授 河岡 義裕(カワオカ ヨシヒロ)
報道に関するお問い合わせ
東京大学医科学研究所 管理課総務チーム
AMEDの事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構(AMED)
創薬戦略部 医薬品研究課 革新的先端研究開発支援事業(インキュベートタイプ)担当