2019-10-02 東京大学 先端科学技術研究センター
1.発表者:
大澤 毅(東京大学先端科学技術研究センター ニュートリオミクス・腫瘍学分野 特任准教授)
島村 徹平(名古屋大学大学院医学系研究科 システム生物学分野 教授)
曽我 朋義(慶応大学先端生命科学研究所 教授)
児玉 龍彦(東京大学名誉教授)
2.発表のポイント:
- 低栄養状態のがん組織において、栄養飢餓の中でも特にグルタミン(注1)の欠乏が、がんの悪性化に関わることがわかりました。
- がん細胞がグルタミンの欠乏に対して特異的にがん代謝物(オンコメタボライト)を蓄積して飢餓耐性を獲得するメカニズムとともに、ある特定のがん代謝物が患者予後に相関することを明らかにしました。
- 本成果はグルタミン代謝異常をはじめとする栄養学の視点から、新たながん治療法の確立の必要性を強く示唆するものです。
3.発表概要:
固形がんでは、不完全な血管構築や血流不全から引き起こされる低酸素、低栄養、低pHなどの腫瘍微小環境が、エピゲノム変化、エネルギー代謝変動、転移・浸潤能などを促進し、がんの悪性化や治療抵抗性、再発・転移などの予後不良に寄与することが知られています。しかしながら、酸素や栄養の供給が不足した環境に適応したがん細胞に特異的な代謝経路はこれまで明らかにされていませんでした。東京大学先端科学技術研究センターの大澤毅特任准教授、児玉龍彦名誉教授(がん代謝プロジェクトリーダー)、名古屋大学の島村徹平教授、慶応大学の曽我朋義教授らの研究グループは、低栄養状態のがん組織において、グルタミン欠乏に応答して細胞膜合成を調節する代謝酵素であるPCYT2(注2)の発現が低下し、細胞膜リン脂質(PE)合成経路(注3)の中間代謝物であるエタノールアミンリン酸(PEtn)(注4)ががん細胞内に蓄積することによって、がん細胞が栄養飢餓に対して耐性を獲得するというメカニズムを明らかにしました。本研究成果は、2019年10月1日午前11時(米国東部夏時間)に電子ジャーナル「Cell Reports」に掲載されました。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)「革新がん医療実用化事業」と文部科学省科学研究費補助金などの支援を得て行われました。
4.発表内容:
本研究グループは、これまで固形がんの中心部が低酸素・低栄養・低pHに陥りやすく、この特徴的な腫瘍(がん)の微小環境が、がん細胞のエピゲノム変化、エネルギー代謝変動、転移・浸潤能などを促進し、がんの悪性化や治療抵抗性など予後不良に寄与することを報告してきました。本研究では、栄養飢餓中のアミノ酸欠乏状態におけるがん細胞の代謝変動を予測するために、栄養飢餓状態を模した培養系を用いて、がん細胞に対しトランスクリプトーム(注5)およびメタボローム(注6)の網羅的オミクス統合解析(注7)を行いました。これらの解析結果から、がん細胞がグルタミン欠乏に特異的に、がん代謝物(オンコメタボライト)であるエタノールアミンリン酸を蓄積することを見出しました。さらに、培養細胞と実験用マウスを用いた解析から、グルタミン欠乏に応答してPE合成経路の律速酵素であるPCYT2の発現が低下することを突き止めました。
これらの結果より、低栄養状態のがん組織は、PE合成経路の中間代謝物であるエタノールアミンリン酸をがん細胞内に蓄積することにより、栄養飢餓に対する耐性を獲得し、患者予後に関与することがわかりました(図)。
本研究は、栄養飢餓の中でも特にグルタミン欠乏が、がんの悪性化に関わることを初めて示唆するものです。近年、がん研究においてアミノ酸代謝異常の重要性が注目されていますが、本研究成果によって、グルタミン代謝異常をはじめとする栄養学の視点から、新たながん治療法を確立する必要性が強く示されました。
5.発表雑誌:
雑誌名:Cell Reports
論文タイトル:Phosphoethanolamine Accumulation Protects Cancer Cells under Glutamine Starvation through Downregulation of PCYT2
著者:Tsuyoshi Osawa, Teppei Shimamura, Kyoko Saito, Yoko Hasegawa, Naoko Ishii, Miyuki Nishida, Ritsuko Ando, Ayano Kondo, Muyassar Anwar, Rika Tsuchida, Shinjiro Hino, Akihisa Sakamoto, Kaori Igarashi, Kaori Saitoh, Keiko Kato, Keiko Endo, Shotaro Yamano, Yasuharu Kanki, Yoshihiro Matsumura, Takashi Minami, Toshiya Tanaka, Motonobu Anai, Yoichiro Wada, Hideki Wanibuchi, Mitsuhiro Hayashi, Akinobu Hamada, Masayuki Yoshida, Shinichi Yachida, Mitsuyoshi Nakao, Juro Sakai, Hiroyuki Aburatani, Masabumi Shibuya, Kentaro Hanada, Satoru Miyano, Tomoyoshi Soga and Tatsuhiko Kodama
DOI番号:10.1016/j.celrep.2019.08.087
アブストラクトURL https://www.cell.com/cell-reports/fulltext/S2211-1247(19)31149-0
6.問い合わせ先:
<研究について>
東京大学先端科学技術研究センター ニュートリオミクス・腫瘍学分野
特任准教授 大澤 毅(おおさわ つよし)
<AMED事業について>
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 がん研究課
7.用語解説:
(注1)グルタミン:
グルタミンはアミノ酸の一種で、側鎖にアミドを有し、グルタミン酸のヒドロキシ基をアミノ基に置き換えた構造をもつ。
(注2)PCYT2:
ホスファチジルエタノールアミンとプラスマロゲン生合成を調節する代謝酵素。
(注3)細胞膜リン脂質(PE)合成経路:
細胞膜リン脂質(ホスファチジルエタノールアミン)の生合成経路。
(注4)エタノールアミンリン酸:
PE合成経路の中間代謝物。がん代謝物(オンコメタボライト)。
(注5)トランスクリプトーム:
特定の状況下での細胞内の全転写産物(全RNA)のこと。細胞内の全DNAの塩基配列情報であるゲノムは原則として同一個体内のすべての細胞で同一だが、トランスクリプトームは各細胞や条件で異なる。
(注6)メタボローム:
生物実験サンプル内の低分子化学物質や代謝物の総体を指す。
(注7)オミクス統合解析:
生体内の分子群(DNAやRNA、タンパク質、代謝物、脂質等)を網羅的に解析することで生命現象を包括的に調べる手法を『オミクス解析』と呼ぶ。このオミクス解析から得られた多階層の情報を統合して解析する方法。
8. 添付資料:
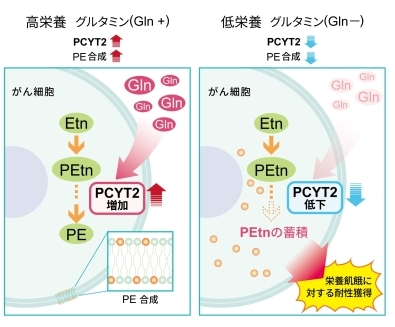
図:グルタミン欠乏におけるがん細胞の応答メカニズム。
(左)高栄養状態(グルタミン+)では、PCYT2の発現が上昇し(産生量が増加し)、PE合成経路が促進する。(右)一方、がん細胞がグルタミン欠乏に陥ると、PCYT2の発現が低下し(産生量が低下し)、エタノールアミンリン酸(PEtn、図中のオレンジ色の○)が細胞内に蓄積する。結果として、がん細胞が栄養飢餓に対する耐性を獲得し、がんの生存や進展に寄与する。