2019-10-08 千葉大学,富山大学,日本医療研究開発機構
千葉大学大学院医学研究院の平原潔准教授、中山俊憲教授らの研究グループは、富山大学医学部第一内科の市川智巳博士、戸邉一之教授らと共同で、カビの暴露によって肺に起こる組織の線維化(注1)を誘導する細胞集団を同定し、これまで不明とされていた組織線維化に至るメカニズムを明らかにしました。この研究成果は、2019年10月8日(日本時間)にNature Immunologyに掲載されました。なお、本研究は、日本医療研究開発機構の支援を受けて行われました。
本研究成果のポイント
- カビは、ヒトの生活環境のいたるところに生息しますが、通常は健康に害を及ぼしません。しかし、病気や加齢などで免疫力が低下している場合、様々な症状を引き起こすことが知られています。特に肺では、カビが原因で組織の線維化が起こり、息切れ・呼吸困難・長引く咳などの難治性の症状につながります。
- これまで、カビが肺の組織の線維化を起こす詳しいメカニズムは不明でした。本研究グループは、カビの暴露で線維化をおこした肺に「組織常在性記憶CD4 T細胞」という新たな細胞集団を同定しました。また、この「組織常在性記憶CD4 T細胞」が、組織線維化を引き起こす病原性の高い細胞集団と組織線維化を抑制する細胞からなることを見出しました。
- 今回新たに同定した「組織常在性記憶CD4 T細胞」集団のうち、病原性の高い細胞集団を治療標的とすることで、難治性の肺の組織線維化において有効な治療法を確立することが期待されます。
研究の背景
ヒトの生活環境に広く存在するカビは、学術的には真菌と呼ばれ、その一種類であるアスペルギルスは、病気の原因とはなりにくい菌として知られています。しかし、病気や加齢などにより免疫機能が低下した状態では、アスペルギルス フミガタスというカビを吸い込むことで、気管支喘息の重症化など、肺に様々な症状を引き起こします。医療の高度化や高齢化が進む現代では、真菌に伴う各種疾患の罹患者数は増加傾向にあります。また、アスペルギルス フミガタスによって肺に引き起こされる組織線維化は、既存の治療が効かないため、新たな治療法が求められています。
これまで、真菌感染などが原因で引き起こされる組織の線維化については、体の中の様々な細胞が複雑に関与しており、基礎研究が進んでおらず、詳細なメカニズムは不明のままでした。
本研究グループは、カビによる気道周囲の線維化がどのように起こるのか、その分子メカニズムを明らかにすることを目的に研究を行いました。
研究の成果
本研究グループは、カビによって誘導される肺組織の線維化を解析する目的で、ヒトで色々な肺の病気を引き起こすカビであるアスペルギルス フミガタスを用いて、マウスで肺の組織線維化が起こるモデルを作りました。カビを7週間に渡って暴露したマウスの肺では、正常(コントロール)のマウス肺と比べて、肺の中に炎症細胞が多数集まっており(図1 上段)、組織の線維化が進行していました(図1 下段)。
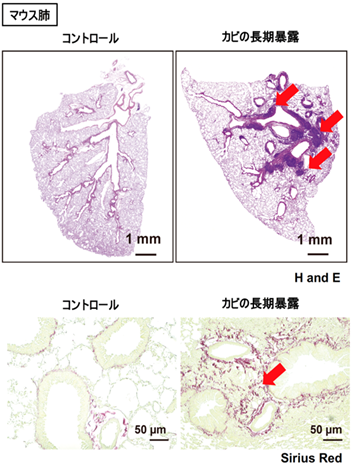
図1 アスペルギルス(カビ)の長期暴露で肺に炎症細胞の集積(上段)と線維化反応(下段)が誘導される
カビを長期間に渡って暴露したマウスの肺を詳しく解析したところ、新たな細胞集団やその構造が明らかになりました。まず第1に、体内を移動せず3ヶ月以上に渡って肺の組織中に住み続ける「組織常在性記憶CD4 T細胞」という特殊な細胞集団を同定しました。第2に、「組織常在性記憶CD4 T細胞」集団は、これまで知られてきた体内を循環するT細胞(ナイーブ T細胞、エフェクターメモリーT細胞)と比べて、線維化に関連する遺伝子が高発現していることがわかりました。第3に、「組織常在性記憶CD4 T細胞」はCD103という細胞表面マーカーで2つのサブグループにわかれることを明らかにしました。この中で、CD103陰性の「組織常在性記憶CD4 T細胞」(Tissue resident memory;Trm)は、線維化を誘導する様々な炎症性サイトカインという生理活性物質を多く産生していることがわかりました。一方で、CD103陽性の「CD4 Trm細胞」の中では、制御性T(regulatory T; Treg)細胞のマーカー転写因子であるFoxp3が高発現していることがわかりました。なお、Treg細胞は、生体内の過剰な炎症反応を抑制することが知られています(図2)。
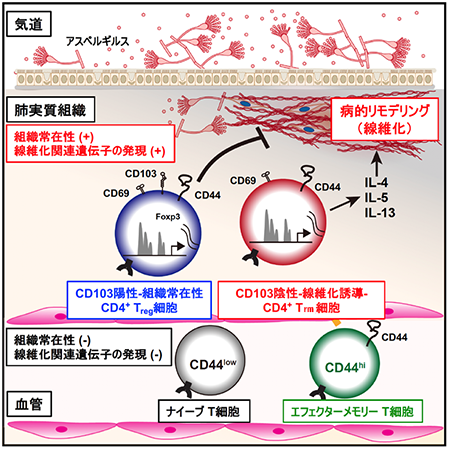
図2 アスペルギルスの長期暴露で誘導される組織常在性記憶CD4T細胞と肺の組織線維化
さらに別の実験で、「CD4 Trm細胞」が肺の線維化に関わっているのかを調べる目的で、特殊な化合物を使って、肺の中を「CD4 Trm細胞」だけの状態にしました。このような状態でも肺の強い線維化反応が起こりました。つまり、「CD4 Trm細胞」が肺の線維化を誘導することが判明しました。
最後に、CD103陰性の「CD4 Trm細胞」とCD103陽性の「組織常在性Treg細胞」がそれぞれ肺の線維化反応にどのように関わっているのかを解析しました。抗CD103抗体を使って、CD103陽性の「組織常在性Treg細胞」を肺内から除去した状態で、カビの暴露を行ったところ、マウス肺の線維化が著しく悪化しました(図3)。つまり、CD103陽性の「組織常在性Treg細胞」がCD103陰性の「CD4 Trm細胞」によって誘導される線維化を抑制することが明らかになりました。
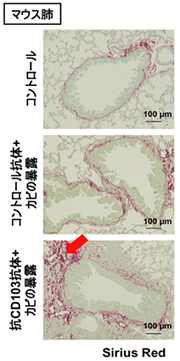
図3 抗CD103抗体投与による肺の組織線維化の悪化
今後の展開
今回、我々が新たに同定した「CD4 Trm細胞」は、体内を移動せず肺の炎症局所に数ヶ月以上の長期間に渡って住み続けるという特徴があります。このような特殊な細胞集団はこれまであまり注目されてきませんでした。「CD4 Trm細胞」は、組織内に長期間住み続けていることから、従来の点滴などで投与する薬剤は、組織の中にいる「CD4 Trm細胞」には十分に届いていない可能性があります。そのため、これらの細胞集団を標的とした新規の治療法を確立することで、肺組織の線維化が引き起こす難治性の疾患において画期的な治療薬の開発につながることが期待されます。
研究プロジェクトについて
本研究は以下の支援を受けて行われました。
- 日本医療研究開発機構革新的先端研究開発支援事業(AMED-CREST「適応・修復領域」)「気道組織における病的リモデリング(線維化)機構の解明と病態制御治療戦略の基盤構築」(研究開発代表者:中山 俊憲)
- 同(PRIME「機能低下領域」)「線維化誘導-病原性ヘルパーT細胞によるイムノエイジング病態形成機構の解析と病態制御」(研究開発代表者:平原 潔)
- 日本医療研究開発機構 免疫アレルギー疾患実用化研究事業「好酸球性アレルギー炎症において組織線維化を引き起こす線維化誘導-病原性ヘルパーT細胞を標的とした新規線維化治療法開発」(研究開発代表者:平原 潔)
- 同「IL-33活性化の新規制御機構解明による難治性アレルギー性気道炎症の治療法開発」(研究開発代表者:中山 俊憲)
論文情報 及び 関連ニュースリリース
- 論文タイトル:
- “CD103hi Treg cells constrain lung fibrosis induced by CD103lo tissue-resident pathogenic CD4 T cells”(CD103陽性の制御性T細胞は、CD103陰性の組織常在性病原性CD4 T細胞によって誘導される肺の線維化を制御する)
- 雑誌名:
- Nature Immunology DOI: 10.1038/s41590-019-0494-y
- 参考情報:
- 「ぜんそくの重症化に有効な治療法の鍵を発見 重症アレルギー疾患を引き起こす組織線維化のメカニズムを解明 PDF」2018年6月25日発行(千葉大学)
用語解説
- 注1)線維化
- 炎症や組織損傷など様々な原因で、体内の臓器中に過剰の膠原線維(コラーゲン)をはじめとする細胞外基質と呼ばれる物質が沈着した状態。線維化を起こした臓器は硬くなり、正常な機能を果たせなくなる。
本件に関するお問い合わせ
研究に関すること
中山 俊憲(ナカヤマ トシノリ)
千葉大学 大学院医学研究院 免疫発生学(H3) 教授
戸邉 一之(トベ カズユキ)
富山大学大学院医学薬学研究部(医学)内科学第一講座 教授
報道担当
千葉大学亥鼻地区事務部総務課企画係
富山大学総務部総務・広報課
AMEDの事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
革新的先端研究開発支援事業について
基盤研究事業部 研究企画課
免疫アレルギー疾患実用化研究事業について
戦略推進部 難病研究課