警戒行動時の二次情報伝達物質の動態を可視化
2020-02-04 理化学研究所
理化学研究所(理研)脳神経科学研究センター神経グリア回路研究チームの平瀬肇チームリーダー、大江祐樹研究員らの国際共同研究グループは、神経活動を支えるグリア細胞の一つである「アストロサイト」の活性化様式は心理状態に応じて変化し、その導因は脳幹[1]にあるノルアドレナリン[2]を放出するノルアドレナリン作動性神経細胞にあることを発見しました。
本研究成果は、心理状態が影響を及ぼす記憶の定着メカニズムの解明に貢献するととともに、心的外傷を治療する上での重要な知見になると考えられます。
今回、国際共同研究グループが、マウスの大脳皮質にあるアストロサイトの「二次情報伝達物質(セカンドメッセンジャー)[3]」であるカルシウムと環状アデノシン一リン酸(cAMP)の動態を同時に測定したところ、カルシウム濃度は少量のノルアドレナリンで上昇する一方、cAMP濃度の上昇には多量のノルアドレナリンを必要とすることが分かりました。また、覚醒状態のマウスで二次情報伝達物質の動態を調べたところ、軽い驚きを感じたときにはカルシウム濃度だけが上昇しますが、強い恐怖を感じたときにはカルシウム濃度とcAMP濃度の両方が上昇することが分かりました。このことから、興奮時に脳内に放出されるノルアドレナリンには、2段階の状態が存在することが明らかになりました。さらに、2段階目の状態のときに脳の糖代謝が促進され、それが記憶の定着につながる可能性が示されました。
本研究は、オンライン科学雑誌『Nature Communications』(1月24日付)に掲載されました。
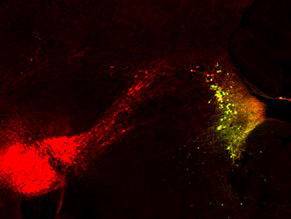
マウスの脳幹にあるノルアドレナリン作動性神経細胞(黄色の点)
背景
脳の情報は「神経細胞」を介して伝達されますが、その周りで神経細胞を補佐する役割を果たす細胞を「グリア細胞」といいます。グリア細胞の一種である「アストロサイト」は、神経伝達物質の回収や代謝などさまざまな役割を担っています。これまで、記憶のメカニズムについては神経細胞を中心に研究されてきましたが、最近の研究ではアストロサイトが記憶の定着に重要な役割を担うことが報告されています。
アストロサイトは活性化すると、細胞内で二次情報伝達物質(セカンドメッセンジャー)の一つであるカルシウムイオン(以下カルシウム)の濃度が上昇します。これまでの研究により、このカルシウム濃度の上昇は、驚愕反応や随意運動開始時に、神経修飾物質[2]の「ノルアドレナリン」がアストロサイトのα1受容体に結合することで誘発されることが分かっています。
また、カルシウムとは別の二次情報伝達物質である環状アデノシン一リン酸(cAMP)の濃度の上昇は、ノルアドレナリンがアストロサイトのβ受容体に結合して誘発されることが示唆されていて、さらに記憶の定着に関与することが報告されていますが、その詳しい動態やカルシウムとの相互関係については明らかになっていませんでした。
そこで、国際共同研究グループは今回、生きたマウスを用いて、カルシウムとcAMPを同時測定し、検証を行いました。
研究手法と成果
まず、アストロサイトにおける二次情報伝達物質の動態を測定するために、光刺激によってノルアドレナリンを選択的に放出するマウス実験系を作製しました。Cre-loxP部位特異的組換え技術[4]を用いて、脳幹の青斑核[1]にあるノルアドレナリン作動性神経細胞に光受容イオンチャネルのチャネルロドプシン2(ChR2)[5]を発現させました(図1)。ChR2は光によって活性化され、発現している神経細胞を興奮させます。また、カルシウムの蛍光プローブであるGCaMP[6]とcAMPの蛍光プローブ Pink Flamindo[6]を大脳皮質のアストロサイトに発現させ、2光子顕微鏡[7]を用いて観察しました。
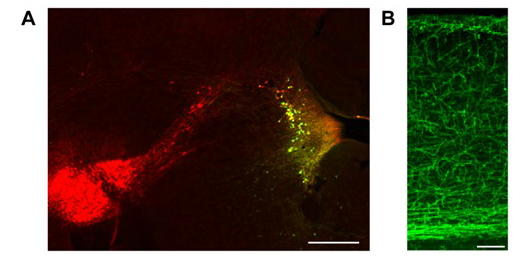
図1 マウス脳においてノルアドレナリン作動性神経細胞特異的にChR2が発現している様子
A:光刺激によってノルアドレナリンを放出させるためにChR2をマウス脳幹の青斑核特異的に発現させた。黄色は青斑核、赤は腹側被蓋野。スケールバーは500マイクロメートル(μm、1μmは1,000分の1mm)。
B:大脳皮質。繊維状に見える構造がノルアドレナリン作動性神経細胞の軸索で、大脳皮質全体に投射しているのが分かる。スケールバーは100μm。
大脳皮質に投射しているノルアドレナリン作動性神経細胞の軸索を光刺激したところ、3~5秒でアストロサイト内のカルシウム濃度に上昇が見られました(図2A,B)。しかし、同条件ではcAMP濃度の上昇は確認できなかったため、光刺激をさらに長く与え続けたところ、10~30秒の刺激で濃度が上昇しました(図2C,D)。このことから、アストロサイトの二つの二次情報伝達物質は、それぞれ刺激時間に依存して異なる反応を示すことが分かりました。
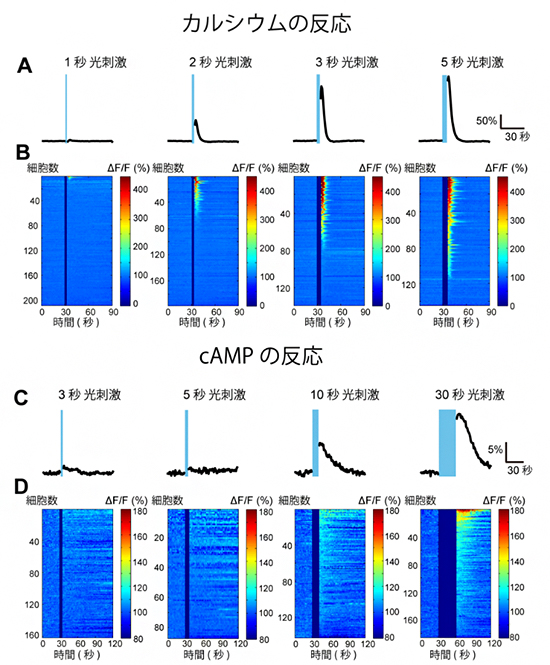
図2 光刺激によるアストロサイトのカルシウムとcAMPの変化
A:光刺激時間とカルシウムの反応。3~5秒の刺激でカルシウム濃度の上昇が見られた。
B:各細胞のカルシウム反応。縦軸は細胞数、横軸は時間を示している。反応が高い点を暖色、低い点を寒色で表しており、光刺激後にカルシウム濃度が上昇した様子が分かる。
C:光刺激時間とcAMPの反応。3~5秒の光刺激ではcAMP濃度は上昇しなかったが、10~30秒の長い刺激では上昇が見られた。
D:各細胞のcAMP反応。光刺激後にcAMP濃度が上昇した様子が分かる。
上記のようなカルシウムとcAMPの反応の違いの理由を調べるために、細胞外ノルアドレナリン蛍光プローブであるnLightを大脳皮質に発現させ、刺激時間と細胞外ノルアドレナリン濃度の関係を調べました。すると、放出されるノルアドレナリンの量は、光刺激時間が長いほど多いことが分かりました。
この結果は、アストロサイト内のカルシウム反応に関わるα1受容体とcAMP反応に関わるβ受容体では、それぞれ活性化するためのノルアドレナリン量の閾値(下限)が異なることを意味しています。つまり、α1受容体の閾値の方がβ受容体よりも低いため、カルシウム濃度は短時間の光刺激で上昇するのに対し、cAMP濃度はより長い時間刺激を与えないと上昇しないことが示されました。
次に、このメカニズムが覚醒状態の動物の心理にどのような変化をもたらすのかを調べました。これまでの研究により、予期不能なタイミングでマウスの顔面に空気を吹き付けると軽い驚愕反応が生じ(図3A)、これに伴ってノルアドレナリンが放出され、アストロサイトのカルシウム濃度が上昇することが分かっています。このマウス実験系を用いて、カルシウム濃度とcAMP濃度の同時測定を行ったところ、カルシウム濃度は上昇しましたが、cAMP濃度の上昇は見られませんでした(図3B-E)。この結果から、動物は軽い驚きを感じたときに少量のノルアドレナリンを放出し、アストロサイトのカルシウム濃度が上昇すると考えられます。
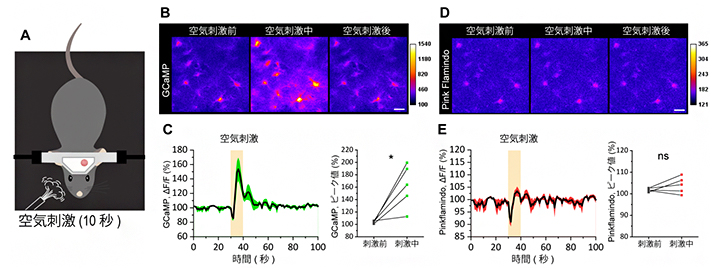
図3 軽い驚愕反応時のカルシウム値とcAMP値の変化
A:マウスの顔に予期不能なタイミングで空気を10秒間吹き付けることで、軽微な驚愕反応を引き起こさせる実験系のイメージ。
BC:カルシウム反応の結果を2光子顕微鏡の画像(B)と二つのグラフ(C)で示した。Cの左のグラフは縦軸がカルシウムの反応、横軸が時間を表す。右のグラフは、空気刺激前と刺激中のカルシウム反応を定量的に解析したもの。カルシウムでは空気刺激による反応が見られた。スケールバーは20μm。
DE:cAMP反応の結果を2光子顕微鏡の画像(D)と二つのグラフ(E)で示した。cAMPでは空気刺激による反応は見られなかった。スケールバーは20μm。
さらに、マウスに強烈な警戒反応を引き起こさせる恐怖条件づけ刺激を与える実験を行いました。通常、恐怖条件づけ刺激は自由行動下の動物に与えますが、今回の実験では2光子顕微鏡によって脳の細胞を可視化するため、頭部を固定した実験系を新たに用意しました(図4A)。警告音を30秒間鳴らした後、足に電気刺激を1秒間与えるという操作を繰り返すと、マウスは初めの数回で音と電気の刺激の関連性を学習するようになります。実験の結果、初めのうちは足への電気刺激によって、アストロサイトのカルシウム濃度とcAMP濃度はともに上昇しましたが、操作を繰り返すにつれて徐々に減少していき(図4B,C)、学習が成立すると消失しました。
この結果から、動物は強い恐怖を感じたときに多量のノルアドレナリンを放出し、それに伴ってアストロサイトのcAMP濃度が上昇することが記憶の定着に寄与しているのではないかと示唆されました。
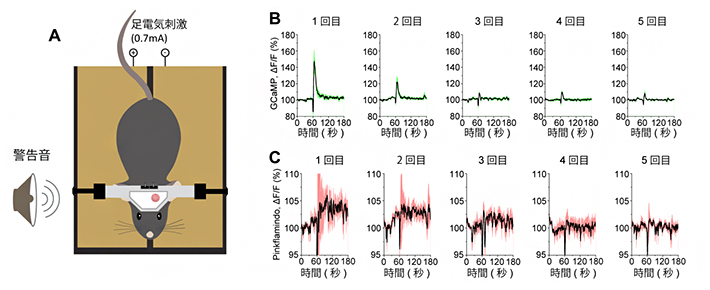
図4 恐怖を伴う警戒反応によるカルシウム値とcAMP値の変化
A:本研究で開発した頭部固定状態での恐怖条件づけ刺激の実験系イメージ。マウスに警告音を30秒間聞かせた後、足に電気刺激を1秒間与えるという操作を繰り返すことで、音と足刺激の関連性を学習させる。
B:恐怖条件づけ刺激によるカルシウム値の結果。初回の刺激で最も大きく反応し、その後徐々に減少した。
C:恐怖条件づけ刺激によるcAMP値の結果。カルシウムと同様の傾向が見られた。
最後に、アストロサイトのcAMP濃度上昇が脳における糖代謝を促進させることを確認するため、化学遺伝学的手法[8]で任意にcAMP濃度を上昇させられるDREADD[9]をマウスの大脳皮質と海馬[10]の一部のアストロサイトに発現させました。そして、クロザピン-N-オキシド(CNO)[9]を腹腔投与し、DREADDを活性化させた後、グリコーゲン(グルコースの重合体)[11]を観察しました。その結果、大脳皮質と海馬の両方において、DREADDによってcAMP濃度が上昇したアストロサイトではグリコーゲンが消失し、cAMP濃度が上昇しなかったアストロサイトではグリコーゲンは残存することが分かりました(図5)。これにより、アストロサイトのcAMP濃度上昇は糖代謝を促進することが、初めて視覚的に示されました。
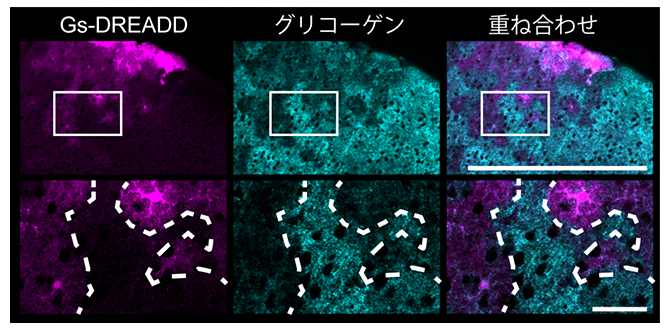
図5 大脳皮質アストロサイトにおけるDREADDを用いたcAMP依存的なグリコーゲン代謝
左:Gs型DREADDの発現(明るい紫の部分)。下段の写真では、白破線の外側の領域にGs-DREADDが発現している。
中:グリコーゲンの染色(明るい青の部分)。下段の写真では、白破線の内側の領域にグリコーゲンが見られる。
右:左と中を重ね合わせた画像。DREADDが発現した白破線の外側の領域ではグリコーゲンが消失したが、発現していない内側の領域ではグリコーゲンが残存していることが分かる。上図のスケールバーは500μm、下図は50μm。
今後の期待
今回、アストロサイトの活性化には、心理状態に応じて段階的な様式があることが分かり、アストロサイトを能動的に制御して記憶や学習といった脳機能を向上させる上で必要な基礎的な知見を得ることができました。本研究成果は、心理状態が影響を及ぼす記憶の定着メカニズムの解明に貢献するとともに、心的外傷を治療する上での重要な知見になると期待できます。
補足説明
1.脳幹、青斑核
脳幹は生命維持機能に重要な脳の部位で、多数の神経核から構成されている。青斑核は脳幹にある神経核の一つで、ノルアドレナリン作動性神経細胞が集合している。これらの青斑核のノルアドレナリン作動性神経細胞は、脳および脊髄へ広範囲に投射している。
2.ノルアドレナリン、神経修飾物質
「神経修飾物質」は神経細胞から分泌される物質で、ほかの多数の神経細胞の活動を変化させる作用を持つ。代表にはドーパミン、セロトニン、「ノルアドレナリン」などがあり、ノルアドレナリンは、覚醒時に警戒行動を起こす際に放出される。
3.二次情報伝達物質(セカンドメッセンジャー)
細胞外からの情報が受容体を介して伝達された後、細胞内で増幅されるシグナルのこと。その後、さまざまな機能に影響を及ぼす。
4.Cre-loxP部位特異的組換え技術
部位特異的に遺伝子を発現させる手法。ウィルスを組み合わせることで発現させる時期もコントロールできる。
5.チャネルロドプシン2(ChR2)
イオンチャネル型の光活性化タンパク質。神経細胞に発現させると、光刺激を利用して自在にその活動を制御できる。
6.GCaMP、Pink Flamindo
それぞれ、カルシウムとcAMPのセンサータンパク質。二次メッセンジャーが結合すると蛍光が明るくなり、細胞内濃度の上昇が分かる。
7.2光子顕微鏡
励起光として長波長の近赤外光を用いるため、生体内での散乱の影響を受けにくく、生体深部にある蛍光分子を観察することができる顕微鏡。
8.化学遺伝学的手法
人工的に改変した代謝型受容体とその活性化物質を組み合わせた手法。活性化物質は生体内に存在しない物質を用いるため、動物の体内に注入したときのみ受容体を活性化できる。
9.DREADD、クロザピン-N-オキシド(CNO)
化学遺伝学的手法の一つ。DREADDは代謝型受容体を制御し、本研究ではGs型Gタンパク質共役型受容体を制御している。CNOはDREADDの活性化物質で、DREADDの活性を自在に制御できる。DREADDは、designer receptors exclusively activated by designer drugsの略。
10.海馬
脳の中で、記憶をつかさどる領域。解剖学的には大脳皮質の内側に位置し、タツノオトシゴに似た形をしていることから「海馬」(タツノオトシゴの別名)と呼ばれる。
11.グリコーゲン
グルコースが重合したエネルギー貯蔵物質。脳においては、記憶の固定化に必要であることが報告されている。
国際共同研究グループ
理化学研究所 脳神経科学研究センター
神経グリア回路研究チーム
チームリーダー 平瀬 肇(ひらせ はじめ)
研究員 大江 祐樹(おおえ ゆうき)
テクニカルスタッフⅡ(研究当時) 王 筱文(Xiaowen Wang)
テクニカルスタッフⅠ(研究当時) 小澤 克也(おざわ かつや)
テクニカルスタッフⅠ 矢作和子(やはぎ かずこ)
神経回路・行動生理学研究チーム
チームリーダー トーマス・マックヒュー(Thomas McHugh)
群馬大学大学院 医学系研究科 脳神経再生医学分野
教授 平井 宏和(ひらい ひろかず)
講師 今野 歩(こんの あゆむ)
カリフォルニア大学 デービス校 生化学・分子医学専攻
准教授 リン・ティアン(Lin Tian)
研究員(研究当時) トマソ・パトリアーチ(Tommaso Patriarchi)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金新学術領域研究(研究領域提案型「グリアアセンブリによる脳機能発現の制御と病態(領域代表者:池中一裕)」)「生体内で起こる皮質回路シナプス可塑性におけるアストロサイトの役割(研究代表者:平瀬肇)」、同新学術領域研究(研究領域提案型「脳情報動態を規定する多領野連関と並列処理(領域代表者:尾藤晴彦)」)「神経修飾物質による皮質アストロサイトの中長期的な活動観測と機能的意義の解明(研究代表者:平瀬肇)」および基盤研究(A)「グリア細胞により支援される皮質神経回路の可塑性(研究代表者:平瀬肇)」、ヒューマンフロンティアプログラムによる支援を受けて行われました。
原論文情報
Yuki Oe, Xiaowen Wang, Tommaso Patriarchi, Ayumu Konno, Katsuya Ozawa, Kazuko Yahagi, Hirokazu Hirai, Lin Tian, Thomas J. McHugh, Hajime Hirase, “Distinct temporal integration of noradrenaline signaling by astrocytic second messengers during vigilance”, Nature Communications, 10.1038/s41467-020-14378-x
発表者
理化学研究所
脳神経科学研究センター 神経グリア回路研究チーム
チームリーダー 平瀬 肇(ひらせ はじめ)
研究員 大江 祐樹(おおえ ゆうき)
報道担当
理化学研究所 広報室 報道担当