2020-02-26 iPS細胞研究所
ポイント
- 人工mRNAは、細胞の遺伝子発現を操作するツールとして注目されている。
- 人工mRNAツールの性能を大幅に向上させる修飾塩基を検討し、N1-メチルシュードウリジン(m1Ψ)を発見した。
- m1Ψ修飾型人工mRNAスイッチを用いることで、効率的に未分化iPS細胞を除去できた。
- m1Ψ修飾型人工mRNAスイッチを組み合わせて、目的の細胞においてタンパク質を発現させることのできる遺伝子回路を構築した。
1. 要旨
京都大学iPS細胞研究所 齊藤博英 教授、Callum Parr 同研究員(研究当時、現 理化学研究所 基礎科学特別研究員)、和田俊輔 同研究員(研究当時)、Yi Kuang同研究員(研究当時、現 香港科技大学 助教)らの研究グループは、人工mRNAの性能を大幅に向上させることのできる修飾塩基を見出しました。
人工mRNAは、細胞の遺伝子発現を操作するツールとして注目を集めています。外来mRNAは細胞に異物として認識され、免疫応答を誘発します。これを回避するために、人工mRNAのシトシン(C)・ウリジン(U)をそれぞれ5-メチルシトシン(m5C)・シュードウリジン(Ψ)に置換するアプローチが取られてきました。しかし、人工mRNAの性能という点で、これらの修飾塩基が最適かどうかは検討されていませんでした。
研究グループは、様々な塩基修飾を施した人工mRNAの性能を評価し、N1-メチルシュードウリジン(m1Ψ)を用いた人工mRNAが最も高い性能を示すことを見出しました。さらに、m1Ψ修飾を施した人工mRNAを応用することで、未分化iPS細胞をより効率的に除去できることや、狙った細胞に目的のタンパク質を発現できることを示しました。本研究成果は、より安全性の高い細胞医療や特異性の高いmRNA医薬への応用が期待されます。
この研究成果は、2020年2月24日に英国科学誌「Nucleic Acids Research」でオンライン公開されました。
2. 研究の背景
人工mRNAは、その塩基配列を適切に設計することで様々な機能を付与できることから、細胞の遺伝子発現を制御するツールとして注目を集めています。また、DNAと異なり、人工mRNAは細胞に導入してもゲノムへの望まない変異導入のリスクを回避できるという点で、医薬品としての応用も期待されています。
外部から導入したmRNAは、細胞に異物として認識され、細胞の免疫応答を誘発します。これを回避するために、人工mRNAのシトシン(C)・ウリジン(U)をそれぞれ5-メチルシトシン(m5C)・シュードウリジン(Ψ)に置換するアプローチが取られてきました。しかし、これらの修飾塩基は免疫応答を回避できますが、人工mRNAツールの性能という点でこれらの修飾塩基が最適なのかどうかは検討されていませんでした。
3. 研究結果
1) 修飾塩基の探索
まず、、研究グループは、どの修飾塩基がmRNAツールの性能を最大化するのか、検討を行いました。モデルとして、細胞内の小さなRNAであるマイクロRNA (miRNA)応答性人工mRNAスイッチ(miRNAスイッチ)、RNA結合タンパク質(RNA Binding Protein; RBP)応答性人工mRNAスイッチ(RBPスイッチ)を使用しました。目的のmiRNA・RBP存在下において、これらのmRNAスイッチからのタンパク質の翻訳が抑制されます。これらについて様々な塩基修飾について検討を行った結果、ウリジンの替わりにN1-メチルシュードウリジン(m1Ψ)を導入したスイッチが最も高い性能を示すことを見出しました(図1)。
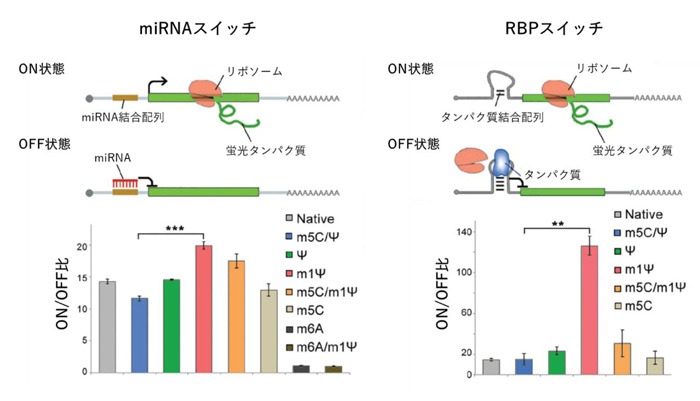
図1. mRNAスイッチの修飾塩基の検討
miRNAスイッチ、RBPスイッチについて種々の組み合わせの塩基修飾を検討した。ON状態とOFF状態における蛍光タンパク質の発現量を比較することで、mRNAスイッチの性能を評価した。(Native: 非修飾型スイッチ、m5C: 5-メチルシトシン、Ψ: シュードウリジン、m1Ψ: N1-メチルシュードウリジン、m6A: N6-メチルアデニン)
2) 未分化iPS細胞の除去効率の改善
細胞医療では、iPS細胞などの幹細胞から作った細胞を移植することで疾患の治療を試みます。その際、未分化iPS細胞が残っていた場合、移植部位で腫瘍を形成するリスクが存在します。そのため、未分化iPS細胞を効率よく除去することは細胞医療における大きな課題の一つです。m5C/Ψ修飾型miRNAスイッチを用いることで、未分化iPS細胞を除去できることは報告されていました。そこで、前項で見出されたm1Ψを用いることで、さらに除去効率を高められるかどうかを検証しました。その結果、m1Ψ修飾型miRNAスイッチは、m5C/Ψ修飾型miRNAよりも高効率に未分化iPS細胞を除去できることが示されました(図2)。
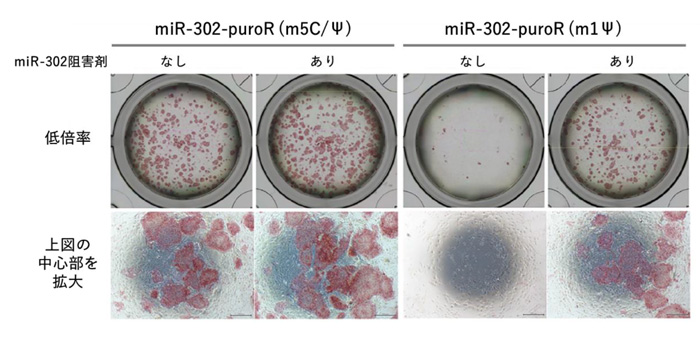
図2. m1Ψ 修飾による未分化iPS細胞の除去効率の向上
iPS細胞はマーカーAlkaline Phosphatase染色により赤紫色で示されている。m1Ψ 修飾型miRNAスイッチは、m5C/Ψ修飾型miRNAスイッチよりも効率的にiPS細胞や分化が不完全な細胞を除去することができた。
3) 生体分子応答性ON回路の設計
miRNAスイッチ・RBPスイッチは、いずれも生体分子存在下でタンパク質の発現が抑制されます。最後に研究グループは、これらのmRNAスイッチを組み合わせることで、特定のmiRNA存在下でタンパク質を発現させることのできる「人工遺伝子回路」の構築を試みました。その結果、m1Ψ修飾型mRNAスイッチを使用することで遺伝子回路の性能を大幅に向上させることに成功しました(図3)。
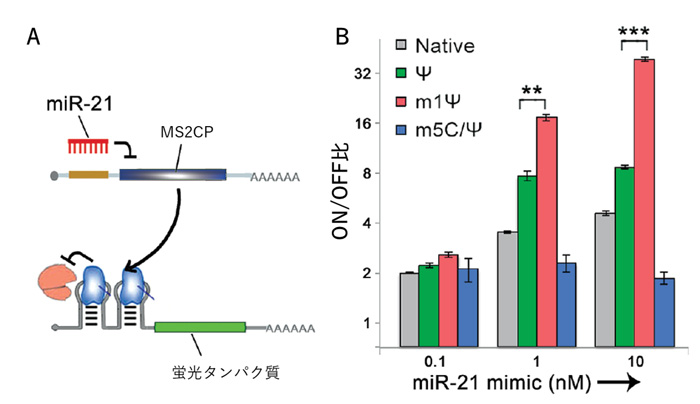
図3. m1Ψ 修飾を用いたmiRNA応答性ON回路のパフォーマンス向上
(A) miRNAスイッチとRBPスイッチを組み合わせたmiRNA応答性ON回路。OFF状態ではRNA結合タンパク質(MS2CP)が蛍光タンパク質の発現を抑制している。ON状態では、miRNAによりMS2CPの発現が抑制されることで、蛍光タンパク質の発現抑制が解除される。(B)各修飾塩基を用いたON回路の性能比較。m1Ψが最も高いON/OFF比を示した。また、miRNA mimicの濃度依存的にON回路のアウトプットの増大が見られた。
4. まとめ
本研究では、mRNAスイッチの性能を向上させる修飾塩基を検討し、m1Ψによる修飾を導入することでmRNAスイッチの性能を大幅に向上できることを見出しました。さらに、m1Ψ修飾型miRNAスイッチを用いて未分化iPS細胞を効率的に除去できることを見出しました。本研究成果は、より安全性の高い細胞医療の実現や特異性の高いmRNA医薬の創出に向けて貢献できるものと期待されます。
5. 論文名と著者
- 論文名
N1-Methylpseudouridine substitution enhances the performance of synthetic mRNA switches in cells - ジャーナル名
Nucleic Acids Research - 著者
Callum J.C. Parr1#, Shunsuke Wada1#, Kenjiro Kotake1, Shigetoshi Kameda1, Satoshi Matsuura1, Souhei Sakashita2, Soyoung Park2, Hiroshi Sugiyama2, Yi Kuang3* and Hirohide Saito1*
# 筆頭著者 * 責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 京都大学大学院理学研究科
- 香港科技大学
6. 本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
- 日本学術振興会 科学研究費補助金 「基盤研究S: 15H05722」
- ヒューマン・フロンティア・サイエンス・プログラム(HFSP)
- iPS細胞研究基金