52万人のゲノム解析により脳卒中の病態を解明する新たな情報を発見
2018-03-13 理化学研究所,大阪大学,九州大学,日本医療研究開発機構
要旨
理化学研究所(理研)統合生命医科学研究センターの久保充明副センター長、統計解析研究チームの鎌谷洋一郎チームリーダー、大阪大学大学院医学系研究科遺伝統計学の岡田随象教授および九州大学大学院医学研究院衛生・公衆衛生学分野の二宮利治教授、秦淳准教授らの国際共同研究グループ※は「MEGASTROKEコンソーシアム[1]」の一員として、世界中から集めた52万人規模の遺伝情報を用いてゲノムワイド関連解析(GWAS)[2]を行い、22の新規座位[3](遺伝的変異[4])を含む32の脳卒中に影響する座位を同定しました。
脳卒中は世界で2番目に死亡者が多い疾患です注1)。脳卒中は大きく虚血性(脳梗塞)と出血性(脳出血、くも膜下出血)に分かれ、脳梗塞はさらにアテローム血栓性脳梗塞、心原性脳梗塞、ラクナ梗塞などの亜型に分類されます。しかし、発症の分子レベルのメカニズムはいまだにあまり分かっておらず、新しい治療法の開発が進んでいません。
今回、国際共同研究グループは、欧州系、南北アメリカ系、アジア系、アフリカ系、そしてオーストラリア系の集団に、バイオバンク・ジャパン[5]と久山町研究[6]が収集した日本人集団を加えた、6万7,000人の脳卒中患者を含む52万人規模のゲノム解析を行いました。その結果、22の新規座位を含む32の脳卒中に影響する座位を同定しました。22の新規座位には、アテローム血栓性脳梗塞、心原性脳梗塞、ラクナ梗塞の三つの亜型に関連する座位も含まれていました。同定した32座位を詳しく観察すると、心房細動、虚血性心疾患、静脈塞栓症の遺伝子、さらに脳卒中の危険因子である高血圧や脂質異常症(高コレステロール血症)関連の遺伝子も含まれていました。これは、これらの疾患や危険因子が、部分的に同じ遺伝子を経由して脳卒中の発症メカニズムに寄与していることを示しています。また、同定した座位に含まれる脳卒中に関連する遺伝子群と既存の治療薬の標的遺伝子とを照合するゲノム創薬解析の結果、脳卒中に関連する遺伝子群は、脳卒中患者の急性期治療や脳梗塞の予防治療に用いられる治療薬と、特に強い結びつきを持つことを明らかにしました。
本成果は、今後のオーダーメイド医療の実現につながる礎を築くものです。同定した薬剤ターゲット候補は今後、直接的な治療につながると期待できます。
本研究成果は、国際科学雑誌『Nature Genetics』に掲載されるのに先立ち、オンライン版(3月12日付け:日本時間3月13日)に掲載されます。
本研究におけるGWASの解析結果は、理学研統合生命医科学研究センター統計解析研究チームが構築した日本人集団ゲノム関連解析情報データベース「Jenger」注2)を通じて一般公開されます。
本研究は、日本医療研究開発機構(AMED)「オーダーメイド医療の実現プログラム」の支援のもと行われました。
注1)2017年1月 WHOファクトシート PDF
注2)Japanese ENcyclopedia of GEnetic associations by Riken (Jenger).
※共同研究グループ
- 理化学研究所 統合生命医科学研究センター
- 副センター長 久保 充明(くぼ みちあき)
- 統計解析研究チーム
- チームリーダー 鎌谷 洋一郎(かまたに よういちろう)
- 研修生 金井 仁弘(かない まさひろ)
(米国ハーバード大学 医学部 博士課程在籍) - 研修生 坂上 沙央里(さかうえ さおり)
(東京大学大学院 医学系研究科 博士課程在籍) - 大阪大学大学院医学系研究科 遺伝統計学
- 教授 岡田 随象(おかだ ゆきのり)
(理化学研究所 統合生命医科学研究センター 統計解析研究チーム 客員主管研究員) - 九州大学大学院医学研究院 衛生・公衆衛生学分野
- 教授 二宮 利治(にのみや としはる)
- 准教授 秦 淳(はた じゅん)
- ルートヴィヒ・マクシミリアン大学ミュンヘン 脳卒中・認知症研究所
- 教授 マルティン・ディシュガンス(Martin Dichgans)
- 博士研究員 ライナー・マリク(Rainer Malik)
- ボルドー大学 疫学科
- 教授 ステファニー・ドゥベット(Stephanie Debette)
- 博士研究員 ムラリダラン・サグルプルムラジュ
(Muralidharan Sargurupremraj) - インド理科大学院 脳研究センター
- 研究者 ガネシュ・チョーハン(Ganesh Chauhan)
- ケンブリッジ大学 公衆衛生学・プライマリケア学部
- 上級リサーチアソシエイト ジョアナ・ホーソン(Joanna MM Howson)
- 臨床神経科学部
- 教授 ヒュー・マルカス(Hugh S Markus)
- 上級リサーチアソシエイト マシュー・テイラー(Matthew Traylor)
- テキサス大学 人類遺伝学センター
- 教授 ミリアム・フォルナージュ(Myriam Fornage)
- ボストン大学医学部 神経内科
- 教授 スッダ・スシャドリ(Sudha Seshadri)
- メリーランド大学医学部 神経内科
- 教授 スティーブン・キトナー(Steven J Kittner)
- バージニア大学医学部 神経内科
- 教授 ブラッドフォード・ウォレル(Bradford B Worrall)
- デコード・ジェネティクス社
- CEO カリ・ステファンソン(Kari Stefansson)
背景
脳卒中は世界で2番目に死亡者が多い疾患です。脳に栄養を送る血管が閉塞したり破れたりすることで脳組織への血流障害が起こり、その結果、麻痺や失語などの神経の障害が生じて日常生活に悪影響を引き起こします。脳卒中は大きく虚血性脳卒中(脳梗塞)と出血性脳卒中(脳出血、くも膜下出血)に分けられ、急性に発症する神経学的な障害を特徴とします。さらに脳梗塞は、アテローム血栓性脳梗塞(LAS)、心原性脳梗塞(CE)、ラクナ梗塞(SVD)の亜型に分類されます。しかし、発症の分子レベルでのメカニズムはいまだにあまり分かっておらず、新しい治療法の開発は進んでいませんでした。
久保副センター長らは2007年に、世界に先駆けて日本人集団の脳梗塞のゲノムワイド関連解析(GWAS)を行いましたが注3)、その後のGWASはほとんどが欧州系集団を対象としたものでした注4、5、6)。また、これまでに再現性の高い10カ所のゲノム領域が脳卒中に関連することが知られていますが、多くの領域はそれぞれの特定の亜型に関連しており、各亜型に分類するとサンプル数が少なくなることが問題でした。このため、大規模な民族横断的アプローチにより、さらに疾患発症に関わるゲノム領域を発見し、脳卒中の病態解明、新しい治療開発やオーダーメイド医療の実現へとつなげていくことが期待されていました。
一方、国際脳卒中遺伝学コンソーシアム(ISGC)[1]では、脳卒中のゲノム解析を行う世界の研究者が情報交換や発表を行ってきました。そして、ISGCで認められた世界最大のGWASを行う構想に基づき、世界最大規模の民族横断的ゲノム解析を行うための脳卒中国際共同研究コンソーシアム「MEGASTROKEコンソーシアム」が2016年に結成されました。MEGASTROKEコンソーシアムには、最近GWASを報告している注7)バイオバンク・ジャパンや久山町研究も参加しています。
注3)Kubo, M et al. “A nonsynonymous SNP in PRKCH (protein kinase C η) increases the risk of cerebral infarction.” Nat Genet 39, 212-217 (2007).
注4)Gudbjartsson, DF et al. “A sequence variant in ZFHX3 on 16q22 associates with atrial fibrillation and ischemic stroke.” Nat Genet41, 876-8 (2009)
注5)Ikram, MA et al. “Genomewide association studies of stroke.” N Engl J Med 360, 1718-1728 (2009).
注6)International Stroke Genetics Consortium (ISGC) et al. “Genome-wide association study identifies a variant in HDAC9 associated with large vessel ischemic stroke.” Nat Genet 44, 328-33 (2012).
注7)Hachiya, T et al. “Genetic predisposition to ischemic stroke.” Stroke 48, 253-258 (2017).
研究手法と成果
MEGASTROKEコンソーシアムはまず、ドイツ、フランス、英国、日本、米国、アイスランド、スペイン、スイス、イタリア、ベルギー、オランダ、デンマーク、スウェーデン、ノルウェー、フィンランド、エストニア、ポーランド、シンガポール、オーストラリア、カナダの世界20カ国のメンバーがそれぞれ実施していたGWASや、新たに実施したGWASの解析結果を収集しました。そして、民族横断的メタ解析手法[7]であるMANTRA法を用いることでそれらの結果を統合し、最終的に6万7,000人の脳卒中患者を含む52万人規模のゲノム解析を行いました。
その結果、脳卒中に関連する32の座位を同定しましたが、そのうち22箇所は今回新たに見つかった座位でした(図1)。亜型についてみてみると、6座位(うち3箇所新規)はLAS、4座位(うち2箇所新規)はCE、2座位(うち1新規)はSVDと関連していました。LASでは今回新規に同定された遺伝子のEDNRAとLINC01492と既報のTSPAN2遺伝子、CEでは新規のNKX2-5と既報のPITX2遺伝子は亜型に特異的に関連していました。
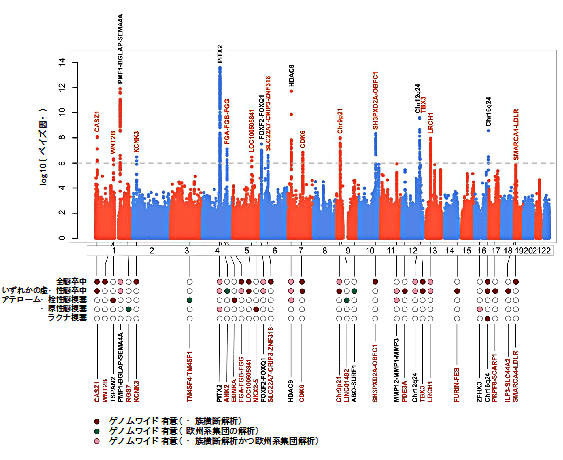
図1 52万人規模のゲノムワイド関連解析(GWAS)の結果
横軸は常染色体上の今回調べた遺伝的変異の位置を示し、縦軸は関連の強さを表す。下は今回同定した32の座位が、脳卒中の各亜型とどのように関連しているかを色で示した。赤字は今回新たに見つかった22座位、黒字は既報の座位を示す。
また、過去に行われたさまざまな他の血管系疾患や血管リスク因子のGWASと比較したところ、今回同定した32の座位は血圧(5座位)、冠動脈疾患(5座位)、心房細動(2座位)、血栓塞栓症(2座位)、LDLコレステロール(2座位)、頸動脈プラーク(1座位)、白質高信号域(1座位)と関連していることが分かりました(図2)。これは、脳卒中とさまざまな血管系疾患や血管リスク因子とを分子レベルでつなぐ情報を得たということであり、今後の病気のメカニズム解明のために大きく活用されることが期待できます。
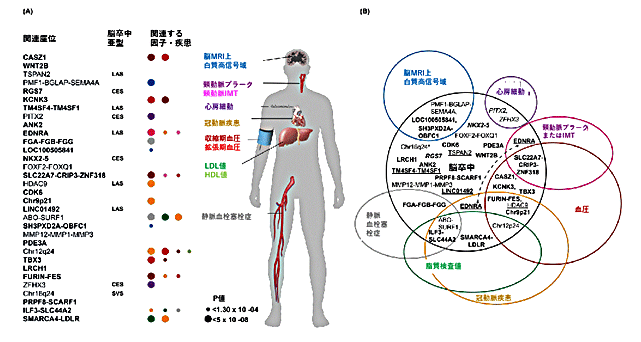
図2 脳卒中と関連する32の遺伝子領域と血管系疾患やリスク因子とのオーバーラップ
(A)血管系疾患やリスク因子のGWASにおいて、脳卒中32座位のそれぞれとの関連。丸の大きさは関連の強さを表す。(B)オーバーラップする座位についてのベン図。
さらに、発見された遺伝子群に対するゲノム創薬解析を実施しました。まず、同定した32の座位に含まれる脳卒中と関連する遺伝子群を、遺伝子発現データやエピゲノム[8]データなどのオミクス情報[9]を活用して絞り込んだ上で、創薬データベース上に登録された既存の治療薬の標的遺伝子とのつながりを、網羅的に検討しました。国際的な疾患治療薬分類基準である解剖治療化学分類法[10]との照合の結果、脳卒中に関連する遺伝子群は、数ある治療薬の中でも、脳卒中患者の急性期治療や脳梗塞の予防治療に用いられる治療薬(抗凝固療法および血栓溶解療法)と、特に強い結びつきを持つことが明らかになりました(図3)。これは、疾患ゲノム解析の成果に基づく新たなゲノム創薬につながる画期的な成果です。
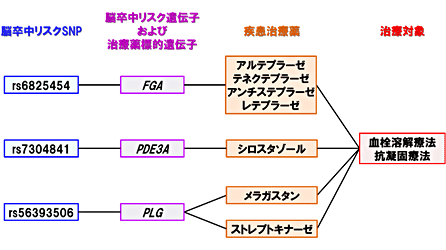
図3 脳卒中における疾患ゲノム情報と疾患治療薬のつながり
今回同定した32の座位に含まれる脳卒中に関連する遺伝子群と既存の治療薬の標的遺伝子の関連を解析した結果。脳卒中リスクSNP(一塩基多型)およびリスク遺伝子が、脳卒中の治療(血栓溶解療法)や予防(抗凝固療法)に使われている治療薬の標的遺伝子と強く結びついていることが明らかになった。
今後の期待
本研究成果で行ったGWASは、脳卒中の遺伝的リスク因子を解明する研究としては世界最大規模です。また、今回同定した新規の22座位を含む32の脳卒中関連座位は、今後の、脳卒中治療における遺伝子情報を用いたオーダーメイド医療の実現の礎を築くものです。
今後、さまざまな血管系疾患と血管リスク因子との関連性をゲノムを軸として読み解くことで、血管系疾患全体に対して、システム的にアプローチをすることが可能になると考えられます。また、今回、疾患ゲノム解析の結果から薬剤ターゲット候補を同定したことで、ゲノム解析結果が治療薬の決定といった形で直接的に脳卒中の診療へと役立つ可能性が期待できます。
論文情報
- タイトル
- Multiancestry genome-wide association study of 520,000 subjects identifies 32 loci associated with stroke and stroke subtypes
- 著者名
- Rainer Malik *, Ganesh Chauhan *, Matthew Traylor *, Muralidharan Sargurupremraj *, Yukinori Okada *, Aniket Mishra, Loes Rutten-Jacobs, Anne-Katrin Giese, Sander W van der Laan, Solveig Gretarsdottir, Christopher D Anderson, Michael Chong, Hieab HH Adams, Tetsuro Ago, Peter Almgren, Philippe Amouyel, Hakan Ay, Traci M Bartz, Oscar R Benavente, Steve Bevan, Giorgio B Boncoraglio, Robert D Brown, Jr. , Adam S Butterworth, Caty Carrera, Cara L Carty, Daniel I Chasman, Wei-Min Chen, John W Cole, Adolfo Correa, Ioana Cotlarciuc, Carlos Cruchaga, John Danesh, Paul IW de Bakker, Anita L DeStefano, Marcel den Hoed, Qing Duan, Stefan T Engelter, Guido J Falcone, Rebecca F Gottesman, Raji P Grewal, Vilmundur Gudnason, Stefan Gustafsson, Jeffrey Haessler, Tamara B Harris, Ahamad Hassan, Aki S Havulinna, Susan R Heckbert, Elizabeth G Holliday, George Howard, Fang-Chi Hsu, Hyacinth I Hyacinth, M Arfan Ikram, Erik Ingelsson, Marguerite R Irvin, Xueqiu Jian, Jordi Jiménez-Conde, Julie A Johnson, J Wouter Jukema, Masahiro Kanai, Keith L Keene, Brett M Kissela, Dawn O Kleindorfer, Charles Kooperberg, Michiaki Kubo, Leslie A Lange, Carl D Langefeld, Claudia Langenberg, Lenore J Launer, Jin-Moo Lee, Robin Lemmens, Didier Leys, Cathryn M Lewis, Wei-Yu Lin, Arne G Lindgren, Erik Lorentzen, Patrik K Magnusson, Jane Maguire, Ani Manichaikul, Patrick F McArdle, James F Meschia, Braxton D Mitchell, Thomas H Mosley, Michael A Nalls, Toshiharu Ninomiya, Martin J O’Donnell, Bruce M Psaty, Sara L Pulit, Kristiina Rannikmäe, Alexander P Reiner, Kathryn M Rexrode, Kenneth Rice, Stephen S Rich, Paul M Ridker, Natalia S Rost, Peter M Rothwell, Jerome I Rotter, Tatjana Rundek, Ralph L Sacco, Saori Sakaue, Michele M Sale, Veikko Salomaa, Bishwa R Sapkota, Reinhold Schmidt, Carsten O Schmidt , Ulf Schminke, Pankaj Sharma, Agnieszka Slowik, Cathie LM Sudlow, Christian Tanislav, Turgut Tatlisumak, Kent D Taylor, Vincent NS Thijs, Gudmar Thorleifsson, Unnur Thorsteinsdottir, Steffen Tiedt, Stella Trompet, Christophe Tzourio, Cornelia M van Duijn, Matthew Walters, Nicholas J Wareham, Sylvia Wassertheil-Smoller, James G Wilson, Kerri L Wiggins, Qiong Yang, Salim Yusuf, AFGen consortium, Cohorts for Heart and Aging Research in Genomic Epidemiology (CHARGE) Consortium, International Genomics of Blood Pressure (iGEN-BP) Consortium, INVENT consortium, STARNET, Joshua C Bis, Tomi Pastinen, Arno Ruusalepp, Eric E Schadt, Simon Koplev, Johan LM Björkegren, Veronica Codoni, Mete Civelek, Nicholas L Smith, David A Trégouët, Ingrid E Christophersen, Carolina Roselli, Steven A Lubitz, Patrick T Ellinor, E Shyong Tai, Jaspal S Kooner, Norihiro Kato, Jiang He, Pim van der Harst, Paul Elliott, John C Chambers, Fumihiko Takeuchi, Andrew D Johnson, BioBank Japan Cooperative Hospital Group, COMPASS consortium, EPIC-CVD consortium, EPIC-InterAct consortium, International Stroke Genetics Consortium (ISGC), METASTROKE Consortium, Neurology Working Group of the Cohorts for Heart and Aging Research in Genomic Epidemiology (CHARGE) Consortium, NINDS Stroke Genetics Network (SiGN), UK Young Lacunar DNA Study, MEGASTROKE Consortium, Dharambir K Sanghera DK, Olle Melander, Christina Jern, Daniel Strbian, Israel Fernandez-Cadenas, W T Longstreth, Jr, Arndt Rolfs, Jun Hata, Daniel Woo, Jonathan Rosand, Guillaume Pare, Jemma C Hopewell, Danish Saleheen , Kari Stefansson **, Bradford B Worrall **, Steven J Kittner **, Sudha Seshadri **, Myriam Fornage **, Hugh S Markus **, Joanna MM Howson **, Yoichiro Kamatani **, Stephanie Debette **§ and Martin Dichgans **§
- * 共同で解析を実施、** 共同で研究を指揮、§責任著者
- 雑誌
- Nature Genetics
- DOI
- 10.1038/s41588-018-0058-3
補足説明
- [1] MEGASTROKEコンソーシアム、国際脳卒中遺伝学コンソーシアム(ISGC)
- ISGCは2007年4月に米国ボストンで組織され、脳卒中のゲノム解析の国際連携を目的とする。次回のワークショップは2018年4月に京都で開催予定。2016年にISGCにおいて世界最大規模の民族横断的ゲノム解析を行うための脳卒中国際共同研究コンソーシアムとして「MEGASTROKEコンソーシアム」の構築が合意された。ISGC はInternational Stroke Genetics Consortium の略。詳細はWelcome to the International Stroke Genetics Consortium
- [2] ゲノムワイド関連解析(GWAS)
- ヒトゲノムの全域に分布する遺伝的変異と、臨床検査値などの量的な形質や病気との因果関係を網羅的に検討する遺伝統計解析手法。これまでに、数百を超える形質や病気を対象に実施され、数多くの関連遺伝的変異が同定されている。GWASはGenome-Wide Association Studyの略。
- [3] 座位
- GWASを含む遺伝統計解析では、病気の原因となる遺伝的変異を直接同定できるというよりは、病気の原因となる遺伝的変異を含むゲノム領域を同定する。その際、遺伝統計解析によって同定されたゲノム領域を指す。
- [4] 遺伝的変異
- ヒトゲノムの99.9%は、人と人との間で全く同一のDNA配列であるが、残り0.1%に多様性がみられる。そのようなゲノム上の場所を指す。
- [5] バイオバンク・ジャパン
- 日本人集団27万人を対象とした、世界最大級の疾患バイオバンク。オーダーメイド医療の実現プログラムを通じて実施され、ゲノムDNAや血清サンプルを臨床情報と共に収集し、研究者へのデータ提供や分譲を行っている。
- [6] 久山町研究
- 福岡県久山町の地域住民を対象に、九州大学が50年以上にわたって継続している生活習慣病の疫学調査。今回の研究では、九州大学病院など福岡県内の7医療機関が収集した脳梗塞患者群と、久山町研究の対象者のうち脳梗塞の既往のない対照群を用いたGWAS解析を行い、その要約データをMEGASTROKEコンソーシアムに供出した。
- [7] 民族横断的メタ解析手法
- ゲノム構造は民族集団によって異なるため、例えば欧州系集団のGWASと日本人集団のGWASを単純に統合することは困難な場合がある。今回研究で用いたMANTRA法などの民族横断的メタ解析手法は、集団間のゲノム構造の違いを考慮した統合解析を実現する。
- [8] エピゲノム
- ゲノム配列に施された後天的な修飾のこと。ゲノム配列そのものを変化させずに、細胞や組織に応じて異なるエピゲノム修飾が行われている。
- [9] オミクス情報
- ゲノム情報やエピゲノム情報、メタボローム情報など、生体内や細胞内に含まれる多彩な情報の総称。
- [10] 解剖治療化学分類法
- 世界保健機関(World Health Organization; WHO)によって定められた、治療対象疾患と疾患治療薬の分類。
発表者・機関窓口
発表者
理化学研究所
統合生命医科学研究センター
副センター長 久保 充明(くぼ みちあき)
統計解析研究チーム
チームリーダー 鎌谷 洋一郎(かまたに よういちろう)
大阪大学大学院医学系研究科 遺伝統計学
教授 岡田 随象(おかだ ゆきのり)
九州大学大学院医学研究院 衛生・公衆衛生学分野
教授 二宮 利治(にのみや としはる)
准教授 秦 淳(はた じゅん)
機関窓口
理化学研究所 広報室 報道担当
大阪大学大学院医学系研究科 広報室
九州大学 広報室
AMED事業に関するお問い合わせ
日本医療研究開発機構(AMED)
基盤研究事業部 バイオバンク課