2020-05-12 東京大学,理化学研究所,大阪大学,日本医療研究開発機構
発表者
門脇 孝(東京大学大学院医学系研究科 糖尿病・生活習慣病予防講座 特任教授:研究当時/東京大学 名誉教授)
山内 敏正(東京大学大学院医学系研究科 内科学専攻 代謝・栄養病態学/医学部附属病院 糖尿病・代謝内科 教授)
堀越 桃子(理化学研究所 生命医科学研究センター 糖尿病・代謝ゲノム疾患研究チーム チームリーダー)
鈴木 顕(大阪大学大学院医学系研究科 遺伝統計学 助教)
岡田 随象(大阪大学大学院医学系研究科 遺伝統計学 教授)
発表のポイント
- 40万人規模の東アジア人集団の遺伝情報を用いたゲノムワイド関連解析を行い、筋肉や脂肪の分化やマイクロRNAに関わる遺伝子など、2型糖尿病発症のリスクを高める61の遺伝子領域を新たに同定しました。本研究において対象とした2型糖尿病の症例数は欧米人集団での研究の症例数を凌駕し、世界最大です。この内、日本人集団は約半数を占め、症例数において最も大きな貢献をしています。
- ある1つの領域で同定された独立したシグナル(注1)が、膵臓、脂肪といった異なる組織において、異なる遺伝子の発現を調節することで2型糖尿病発症のリスクを高める可能性が示されました(図)。
- 本研究成果は、2型糖尿病の遺伝要因における脂肪や筋肉などのインスリン感受性に関わる組織・臓器の寄与を示し、2型糖尿病の病態解明や治療薬開発に貢献することが期待されます。
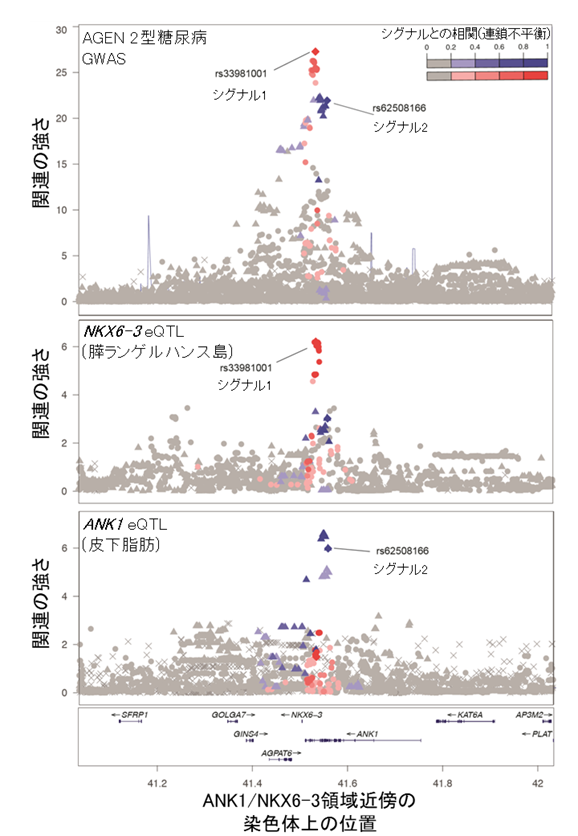
図:ANK1/NKX6-3領域の2つの異なるシグナルは、異なる組織の、異なる遺伝子の発現量に関連している(上段)東アジア人集団における肥満度による補正無しの2型糖尿病GWASのANK1/NKX6-3領域。3つの独立したシグナルが同定された。シグナル1(rs33981001)およびシグナル2(rs62508166)と連鎖不平衡(相関関係)にあるバリアントはそれぞれ赤、青で示されている。
(中段)ANK1/NKX6-3領域における各バリアントと、膵ランゲルハンス島におけるNKX6-3の遺伝子発現量の関連。2型糖尿病シグナル1と高い連鎖不平衡にあるrs12549902は膵ランゲルハンス島におけるNKX6-3の遺伝子発現量と最も強い関連を示した。
(下段)ANK1/NKX6-3領域における各バリアントと、皮下脂肪におけるANK1の遺伝子発現量の関連。2型糖尿病シグナル2と高い連鎖不平衡にあるrs516946は皮下脂肪におけるANK1の遺伝子発現量に最も強い関連を示した。
eQTL(expression quantitative trait loci):発現量的形質遺伝子座。遺伝子発現量を調節する遺伝子領域のこと。
発表概要
2型糖尿病は血糖値が上がることでさまざまな臓器を傷害し、脳卒中・心筋梗塞・腎不全・がんなど、糖尿病以外の数多くの疾患の発症や進行につながる重大な疾患です。日本国内で1,000万人、世界中で4億人以上が2型糖尿病であると言われています。2型糖尿病のかかりやすさは、遺伝要因と環境要因の両方によって影響されますが、欧米人集団に比べ東アジア人集団における2型糖尿病の遺伝要因の理解は不十分でした。
東京大学大学院医学系研究科の門脇孝特任教授(研究当時)、山内敏正教授、理化学研究所 生命医科学研究センターの堀越桃子チームリーダーらの研究グループは、東アジアなどの国々の研究機関との研究を共催し(the Asian Genetic Epidemiology Network (AGEN) consortium、注2)、40万人規模の東アジア人集団の遺伝情報を用いたゲノムワイド関連解析(GWAS、注3)の大規模メタ解析を行い、2型糖尿病発症のリスクを高める遺伝子領域を新たに61箇所同定しました。
本研究において、2型糖尿病の遺伝要因に筋肉や脂肪といったインスリン感受性(注4)に関わる臓器やマイクロRNA(注5)が寄与することが示唆されました。また、1つの遺伝子領域にある独立した異なる2つのシグナルが、異なる臓器における、異なる遺伝子の発現調節を介して2型糖尿病発症のリスクを高める可能性が示唆されました。
これらの結果は東アジア人集団における2型糖尿病の遺伝要因の理解を深めるとともに、将来的には糖尿病の病態解明や治療薬開発に応用できる可能性があります。
なお、本研究の2型糖尿病症例数は約8万人であり、世界最大の症例数です。このうち約半数は日本人集団において実施されたGWAS(文献1)が占めており、バイオバンク・ジャパン(注6)、東北メディカル・メガバンク機構(注7)、多目的コホート研究(JPHC Study)、日本多施設共同コーホート研究(J-MICC Study)よりご協力をいただきました。
本研究は国立研究開発法人日本医療研究開発機構(AMED)のゲノム医療実現推進プラットフォーム事業「先端ゲノム研究開発」(GRIFIN)領域における研究開発課題「糖尿病の遺伝・環境因子の包括的解析から日本発次世代型精密医療を実現するプロジェクト」(研究開発代表者:門脇孝)の一環で行われました。その成果は日本時間2020年5月7日(ロンドン時間 2020年5月6日)に英国科学雑誌 Natureオンライン版に掲載されました。
発表内容
2型糖尿病は、慢性的な高血糖により、さまざまな疾患の危険性を高める重大な疾患であり、日本国内で約1,000万人、世界中で4億人以上が患っていると推測されています。2型糖尿病は民族集団により遺伝要因や病態生理に異なる部分がある可能性が示唆されており、日本人集団を含む東アジア人集団は、欧米人集団に比べ肥満がなくても2型糖尿病を発症しやすいなどの特徴が知られています。東京大学大学院医学系研究科や理化学研究所生命医科学研究センターを含む日本の研究グループはこれまで、日本人集団における2型糖尿病の遺伝的な要因を明らかにするために、大規模なゲノムワイド関連解析(GWAS)を実施し2型糖尿病に関わる遺伝子領域を数多く同定してきました。
今回の研究では、日本におけるこれまでの取り組みをさらに発展させ、東アジア地域における国際的な研究を共同で実施しました(the Asian Genetic Epidemiology Network (AGEN) consortium)。東アジア人集団の2型糖尿病の遺伝素因を解明するために、東アジア人集団における23の2型糖尿病のGWASの結果を統合し、メタ解析を行いました(2型糖尿病 77,418例、対照群 356,122例。この内、日本人2型糖尿病 36,614例、対照群 155,150例)。さらに、肥満度による補正を加えた解析や、男性、女性のみを対象とした層別解析も行いました。これらの解析により、183の遺伝子領域が2型糖尿病と関連しており、うち61領域はこれまでに報告のない新規領域であることが分かりました。同一の遺伝子領域に存在する複数の独立した関連シグナルを同定するために条件付き分析を実施したところ、さらに118のシグナルを同定し、シグナルの総数は301に上りました。
既報のANK1/NKX6-3領域では、今回3つの独立した関連シグナルが見つかりました。このうち、シグナル1(rs33981001)は膵臓のランゲルハンス島(注8)におけるNKX6-3の遺伝子発現を調節するバリアント(注9)と隣接していました(図)。膵臓のランゲルハンス島は血糖値を下げるホルモンであるインスリンを分泌する組織であり、NKX6-3はランゲルハンス島を構成する血糖調節に関わるα細胞(注10)やβ細胞(注11)の発生に関わる遺伝子です。rs33981001の2型糖尿病発症のリスクを上げるアリル(注12)はNKX6-3の遺伝子発現低下と関連していました。一方で、シグナル2(rs62508166)は皮下脂肪組織や骨格筋におけるANK1の遺伝子発現を調節するバリアントと隣接していました。ANK1は骨格筋における糖の取り込みに影響を与えることが知られており、インスリン感受性に関わることが示唆されています。これらの結果から、同一の遺伝子領域にある異なる2つのシグナルが、異なる組織における異なる遺伝子の発現を調節することで、2型糖尿病を発症する危険性に影響を与えることが示唆されました。
次に、各性別に特徴的な2型糖尿病関連領域を探索するため、男性のみ(2型糖尿病 28,027例、対照群 89,312例)、女性のみ(2型糖尿病 27,370例、対照群 135,055例)を対象とした層別解析を行いました。この結果、各性別に特徴的な6つの領域を新たに同定しました。特に、これまでに心血管疾患や血液中の低分子代謝物との関連が男性に比べ女性で強いことが報告されていたCPS1領域(rs1047891)は、本研究において女性を対象とする肥満度による補正を含めた層別解析により2型糖尿病と有意な関連を示しました。
今回同定された2型糖尿病関連領域のうち、2型糖尿病発症リスクに与える効果が男女間で最も大きく異なる領域はALDH2領域(rs12231737)でした。ALDH2領域は男性では2型糖尿病発症リスクと強い関連を示しましたが、女性では全く関連がありませんでした。ALDH2領域は東アジア人集団における適応進化の対象であることが報告されています。また、ALDH2はアルコール代謝に関連する酵素の遺伝子であり、二日酔いの原因物質とされるアセトアルデヒドを酢酸に変換する経路に寄与することが知られています。2型糖尿病発症のリスクを上げるアリルはアルコールへの耐性(強さ)、肥満度・血圧・血中中性脂肪の上昇と関連する一方で、LDLコレステロール(悪玉コレステロール)や心血管疾患の危険性の低下と関連していました。
別の2型糖尿病関連領域には、膵臓のβ細胞で機能する一群のマイクロRNAをコードする領域が含まれていました。これらのマイクロRNAは膵臓のβ細胞に特異的に発現しており、その標的遺伝子はβ細胞のアポトーシス(注13)を促進することが知られています。また、インスリン分泌や膵β細胞の増殖を制御するMIR17HGというマイクロRNAをコードする遺伝子領域も2型糖尿病関連領域に含まれていました。さらに、MIR17HGの標的遺伝子であり、肝臓における糖分(グルコース)の生成に関わるTRAF3遺伝子近傍にも2型糖尿病関連領域が存在しました。以上の知見から、マイクロRNAが2型糖尿病の発症リスクに影響を与えることが示唆されました。
今回の研究で得られた結果は、東アジア人集団における2型糖尿病の遺伝要因の理解を深めるとともに、将来的には2型糖尿病の病態解明や治療薬開発に応用されることが期待されます。
発表雑誌
- 雑誌名:
- 「Nature」
- 論文タイトル:
- Identification of type 2 diabetes loci in 433,540 East Asian individuals
- 著者:
- Cassandra N Spracklen†, Momoko Horikoshi†, Young Jin Kim†, Kuang Lin†, Fiona Bragg, Sanghoon Moon, Ken Suzuki, Claudia HT Tam, Yasuharu Tabara, Soo-Heon Kwak, Fumihiko Takeuchi, Jirong Long, Victor JY Lim, Jin-Fang Chai, Chien-Hsiun Chen, Masahiro Nakatochi, Jie Yao, Hyeok Sun Choi, Apoorva K Iyengar, Hannah J Perrin, Sarah M Brotman, Martijn van de Bunt, Anna L Gloyn, Jennifer E Below, Michael Boehnke, Donald W Bowden, John C Chambers, Anubha Mahajan, Mark I McCarthy, Maggie CY Ng, Lauren E Petty, Weihua Zhang, Andrew P Morris, Linda S Adair, Masato Akiyama, Zheng Bian, Juliana CN Chan, Li-Ching Chang, Miao-Li Chee, Yii-Der Ida Chen, Yuan-Tsong Chen, Zhengming Chen, Lee-Ming Chuang, Shufa Du, Penny Gordon-Larsen, Myron Gross, Xiuqing Guo, Yu Guo, Sohee Han, Annie-Green Howard, Wei Huang, Yi-Jen Hung, Mi Yeong Hwang, Chii-Min Hwu, Sahoko Ichihara, Masato Isono, Hye-Mi Jang, Guozhi Jiang, Jost B Jonas, Yoichiro Kamatani, Tomohiro Katsuya, Takahisa Kawaguchi, Chiea-Chuen Khor, Katsuhiko Kohara, Myung-Shik Lee, Nannette R Lee, Liming Li, Jianjun Liu, Andrea O Luk, Jun Lv, Yukinori Okada, Mark A Pereira, Charumathi Sabanayagam, Jinxiu Shi, Dong Mun Shin, Wing Yee So, Atsushi Takahashi, Brian Tomlinson, Fuu-Jen Tsai, Rob M van Dam, Yong-Bing Xiang, Ken Yamamoto, Toshimasa Yamauchi, Kyungheon Yoon, Canqing Yu, Jian-Min Yuan, Liang Zhang, Wei Zheng, Michiya Igase, Yoon Shin Cho, Jerome I Rotter, Ya-Xing Wang, Wayne HH Sheu, Mitsuhiro Yokota, Jer-Yuarn Wu, Ching-Yu Cheng, Tien-Yin Wong, Xiao-Ou Shu, Norihiro Kato, Kyong-Soo Park, E-Shyong Tai, Fumihiko Matsuda, Woon-Puay Koh, Ronald CW Ma, Shiro Maeda, Iona Y Millwood, Juyoung Lee, Takashi Kadowaki*, Robin G Walters*, Bong-Jo Kim*, Karen L Mohlke*, and Xueling Sim*
†: 共同筆頭著者、*: 共同責任著者 - DOI番号:
- 10.1038/s41586-020-2263-3
- アブストラクトURL:
- https://www.nature.com/articles/s41586-020-2263-3
用語解説
- (注1)シグナル
- 疾患や形質に関連する1つの領域内に、複数の統計学的に独立した関連を示す部分領域が存在することがあり、これをシグナルという。
- (注2)the Asian Genetic Epidemiology Network (AGEN) consortium
- 東アジアにおける2型糖尿病や心血管疾患のゲノム疫学研究を促進することを目標に設立されたコンソーシアム 。
URL:https://blog.nus.edu.sg/agen/ - (注3)ゲノムワイド関連解析(Genome-wide association study; GWAS)
- 糖尿病などの疾患や体重などの量的な形質に影響があるゲノム上の変異を、網羅的に検索する手法。2002年に、理化学研究所が世界に先駆けて報告を行っており、以降、さまざまな疾患や量的形質に関連する感受性遺伝子領域の同定に貢献している。
- (注4)インスリン感受性
- インスリンの効きやすさ。インスリンは血糖値を下げるホルモンであるが、同じインスリン量でもインスリン感受性が高いと血糖値の下がり幅は大きくなる。
- (注5)マイクロRNA
- 遺伝子の発現を調節する機能を持つ20から25塩基長の短いRNA。
- (注6)バイオバンク・ジャパン
- 日本人集団27万人を対象とした生体試料バイオバンクで、ゲノム解析が終了した人数は約20万人とアジア最大である。オーダーメイド医療の実現プログラムを通じて実施され、ゲノムDNAや血清サンプルを臨床情報と共に収集し、研究者へのデータ提供や分譲を行っている。
URL:https://biobankjp.org/ - (注7)東北メディカル・メガバンク機構
- 東北メディカル・メガバンク計画では、東日本大震災からの復興と、個別化予防・医療の実現を目指している。東北大学東北メディカル・メガバンク機構と岩手医科大学いわて東北メディカル・メガバンク機構を実施機関として、東日本大震災被災地の医療の創造的復興および被災者の健康増進に役立てるために、平成25年より合計15万人規模の地域住民コホート調査および三世代コホート調査等を実施して、試料・情報を収集したバイオバンクを整備している。東北メディカル・メガバンク計画は、平成27年度より、国立研究開発法人日本医療研究開発機構(AMED)が本計画の研究支援担当機関の役割を果たしている。
- URL:https://www.megabank.tohoku.ac.jp/
- (注8)ランゲルハンス島
- 膵臓の内部に島の形で散在する、インスリンなどのホルモンを分泌する細胞群。
- (注9)バリアント
- ヒトの遺伝情報はA, T, C, Gの4種類の塩基からなるDNA配列に保存されている。ヒトの遺伝情報全体をヒトゲノムというが、その長さは30億といわれている。ヒトゲノムはそのほとんど(99%以上)がすべてのヒトで同じですが、ごく一部だけ違いがある場所がある。この個人間の違いがある部分をバリアントという。
- (注10)α細胞
- 膵臓のランゲルハンス島に存在し、血糖値を上げるホルモンであるグルカゴンを分泌する細胞。
- (注11)β細胞
- 膵臓のランゲルハンス島に存在し、血糖値を下げるホルモンであるインスリンを分泌する細胞。
- (注12)アリル
- 塩基配列に個人間の違いがあるバリアントでは、ヒトが持ちうる塩基配列の型が複数生じえる。この塩基配列の型をアリルという。
- (注13)アポトーシス
- 細胞の増え方を制御するために、生体内で管理・調節されながら引き起こされる細胞死。
参考文献
1. Suzuki, K., Akiyama, M., Ishigaki, K., Kanai, M., Hosoe, J., Shojima, N., Hozawa, A., Kadota, A., Kuriki, K., Naito, M., Tanno, K., Ishigaki, Y., Hirata, M., Matsuda, K., Iwata, N., Ikeda, M., Sawada, N., Yamaji, T., Iwasaki, M., Ikegawa, S., Maeda, S., Murakami, Y., Wakai, K., Tsugane, S., Sasaki, M., Yamamoto, M., Okada, Y., Kubo, M., Kamatani, Y., Horikoshi, M., Yamauchi, T., Kadowaki, T. (2019). Identification of 28 new susceptibility loci for type 2 diabetes in the Japanese population. Nature Genetics 51(3), 379 – 386.
お問い合わせ先
研究内容に関するお問い合わせ先
東京大学名誉教授 門脇 孝(かどわき たかし)
東京大学医学部附属病院 糖尿病・代謝内科
教授 山内 敏正(やまうち としまさ)
理化学研究所 生命医科学研究センター
糖尿病・代謝ゲノム疾患研究チーム
チームリーダー 堀越 桃子(ほりこし ももこ)
大阪大学大学院 医学系研究科 遺伝統計学
教授 岡田 随象(おかだ ゆきのり)
大阪大学大学院 医学系研究科 遺伝統計学
助教 鈴木 顕(すずき けん)
広報担当者連絡先
東京大学医学部附属病院
パブリック・リレーションセンター(担当:渡部、小岩井)
理化学研究所 広報室 報道担当
電話:048-467-9272
大阪大学大学院医学系研究科 広報室
事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
ゲノム・データ基盤事業部 ゲノム医療基盤研究開発課