IL-34を標的とした新規治療法の開発に期待
2020-10-21 北海道大学,順天堂大学,かずさDNA研究所,日本医療研究開発機構
ポイント
- 腫瘍由来IL-34が、免疫チェックポイント阻害療法に対する抵抗性の獲得に寄与することを発見。
- IL-34の作用阻害が、腫瘍内の炎症性マクロファージ及びT細胞の割合を増加させることを発見。
- IL-34標的治療が、免疫チェックポイント阻害療法の治療効果を高めることを初めて証明。
概要
北海道大学遺伝子病制御研究所の清野研一郎教授、順天堂大学医学部免疫学講座の八木田秀雄先任准教授、かずさDNA研究所ゲノム事業推進部の長谷川嘉則チーム長、DNA-Link社のイ・ヒギョン博士らの研究グループは、がん細胞が産生する液性生理活性因子インターロイキン-34(IL-34)*1が、抗PD-1*2抗体治療をはじめとした免疫チェックポイント阻害療法*3(Immune checkpoint blockade、以下ICB)に対する抵抗性の獲得に寄与することを発見しました。
外科的療法、薬物療法、放射線療法に次いで新たに確立された免疫療法は、本来ヒトに備わっている免疫の力を高めることにより、がんを縮小させることを目的とした治療法です。中でもPD-1やCTLA-4*4をはじめとした免疫チェックポイント分子の働きを阻害するICBは、悪性黒色種をはじめとしたいくつかのがんの治療として、既に実臨床(実際の臨床)での使用が認められています。一方で、ICBに対し治療抵抗性を示すがん患者が多いことが報告されており、実際に治療効果が得られるのは治療を受けた患者全体の20~30%に留まっています。そのため、ICB治療抵抗性を解除し得る新規治療法の確立を目的とした研究が世界中で行われています。
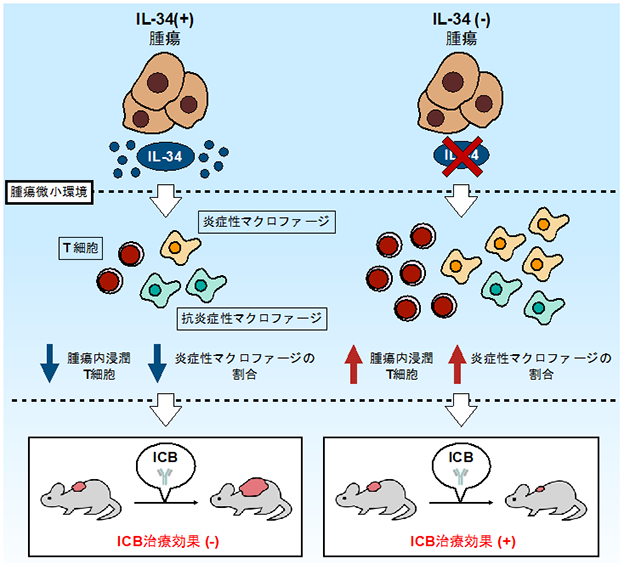
清野教授らの研究グループは、がん細胞を由来とするIL-34の発現及び作用を阻害することで、抗腫瘍効果を有するとされる炎症性マクロファージ*5と、腫瘍細胞に対する攻撃の要であるT細胞*6の腫瘍内における割合が増加し、その結果、本来ICB治療に対し抵抗性を示していた腫瘍に対しても治療効果が得られるようになることを明らかにしました。また、抗IL-34抗体をICB治療時に併用することで、その治療効果が高まることを示し、さらに免疫系をヒト化したマウスモデルを用いた実験により、実臨床に近い条件においても同様の傾向にあることを示唆する結果を報告しました(参考図)。
本結果は、がん細胞由来のIL-34を標的とした治療がICBの治療効果を高めることを示すものであり、ICB抵抗性を有するがん患者に対する新規治療法の開発に繋がるものと期待されます。
なお、本研究成果は、2020年9月19日(土)公開のiScience誌にオンライン掲載されました。
背景
PD-1やCTLA-4をはじめとした免疫チェックポイント分子は、腫瘍微小環境における免疫細胞を主とした様々な細胞の表面に発現しており、腫瘍細胞に対する免疫反応を負に調節します。近年、それらの分子の働きを阻害する免疫チェックポイント阻害療法(ICB)ががんの新たな治療法として確立され、外科療法、薬物療法、放射線療法に次ぐ第4の手法としてその適応対象を拡大し続けています。その一方で、ICBの治療効果はがんの種類やがん組織を構成する微小環境、あるいは対象患者体内の免疫環境等に大きく依存し、治療感受性を示す患者は治療を受けた患者全体の20~30%に留まるといわれています。そのため、ICBに対する治療抵抗性を解除し得る方法が日々模索されています。
IL-34は2008年に初めて同定された液性生理活性因子であり、正常なヒトにおけるその発現は脳や皮膚に限定されることが知られています。近年様々ながん種の病巣においてもIL-34の発現が確認され、がんの進行や転移に関与することが報告されています。また、清野教授らのグループは過去に、肺がん細胞由来のIL-34が、抗がん剤を用いた治療に対する抵抗性の獲得に寄与することを報告しました。しかし、多くのがん種が有するとされるICB治療抵抗性とIL-34の関係性は不明なままでした。そこで本研究では、がん細胞を由来とするIL-34とICB治療への抵抗性の獲得に何らかの関係性があるという仮説のもと、IL-34標的治療を基軸としたICB抵抗性解除法の確立を目的としました。
研究手法
本研究では、マウスを由来とする3種のがん細胞株(卵巣がん:HM-1、大腸がん:CT26、乳がん:4T1)を準備し、IL-34を恒常的に発現する株に加え、遺伝子編集手法であるCRISPR-Cas9システム*7を用いてIL-34をノックアウト*8した株を作製しました。これらの細胞株を実験用マウスの皮下に移植して腫瘍を形成させ、ICB治療を施した後に腫瘍の大きさを経過観察することで、がん細胞由来IL-34の有無によって生じるICB治療効果の差を比較しました。
また、腫瘍内に浸潤する免疫細胞を解析することで、がん細胞由来のIL-34が存在する腫瘍内の免疫環境とICB抵抗性獲得の関係性を調査しました。さらに、体内の免疫系がヒト化された実験用マウスに、ヒトのがん組織を移植したモデルを用い、抗ヒトIL-34抗体及び抗ヒトPD-1抗体による併用治療を行うことで、より臨床に近い条件でIL-34標的治療の有用性を検討しました。
研究成果
マウス由来のがん細胞を用いた実験の結果から、IL-34を産生する腫瘍がICB抵抗性を有するのに対し、その発現を消失させた腫瘍はICB治療に対し感受性を示すことを明らかにしました。また、がん細胞由来のIL-34を欠損したがん微小環境において、抗腫瘍免疫の活性化に関わる様々な液性生理活性因子の遺伝子発現が上昇していることがわかりました。
次に、腫瘍内に浸潤する免疫細胞の動態を解析することで、がん細胞由来のIL-34の発現阻害が、免疫応答を活発化する炎症性マクロファージと、がんを攻撃する働きを担うT細胞の腫瘍内における割合を増加させることを明らかにしました。また、IL-34陽性腫瘍に対し、抗IL-34抗体治療及びICB治療を行う群の腫瘍は、ICB単剤による治療群と比べ、縮小することを示しました。さらに、体内の免疫系がヒトに置換されている特殊なマウスを用いた実験では、抗ヒトIL-34抗体及び抗ヒトPD-1抗体の併用療法を行う群の3匹中2匹で、比較群よりも腫瘍が縮小しました。
これらの結果より、がん細胞から産生されるIL-34を標的とした治療は、ICB抵抗性を示す患者に対して有用な新規治療法となる可能性があると考えられます。
今後への期待
本研究によって、がん細胞由来のIL-34の働きを阻害することで、一部のがん種のICB抵抗性を解除し得ることが示されました。本研究成果は、IL-34とICB治療を紐づけた初めての報告であり、今後IL-34を標的とした新規治療法が確立されると同時に、腫瘍におけるICB抵抗性獲得のメカニズムの解明がより進むことが期待されます。
研究費・研究支援
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の革新的がん医療実用化研究事業「IL34を基軸としたがん微小環境分子基盤の理解とその臨床的特性に基づいた新しい治療法の開発」(研究開発代表者:清野研一郎)より支援を受けて行われました。
論文情報
- 論文名
- Interleukin-34 limits the therapeutic effects of immune checkpoint blockade(インターロイキン-34は免疫チェックポイント阻害療法の治療効果を抑制する)
- 著者名
- 羽馬直希1、小林拓斗1、韓ナヌミ1、北川郁人1、梶原ナビール1、大塚亮1、和田はるか1、Hee-kyung Lee2、Hwanseok Rhee2、長谷川嘉則3、八木田秀雄4、Muhammad Baghdadi1、清野研一郎1(1北海道大学遺伝子病制御研究所免疫生物分野、2DNA Link社、3公益財団法人かずさDNA研究所ゲノム事業推進部、4順天堂大学医学部免疫学講座)
- 雑誌名
- iScience
- DOI
- 10.1016/j.isci.2020.101584
- 公表日
- 2020年9月19日(土)(オンライン公開)
用語解説
- *1 インターロイキン-34(IL-34)
- インターロイキンとは白血球から分泌されるタンパク質の総称で、細胞同士の情報伝達を担うものを指す。30種類以上が発見されており、IL-34は34番目に同定された。
- *2 PD-1
- Programmed cell Death-1の略称。免疫チェックポイント分子の一種である。T細胞を始めとした様々な免疫細胞の表面に発現し、PD-L1を結合することで活性化を抑えるシグナルを細胞内に伝える働きをもつ。
- *3 免疫チェックポイント阻害療法(ICB)
- 免疫チェックポイント分子は体内の免疫恒常性を保つために自己に対する免疫応答や、過剰な免疫反応を抑制する働きを有する分子群を指す。発がん過程においては、がん細胞が免疫チェックポイント分子を利用して免疫反応から逃避する働きをもつようになることから、その働きを阻害し、免疫反応を活性化させる治療法が免疫チェックポイント阻害療法(ICB)である。
- *4 CTLA-4
- Cytotoxic T-lymphocyte-associated protein-4の略称。PD-1と同様、免疫チェックポイント分子の一種であり、主にT細胞の細胞表面に発現している。取り込んだ異物の情報を周囲の細胞に伝達する働きをもつ抗原提示細胞の表面に発現するCD80もしくはCD86と呼ばれる分子と結合することで、T細胞の活性を抑制するシグナルを細胞内に伝える働きをもつ。
- *5 マクロファージ
- 免疫細胞である骨髄由来細胞の一種。腫瘍環境内では免疫反応を活性化する炎症性と、その活性化を抑制する抗炎症性のマクロファージが存在すると言われている。
- *6 T細胞
- 免疫細胞であるリンパ球の一種。腫瘍を攻撃する役割を担う細胞であり、多くのがん種において腫瘍内に多く浸潤しているほど患者の予後が良いとされる。
- *7 CRISPR-Cas9システム
- DNA配列中の任意の部分を切断できる遺伝子改変ツール。切断したい部分に結合するように設計された短い塩基配列と、DNA切断酵素であるCas9 タンパク質を発現するために必要な遺伝子配列を同時に細胞に導入することで、DNA配列中の任意の部分を切断・編集することが可能となる。
- *8 ノックアウト
- 細胞があるタンパク質を産生するために必要不可欠な遺伝子を人為的操作で編集し、その産生を消失させること。
お問い合わせ先
研究内容に関すること
北海道大学遺伝子病制御研究所免疫生物分野 教授 清野研一郎(せいのけんいちろう)
順天堂大学医学部免疫学講座 先任准教授 八木田秀雄(やぎたひでお)
配信元
北海道大学総務企画部広報課
順天堂大学総務局総務部文書・広報課
公益財団法人かずさDNA研究所広報・研究推進グループ
AMEDに関すること
国立研究開発法人日本医療研究開発機構(AMED)
疾患基礎研究事業部疾患基礎研究課
革新的がん医療実用化研究事業事務局