2020-10-30 京都大学iPS細胞研究所,日本医療研究開発機構
ポイント
- ヒトiPS細胞由来膵前駆細胞注1)の増殖培養法の開発は再生医療用膵β細胞注2)の安定した供給につながる。
- ヒトiPS細胞由来膵前駆細胞がWNT7B注3)による非古典的Wnt経路注4)の活性化によって増殖する機構を明らかにした。
- WNT7Bを用いたヒトiPS細胞由来膵前駆細胞の増殖培養法を開発した。
要旨
インスリン注5)を分泌する膵β細胞をヒト多能性幹細胞(ES細胞およびiPS細胞)から作製し、皮下などに移植する再生医療(細胞療法)は、糖尿病の根治的な治療法の1つとして期待されています。しかし、実現に向けては膵臓のもととなる細胞である膵前駆細胞を効率よく安定して大量に作製する課題がありました。これまでの研究で、膵前駆細胞の増殖を促進する化合物としてAT7867が同定されていましたが(Kimura et al., 2017)、膵臓の発生や増殖機構については分かっていないことが未だ多く、AT7867の作用をさらに詳しく調べる必要がありました。
今回、木村東研究員(CiRA増殖分化機構研究部門)および長船健二教授(CiRA同部門)らの研究グループは、siRNA注6)を使ったスクリーニングによってWNT7Bというタンパク質がAT7867によって作られる膵前駆細胞の増殖因子であることを解明し、WNT7Bを用いることでヒトiPS細胞から膵前駆細胞を大量に作製することに成功しました。さらに、AT7867がYY1という転写因子のリン酸化を抑えることによって、WNT7Bの生成を上昇させることと、WNT7Bが膵前駆細胞を増殖させる過程はβ-カテニン注7)を介さない経路であることも突き止めました。膵前駆細胞が大量に作製されるしくみを解明した本研究成果は、将来、糖尿病治療に向けて必須となる細胞の安定供給の技術へと繋がることが期待されます。
この研究成果は2020年10月30日午前0時(日本時間)に米国科学誌「Cell Chemical Biology」でオンライン公開されます。
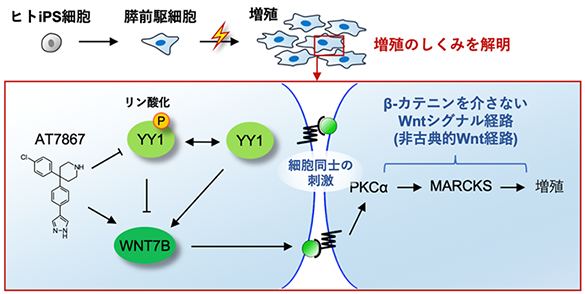
図1:論文の概要図
研究の背景
日本で10万人以上の患者さんがいると推計される1型糖尿病は、インスリンを作る膵β細胞が減ってしまうことにより起こる病気です。膵臓や膵島注8)の移植によって膵β細胞を補充する方法が糖尿病根治に向けた治療法の一つですが、移植用の膵臓不足が問題となっています。このため、膵β細胞の供給源としてヒト多能性幹細胞(ES細胞およびiPS細胞)からの膵臓細胞・組織の作製研究が進められています。しかし、臨床応用に向けて、ヒト多能性幹細胞から膵β細胞を作るまでのステップが多く、コストが高くなることが課題であり、より多くの患者さんに届けられる治療法とするためには、膵β細胞の前段階である膵前駆細胞を大量に安定して作製する技術を確立する必要があります。
研究グループはこれまで、ヒトiPS細胞から作製した膵前駆細胞を増殖させる活性を有するAT7867という化合物を見出しておりましたが(Kimura et al., 2017)、AT7867がどの物質と作用して膵前駆細胞の増殖につながるのかをさらに詳しく解明することによって、より高効率の膵前駆細胞の増殖培養法の開発が期待されておりました。
研究結果
1)AT7867がWNT7B発現を介して膵前駆細胞の増殖を促進させることを突き止めた。
AT7867がどの遺伝子に作用して膵前駆細胞を増殖させるのかを調べました。AT7867を加えた膵前駆細胞に遺伝子の機能を抑制するRNA干渉注9)を用いてスクリーニングを行いました(図2)。590の候補遺伝子について、膵前駆細胞の増殖を調べたところ、WNT7Bという遺伝子が有力な遺伝子であることが分かりました。次に、AT7867を含まないで、ヒトのWNT7Bタンパク質とほぼ同じ活性を有するマウスのWnt7bタンパク質を含む条件のもとで膵前駆細胞を培養したところ、他のタンパク質と比べ膵前駆細胞がより高効率に増殖していることが分かりました(図3)。これらの結果から、AT7867から膵前駆細胞の増殖における過程で、WNT7Bが関わっていることが分かりました。
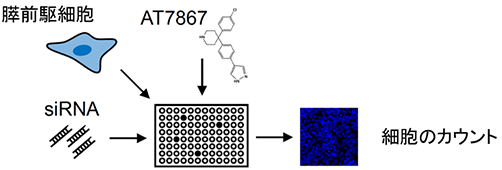
図2:siRNA(RNA干渉)を使ったスクリーニング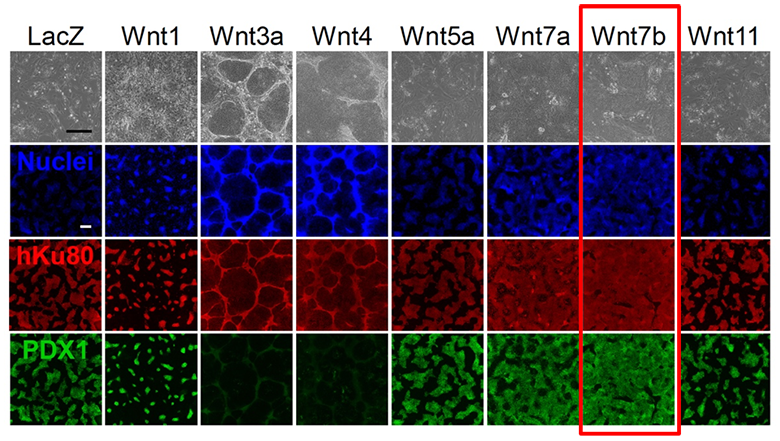
図3:8種類の培養液で4日間培養し、免疫発光させた膵前駆細胞最上段は光学顕微鏡で観察した細胞の像、青は細胞核、赤はヒトの細胞、緑は膵前駆細胞を示す。スケールバーは300μm。
2)YY1という転写因子がWNT7Bの生成に関わっていることを突き止めた。
さらに、AT7867がWNT7Bを活性化する具体的な経路について調べるため、AT7867を与えた細胞とAT7867と構造が類似しているものの膵前駆細胞の増殖活性のない化合物を与えた細胞の違いを、質量分析装置を用いたリン酸化プロテオーム注10)解析により調べました。すると、Yin Yang1(YY1)という転写因子がWNT7Bの生成に関わっていることが分かりました。具体的には、AT7867がYY1のリン酸化を防ぐことでWNT7Bの生成を上昇させることが示されました。実際に、siRNAスクリーングを行いYY1の遺伝子発現を減弱させると、膵前駆細胞の増殖が抑制されることが分かりました(図4)。これらの結果から、AT7867とWNT7Bの相互作用においてYY1因子が介在し、YY1因子の有無によって膵前駆細胞の増殖に影響があることが分かりました。
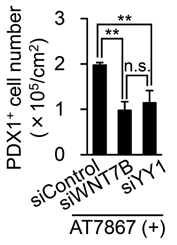
図4:siRNAで遺伝子発現を減弱させた後の膵前駆細胞数の比較YY1の発現を減弱させたときに細胞増殖が有意に抑制されることが分かった。縦軸は膵前駆細胞数、横軸はAT7867を含む培養条件のもとで発現を減弱させた遺伝子名を示す。
3)WNT7Bからβ-カテニンを経由しないで膵前駆細胞が作られていることが分かった。
これまでのマウスの研究では、タンパク質Wnt3a、Wnt4、Wnt7a、Wnt7bはβ-カテニンを介してWntシグナルの経路を活性化すること(古典的Wnt経路)が報告されていました。そこで、AT7867からWNT7Bを経て膵前駆細胞が作製される過程におけるβ-カテニンの関与について確認するため、TCF/LEFルシフェラーゼ注11)の活性を調べました。すると、興味深いことに、AT7867やWNT7Bを経て膵前駆細胞が作製される過程において、β-カテニンが介在しない非古典的Wnt経路を経ていることが分かりました。このことは、ヒトとマウスでは膵臓の発生過程に違いがあることを意味します。
また、これまでの研究で、WNT7Bからの非古典的Wnt経路ではプロテインキナーゼC(PKC)注12)が介在していることが知られているため、PKCと関わりのある遺伝子をsiRNAでスクリーニングを行いました。すると、PKCαとMARCKSという遺伝子の発現が減弱された場合、膵前駆細胞の増殖が抑制されることが分かりました(図5)。これらの結果から、ヒトの膵前駆細胞の増殖機構は非古典的Wnt経路で、PKCαとMARCKSが関わっていることが分かりました。
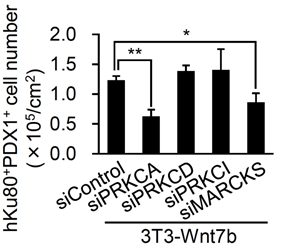
図5:siRNAで遺伝子発現を減弱させた後の膵前駆細胞数の比較PRKCA(PKCα)とMARCKSの発現を減弱させたときに細胞増殖が有意に抑制されることが分かった。縦軸は膵前駆細胞数、横軸はマウスのWnt7bタンパク質を含む培養条件のもとで発現を減弱させた遺伝子名を示す。
本研究の意義と今後の課題
本研究では、ヒトの膵前駆細胞の増殖過程はWNT7Bと非古典的Wnt経路が関わっていることを初めて突き止めました。この機構はこれまで知られていた古典的Wnt経路でのマウスの膵前駆細胞の増殖過程と異なることを示し、ヒト膵臓の発生機構の新たな知見となります。また、安定化または活性化したWNT7BがAT7867より高効率に膵前駆細胞を増殖させる大量生成の鍵となることを示した本研究成果は、将来、1型糖尿病に対する再生医療における膵β細胞の安定供給の技術の開発へと繋がります。
論文名と著者
- 論文名
- “Combined Omics Approaches Reveal the Roles of Non-canonical WNT7B Signaling and YY1 in the Proliferation of Human Pancreatic Progenitor Cell.”
- ジャーナル名
- Cell Chemical Biology
- 著者
- Azuma Kimura1*, Taro Toyoda1, Mio Iwasaki1, Ryusuke Hirama2 and Kenji Osafune1**
- 著者の所属機関
- 1.京都大学iPS細胞研究所(CiRA)
2.味の素株式会社バイオ・ファイン研究所
*:筆頭著者、**:責任著者
本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 国立研究開発法人日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム iPS細胞研究中核拠点
- 日本学術振興会(JSPS)科研費[17J07622][18K08510]
- 公益財団法人母子健康協会
用語説明
- 注1)膵前駆細胞
- 受精卵が分裂・成長してさまざまな細胞に変化していくときに生じる、膵臓のもとになる細胞。
- 注2)膵β細胞
- 膵臓ランゲルハンス島に存在する、血糖値に応じてインスリンを血中に分泌する細胞。1型糖尿病患者ではこの膵β細胞が何らかの原因により破壊されるため、血中のインスリンが不足し、高血糖を呈する。
- 注3)WNT7B
- ヒトの膵臓の発達に重要な役割をするタンパク質および遺伝子の一種。Wnt7bはWNT7Bと同等の機能を持つマウスのタンパク質および遺伝子。細胞外に放出されて、他の細胞表面にある受容体と結合し、その細胞の中でWNTシグナル経路と呼ばれる一連のシグナル伝達を活性化する。
- 注4)非古典的Wnt経路
- β-カテニンを介さないWntシグナル経路。Wntシグナル経路には大きく分けて二種類あり、β-カテニンを介して遺伝子発現するWntシグナルの経路は古典的Wnt経路と呼ばれ、それ以外の経路は非古典的Wnt経路と呼ばれる。
- 注5)インスリン
- 血糖値を下げるはたらきをもつホルモン。
- 注6)siRNA(small interfering RNA)
- 21-23塩基対からなる低分子二本鎖RNA。細胞内に導入することで、二本鎖だったsiRNAは酵素の働きを受けて一本鎖に解離し、mRNAの破壊によって遺伝子の発現を抑制する。この現象をRNA干渉注9)という。
- 注7)β-カテニン
- Wntシグナル(標的遺伝子の転写を促進するシグナル伝達機構の一つ)のシグナル伝達因子。核内で転写因子(TCF/LEF)と結合し、細胞の増殖や発生運命の決定に関わる遺伝子の転写を活性化する。
- 注8)膵島
- 膵臓ランゲルハンス島のこと。膵臓の内部に島のような形状で散在する膵α細胞や膵β細胞などの内分泌細胞の集まり。
- 注9)RNA干渉(RNAi)
- 細胞内で形成される二本鎖RNA(siRNA注6))により、任意の遺伝子の発現を抑制する手法。
- 注10)プロテオーム
- ある生物が持つゲノム情報によって作られる全てのタンパク質のセット、またはある細胞がある瞬間に発現している全てのタンパク質のセット。個々のタンパク質の構造や機能、細胞や組織内で発現しているタンパク質の網羅的な解析によるタンパク質間相互作用の理解を目指した研究をプロテオーム解析と呼ぶ。複雑なタンパク質間相互作用の理解は、より効率的な診断手法や治療法の開発が可能になると考えられている。
- 注11)TCF/LEFルシフェラーゼ
- TCF/LEF転写因子が結合し転写誘導する配列をルシフェラーゼ遺伝子に組み込んだもの。β-カテニンが介在する場合、β-カテニンは核内でTCF/LEF転写因子に結合し、Wnt応答遺伝子の転写や発現を誘導する性質を持つ。この過程にルシフェラーゼ遺伝子を組み込むことにより、ルシフェラーゼ遺伝子の転写が誘導されるため、ルシフェラーゼの活性(発光)を調べることで、β-カテニンの介在の有無を確認できる。
- 注12)プロテインキナーゼC(PKC)
- タンパク質分子をリン酸化する酵素の一種。この酵素の働きによりリン酸化(リン酸基H2PO4–を付加させる化学反応)されたタンパク質は構造が変わり、情報を伝達することができる。プロテインキナーゼCは少なくとも10種類以上の分子種の存在が知られている。
お問い合わせ先
京都大学iPS細胞研究所(CiRA)研究支援部門
国際広報室 大内田美沙紀
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
再生・細胞医療・遺伝子治療事業部 再生医療研究開発課