2021-06-21 京都大学iPS細胞研究所,日本医療研究開発機構
ポイント
- iPS細胞由来の骨格筋細胞における、電気刺激を用いた収縮力評価システムを確立した。
- デュシェンヌ型筋ジストロフィー患者由来iPS細胞において、コントロール株注1)と比較して筋疲労に似た収縮力低下を再現することに成功した。
- 筋疲労に似た収縮力低下を改善する化合物を見つけた。
- 光遺伝学技術注2)を用いて、収縮力低下を指標とするスクリーニング系を構築した。
要旨
内村智也研究員(京都大学CiRA臨床応用研究部門、T-CiRA共同研究プログラム)、櫻井英俊准教授(京都大学CiRA臨床応用研究部門、T-CiRA共同研究プログラム)らの研究グループは、デュシェンヌ型筋ジストロフィー(DMD)由来iPS細胞を用いてDMD患者さんに見られる筋疲労に似た収縮力低下を再現することに成功しました。また、この収縮力低下を改善するような化合物を見出し、更により多くの化合物を評価する為のスクリーニング系の構築を行いました。これにより、既存薬とは異なる効能を持つ創薬開発の実現に貢献できると期待されます。
この研究成果は2021年6月5日午前0時(日本時間)に米国科学誌「Cell Reports Medicine」でオンライン公開されました。
研究の背景
DMDは、筋肉にあるジストロフィンタンパク質が欠損することによって発症する進行性の重篤な筋疾患で、現在治療薬は限られており根本的な治療方法は開発されていません。
現在DMDの治療薬としてはステロイド剤が主に使用されていますが、病気の進行を2~3年程度遅らせるのみに留まっており、根治に至るまたは発症そのものを抑制するような治療薬の開発が切望されています。近年iPS細胞を利用したDMDの病態研究や創薬研究が活発になってきていますが、機能的な病態を再現するには至っておらず、よりDMD患者さんの症状を反映した病態モデルの開発が求められています。
そこで本研究グループは、患者由来ヒトiPS細胞から分化させた骨格筋細胞を用いて、骨格筋の機能に着目した解析方法の開発を目指して研究を行いました。
研究結果
(1)DMD患者由来iPS細胞から分化誘導した成熟筋細胞を用いて、筋疲労に似た収縮力低下を再現
本研究グループは、骨格筋細胞の機能性を評価する為に、まずiPS細胞からより成熟化した筋細胞への分化誘導法を電気刺激とコラーゲンゲルを用いて開発しました。柔らかいコラーゲンゲルの上で培養する事で、従来のプラスチック上では不可能であった、より細胞にとって適した硬さを有する足場での培養が可能になりました。また、長期間電気刺激による培養を行う事で、筋細胞が成熟化し収縮力など機能評価に適した状態まで誘導することに成功しました。実際に、この方法で分化した筋細胞では、筋組織成熟度を表す細胞融合指数として細胞内の核の数を計測する解析において8~9割の細胞が複数個の核を有しており、細胞融合が促進されていました(図1A)。また、成熟した筋細胞の特徴であるサルコメア構造注3)も有していました(図1BとC)。
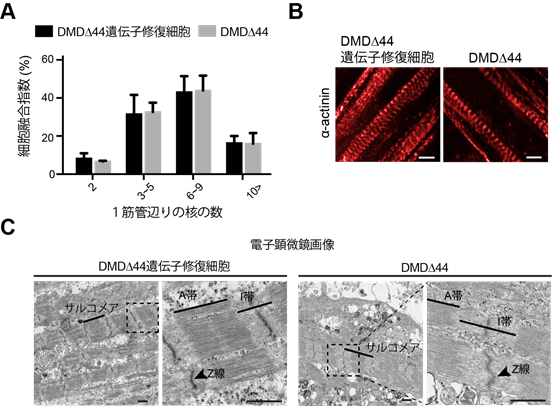
図1 DMD患者由来ヒトiPS細胞から骨格筋細胞への分化誘導と成熟化培養A:分化後17日目における筋管の細胞融合指数の結果。細胞同士が融合した事により、1筋管辺りの核の数が複数個ある細胞が90%を超えていることが分かる。解析には、核数を2個以上有している細胞を筋管細胞として定義した。
B:分化後17日目におけるサルコメア構造を表す蛍光顕微鏡画像。
C:分化後17日目におけるサルコメア構造を表す電子顕微鏡画像。
次に、成熟化した筋細胞を用いて電気刺激による収縮機能の評価を行いました。機能評価には、2例の異なるDMD患者さんから樹立したiPS細胞株(DMD∆44およびDMD∆46-47)と、1例の健常人由来iPS細胞のDMD遺伝子注4)に変異を入れて病気の状態にしたiPS細胞株(409B2 ex45ノックアウト)を用いました。電気刺激による連続収縮下において、どの株でも培養17~20日頃では収縮力に差が認められなかったことから、筋管細胞1本1本の最大収縮機能には違いが無いことが推測されます。一方で、長期間連続収縮(1週間以上)させていくと、ジストロフィンタンパク質を発現していないDMD細胞では顕著に収縮力が低下していくことが認められました。このことから、ジストロフィンタンパク質が無いと徐々に収縮機能が低下していく、つまり患者さんに見られる症状である筋疲労の蓄積に似た現象が再現されたと考えました(図2)。
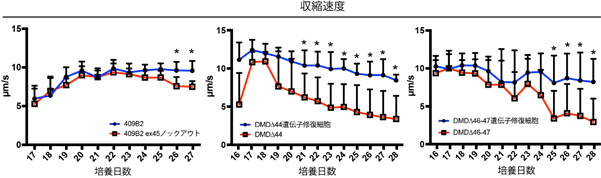
図2 ジストロフィンタンパク質欠損iPS細胞由来筋管における、筋疲労蓄積時に似た筋収縮力の低下解析。左パネル:409B2 ex45ノックアウト注5)、中央パネル:DMD∆44、右パネル:DMD∆46-47の計3つの異なるDMD-iPS細胞株を用いて解析。*p値が0.05未満を統計学的に有意とみなした。
(2)収縮力低下を改善する化合物の同定
次に、本研究グループは筋疲労に似た収縮力低下を改善するような化合物の探索を行いました。使用した化合物には、既に臨床で使用されているステロイド剤(デフラザコート)や過去に動物モデルで効果があると発表された化合物、更にカルシウムの過剰流入注6)を妨げる化合物など計30以上の化合物をテストしました。ステロイド剤では、特に収縮力低下を改善する効果は見られませんでした。一方で、筋弛緩薬の1つであるダントロレン注7)では収縮力低下が著しく改善されました。これらの結果からも、この評価システムを用いることで今までとは異なる効能を持つ化合物の同定が期待されます(図3)。
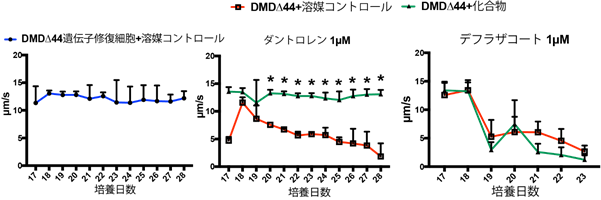
図3 収縮力低下に対する化合物の効果解析30以上の化合物を添加し、収縮力低下に対する効果を評価した。左のパネルは、遺伝子修復細胞の溶媒コントロールのグラフで、中央と右のパネルはDMD∆44株においてそれぞれ効果のあったダントロレンと無かったデフラザコートを添加した際のグラフである。*p値が0.05未満を統計学的に有意とみなした。
最後に、本収縮力低下モデルでより多くの化合物を評価(スクリーニング)する為に、光遺伝学技術を取り入れて解析方法の改良を行いました。従来の電気刺激を用いた評価モデルでは、1プレート辺り6ウェルのプレートを使用していましたが、電気刺激に変わって光刺激を用いる事で、96ウェルプレートでの筋幹細胞の収縮に成功し、解析方法を確立しました(図4A)。特に、隣り合う4ウェルを1データとして解析する事で、データ間でのバラツキを抑える事に成功し、より安定したスクリーニングを行う事が可能になると考えられます(図4AとB)。更に、収縮力低下も光刺激モデルで再現する事が出来た為、今後はより多くの化合物を評価する事が期待されます(図4C)。
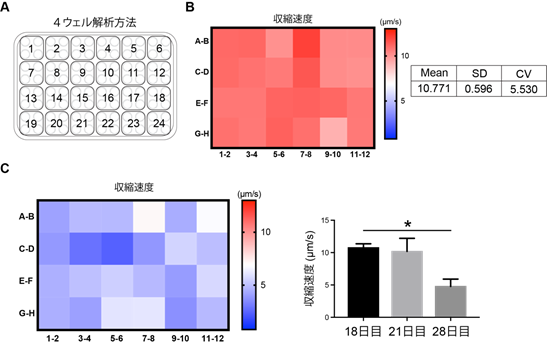
図4 光刺激を用いた96ウェルスクリーニングの系の構築A:96ウェルプレートにおいて、隣り合う4ウェルを1サンプルとして解析する方法の説明
B:光刺激下における分化培養17日目のDMD∆44筋管の収縮速度を、4ウェル解析方法で解析した結果とヒートマップ図。Mean:平均値、SD:標準偏差、CV:変動係数注8)
C:光刺激下における分化培養28日目のDMD∆44筋管の収縮速度を、4ウェル解析方法で解析した結果とヒートマップ図。*p値が0.05未満を統計学的に有意とみなした。
本研究の意義と今後の展望
DMDの患者さんは筋疲労の蓄積が顕著であり、それによる収縮力低下や筋組織の破壊が引き起こされていると考えられていますが、筋疲労を改善し病態の発症を防ぐ様な薬は見出されていませんでした。本研究では、iPS細胞を用いてDMD患者さんに見られる筋疲労の蓄積に似た収縮力低下を再現し、同時に収縮力低下を抑制する効果を持つ化合物を見出しました。さらに、創薬スクリーニングへの展開を見据えて、同時に多数の化合物の評価を可能にする為に、96ウェルプレートでの収縮力評価システムを開発しました。より多くの多検体を一度に評価する為に、384ウェルプレートへの応用展開も含めて、将来的な創薬への道筋を示す事に成功しました。
今後は実際にスクリーニングを行い、薬の種となる化合物を見出す事で筋疲労に似た収縮力低下を改善する薬が、DMDに効果があるかを調べる事を目指します。
論文名と著者
- 論文名
- ”A muscle fatigue-like contractile decline was recapitulated using skeletal myotubes from Duchenne muscular dystrophy patient-derived iPSCs”
- ジャーナル名
- Cell Reports Medicine
- 著者
- Tomoya Uchimura1,2*, Toshifumi Asano3,4, Takao Nakata3,4, Akitsu Hotta1,2, and Hidetoshi Sakurai1,2*
- 著者の所属機関
-
- 京都大学iPS細胞研究所 臨床応用研究部門
- タケダ-CiRA(T-CiRA)共同研究 プログラム
- 東京医科歯科大学 大学院医歯学総合研究科
- 東京医科歯科大学 脳統合機能研究センター
*責任著者
本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 武田薬品工業株式会社「T-CiRA共同研究プログラム」
- AMED再生医療実現拠点ネットワークプログラム「疾患特異的iPS細胞の利活用促進・難病研究加速プログラム」
- JSPS科研費JP18K14663
用語解説
- 注1)コントロール株
- 患者由来iPS細胞の遺伝子変異を修復することで、遺伝的背景が患者株と同一のコントロールとなるiPS細胞株。
- 注2)光遺伝学技術
- 細胞に、光に反応し活性化するタンパク質を発現させることで、細胞の機能を光で調節する技術。
- 注3)サルコメア構造
- 筋繊維を構築している構造の名称で、筋繊維の長軸方向にきれいに並んでいる周期構造の事。培養筋細胞ではサルコメア構造の構築が、成熟化の1つの指標とされている。
- 注4)DMD遺伝子
- ジストロフィン蛋白をコードする遺伝子の名前。
- 注5)409B2 ex45ノックアウト
- 409B2 iPS細胞は健常人から樹立された細胞で、ジストロフィン遺伝子のエクソン45番をゲノム編集することで、人工的にジストロフィンを欠損させたiPS細胞株。
- 注6)カルシウムの過剰流入
- 健常細胞においてはカルシウムの細胞内への流入は制御されているが、DMDにおけるジストロフィン欠損時では、カルシウムの流入が過剰に増加することで様々な悪影響を与えることが知られている。
- 注7)ダントロレン
- 筋弛緩薬の1つ。骨格筋細胞の受容体に結合することで細胞内のカルシウム濃度を低下させ、筋弛緩させる。
- 注8)変動係数
- 標準偏差を平均で割った数。数値が小さい程、平均に対する各データのばらつきが小さいことを表し、スクリーニングにおいてはCV値10以下を可能とした系を構築する場合が多い。
お問い合わせ先
本件担当
京都大学iPS細胞研究所(CiRA)
国際広報室
AMED事業に関すること
日本医療研究開発機構
再生・細胞医療・遺伝子治療事業部 再生医療研究開発課