2021-11-16 京都大学
谷藤一樹 化学研究所助教、大木靖弘 同教授、Markus W. Ribbe カリフォルニア大学アーバイン校教授、Yilin Hu 同教授、R. David Britt カリフォルニア大学デービス校教授らの研究グループは、窒素還元酵素(ニトロゲナーゼ)の触媒活性中心となる金属-硫黄補酵素が、その生合成過程において亜硫酸イオン(SO32–)から硫黄(S)原子を取り込む様子を明らかにしました。
窒素(N)は生命活動に必須の元素であり、ニトロゲナーゼは大気窒素から生物が利用可能な窒素源を生み出すことで生態系を支えています。この酵素の触媒機能はM-cluster(またはFeMoco)と呼ばれるFe-Mo-S-Cからなる活性中心が担っていますが、その生合成過程は未だ明らかになっておらず、ニトロゲナーゼを人工利用する上での妨げとなっています。本研究では、M-clusterの生合成を担うあるタンパク質に着目し、その前駆体であるFe等価体([Fe8S9C])が、タンパク質上で2つの[Fe4S4]クラスターから生成する過程を詳しく調べました。すると、この過程ではSO32–からS原子の取り込みが起こり、さらにそのS原子が同族元素(Se、Te)によって置き換えられることが分かりました。これにより取り込まれた元素の選択的な観測に成功したほか、反応過程のシミュレーションによって一連のプロセスの進行を支持する結果も得ました。この成果は、ニトロゲナーゼが機能するために外部基質となるS源が必要になることを示しており、生物による窒素固定を人工利用する上で重要な発見と言えます。
本研究成果は、2021年10月11日に、国際学術誌「Nature Chemistry」のオンライン版に掲載されました。
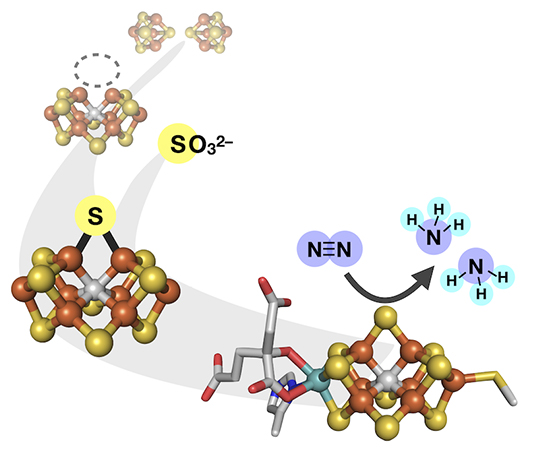
図:本研究の模式図。窒素還元酵素の活性中心(右下)が合成される過程で亜硫酸イオン(SO32–)から硫黄(S)を取り込む様子を表す。
研究者情報
研究者名:谷藤一樹
研究者名:大木靖弘