2022-02-20 東京大学
発表者
季高 駿士(東京大学 大学院総合文化研究科 広域科学専攻 博士課程3年)
岡 芳樹(東京大学 大学院総合文化研究科 広域科学専攻 博士課程3年(研究当時))
椢原 朋子(東京大学 大学院総合文化研究科 広域科学専攻 博士課程3年(研究当時))
林 勇樹(東京大学 大学院総合文化研究科 広域科学専攻 助教)
新井 宗仁(東京大学 大学院総合文化研究科 広域科学専攻 教授)
発表のポイント
- 白血病の一因となるタンパク質に強く結合するペプチド阻害剤を理論的に設計しました。
- ペプチドが持つ、らせん構造の安定性を理論的に予測することで、標的タンパク質への結合を強めることに成功しました。
- 本成果は、ペプチドを用いた医薬品開発への応用が期待されます。
発表概要
東京大学大学院総合文化研究科の季高駿士大学院生と新井宗仁教授らの研究グループは、白血病の一因となるタンパク質に結合するペプチド阻害剤の理論的な設計に成功しました。
タンパク質は生命活動に重要な分子であり、それらが決まった相手と結合することで機能を発揮します。しかし、そこに異常が生じると、がんや白血病などの疾患が引き起こされます。したがって、疾患の原因となるタンパク質に強く結合する物質を開発し、決まった相手との結合を阻害できれば、その物質は疾患の治療薬候補になります。近年、そのような阻害剤としてペプチド(注1)が注目されています。しかし、標的となるタンパク質に強く結合できるペプチドを、計算機や理論などを用いて合理的に設計する手法の開発が課題となっていました。
今回、ペプチドが持つらせん構造(ヘリックス)の安定性を理論的に予測することで、白血病の一因となるタンパク質に強く結合し、決まった相手との結合を阻害できるペプチドの開発に成功しました。また、らせん構造を持つペプチドを安定化させるシンプルな方法を見出しました。本研究の成果は今後、ペプチドを用いた医薬品開発への応用が期待されます。
本研究成果は2022年1月20日付(英国時間)でオープンアクセス誌「Scientific Reports」オンライン版に掲載されました。
発表内容
研究の背景・先行研究における問題点
生体内にはさまざまなタンパク質があり、それらが相互作用(結合)することで生存に重要な機能を発揮しています。そのような「タンパク質間相互作用」(Protein-protein interaction, PPIともいう)は、約65万種類にも及ぶと言われています。タンパク質間相互作用の中には、がんや白血病などの重大な疾患の原因となるものもあります。それゆえ、疾患に関わるタンパク質間相互作用を阻害することは、創薬における新たなアプローチ法として注目されています。
白血病の原因となるタンパク質間相互作用の一つに、「c-Myb」と「KIX」というタンパク質同士の相互作用があります(図1)。c-Mybは転写因子(注2)の一種であり、細胞内でDNAに結合します。また、転写を助けるタンパク質であるCBPのKIXドメイン(注3)にも結合し、これによって未分化造血細胞の増殖に必要なタンパク質の合成を促進します。しかし、c-Mybが異常に増えてc-MybとKIXとの結合が次々に起きると、細胞が異常に増殖してしまい、白血病の原因となります。それゆえ、c-MybとKIXとのタンパク質間相互作用を阻害する物質の創製は、白血病の治療薬開発に役立つと期待されています。このような物質を創製するためのアプローチの一つは、c-MybよりもKIXに強く結合する物質、すなわち、KIXをターゲットとした阻害剤を開発し、これをKIXに結合させることで、c-MybとKIXとの結合をブロックするという方法です。
これまでの医薬品開発では、そのような阻害剤として、主に低分子化合物やモノクローナル抗体が使われてきました。しかし、タンパク質間相互作用は、従来の創薬ターゲットと比べると結合表面が広く浅いため、低分子化合物による阻害は困難です。これに対し、モノクローナル抗体はタンパク質間相互作用を阻害できますが、製造コストが高いだけでなく、細胞内への輸送が困難なため、c-MybとKIXとの相互作用のように細胞内で起きるタンパク質間相互作用を阻害することは困難となっています。
そこで最近注目されているのが、低分子化合物とモノクローナル抗体の中間にあたる「ペプチド」などの中分子医薬品です。ペプチドは、タンパク質間相互作用を阻害できるうえに、抗体に比べて製造コストが低く、また細胞内への輸送も比較的容易です。このようなペプチド阻害剤を開発する際には、非常に多種類のペプチドを実際に作製し、それらの中から標的タンパク質に強く結合できるペプチドを見つけ出すという進化分子工学的手法がこれまでの主流です。この方法は2018年にノーベル化学賞が授与された重要な手法ですが、時間と労力が必要という問題があります。そこで現在、標的となるタンパク質に強く結合できるペプチドを、計算機や理論などを用いて合理的に設計する手法の開発が急務となっています。
研究内容
c-MybとKIXとのタンパク質間相互作用が白血病の原因となりうることから、研究グループは、両者の相互作用を阻害すること目的として、c-MybよりもKIXに強く結合するペプチドの開発を行いました。c-Mybは640個のアミノ酸が繋がってできたタンパク質ですが、KIXとの結合に関与するのは、その中の「Myb32」と呼ばれる32個のアミノ酸からなる領域のみです。Myb32に相当する部分だけを切り出したペプチドはKIXに結合できますが、DNAに結合する領域(図1内のDBD)を含まないため、転写を促進することはありません。このMyb32ペプチドがKIXに結合すると、c-MybはKIXに結合できなくなります。つまり、Myb32ペプチドは、c-MybとKIXとのタンパク質間相互作用の阻害剤として利用可能と考えられます。
研究グループは以前、Myb32ペプチドがKIXと結合するときには、最初にらせん状の構造(ヘリックスと呼ぶ)を作る必要があることを明らかにしました(図1)。このことは、Myb32ペプチドのヘリックス構造を安定化させることができれば、KIXへの結合を強化できることを示唆しています。また、ヘリックス構造の安定性は、ペプチドを構成するアミノ酸の並び方(アミノ酸配列)が与えられれば、AGADIRというサーバーを用いて理論的に予測可能です。そこで研究グループは、Myb32を構成するアミノ酸の一部を別のアミノ酸に置き換えて、KIXとさらに強く結合するペプチドを、次のように理論的に設計しました。
まず、Myb32ペプチドの中でKIXとは接触しない部位を選び、その部位のアミノ酸を、生物が利用している基本的なアミノ酸(20種類)に1つずつ置換していき、それらのペプチド変異体が形成するヘリックス構造の安定性を理論的に予測しました。そして、もとのMyb32ペプチド(野生型)よりもヘリックス構造が安定になると予測されたMyb32ペプチド変異体の中から、特に有望なものを3つ選択しました(それぞれ変異体1、変異体2、変異体3と名付ける)。このようにして、ペプチド阻害剤の候補を理論的に設計しました。
設計したMyb32ペプチド変異体を実際に作製し、実験により検証した結果、予想通りこれらの変異体ではヘリックス構造が安定化しました(図2上)。また、各変異体に含まれるアミノ酸置換を複数組み合わせた変異体(変異体1+2、変異体1+3、変異体2+3、変異体1+2+3)を作製したところ、ヘリックス構造はさらに安定化しました(図2上)。ヘリックス構造が安定化したことに伴って、これらのペプチド変異体のKIXへの結合も、期待通りに強くなりました(図2下)。特に、3種類のアミノ酸置換を組み合わせた変異体(変異体1+2+3)では、もとのMyb32ペプチド(野生型)に比べて、約3倍強くKIXと結合できるようになり、結合の強さの指標である解離定数(注4)は80 nMになりました。この変異体1+2+3では、リジンというアミノ酸をアルギニン(Rで表す)という別のアミノ酸に置換した場所が3か所あったので、RRRペプチドと名付けました。このRRRペプチドは、実際にc-MybとKIXとのタンパク質間相互作用を効率的に阻害することも確認されました。
今回得られたRRRペプチドは、理論的予測に基づいて、もともとリジンだったアミノ酸3か所をそれぞれアルギニンに置換するという至ってシンプルな手法で開発することができました。リジンとアルギニンというアミノ酸はどちらも正電荷を持ち、よく似たアミノ酸であるため、それらを置き換えてもペプチドは本来の機能を維持できると考えられます。したがって、リジンをアルギニンに置換するという方法は、ヘリックス構造を持つペプチドを安定化させ、標的タンパク質への結合親和性を向上させるうえでのシンプルかつ有効な手法であると期待されます。
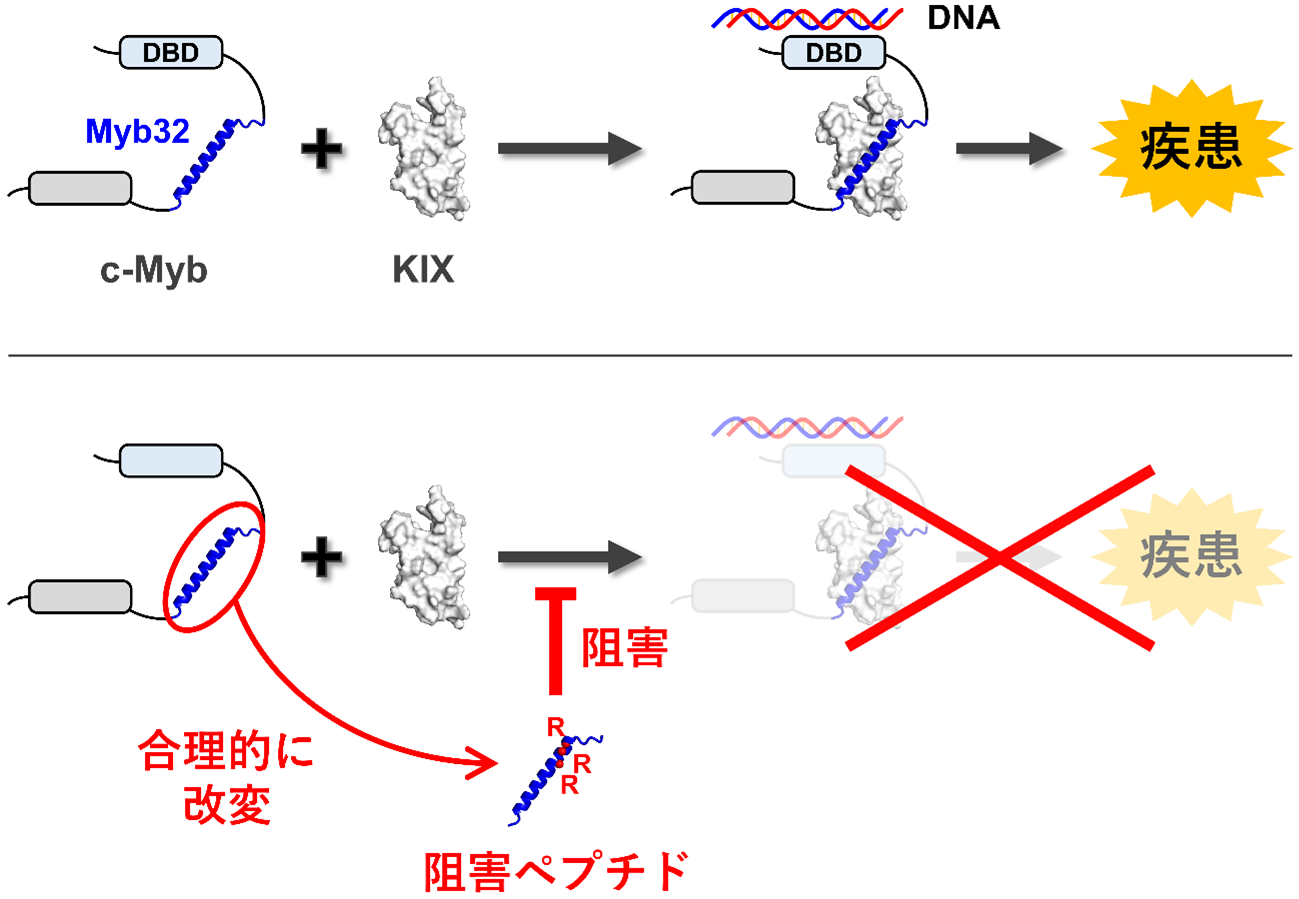
図1.(上段)KIXとc-Mybとの結合は、白血病の一因となる。c-Mybには、KIXに結合する領域(Myb32、青色)と、DNAに結合する領域(DBD)がある。(下段)Myb32に相当する領域だけを切り出したペプチド(野生型)にアミノ酸置換を導入した阻害ペプチド(Myb32ペプチド変異体)は、c-MybよりもKIXに強く結合できる。これによってc-MybがKIXに結合するのをブロック(阻害)する。特に、Myb32にあった3つのリジンというアミノ酸をアルギニン(Rで表す)というアミノ酸に置き換えると、KIXと非常に強く結合できるようになった。
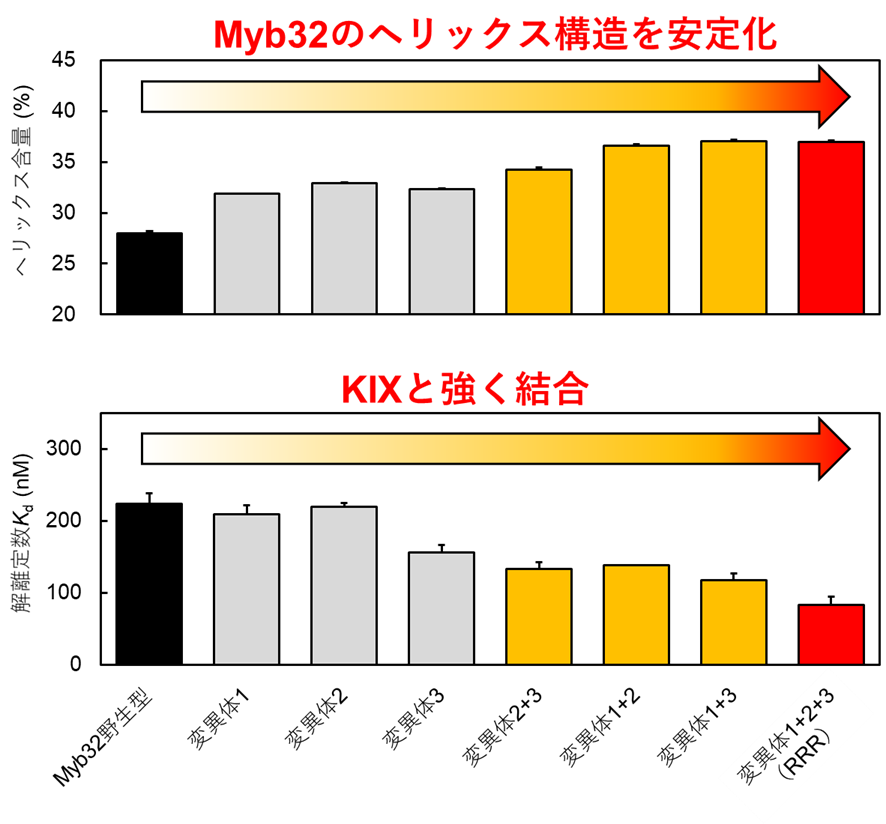
図2.Myb32ペプチドのヘリックス構造を安定化させると、ターゲットとするKIXタンパク質に強く結合できるようになった。(上段)棒グラフの値が大きいほど、ヘリックス構造が安定であることを表す。(下段)棒グラフの値が小さいほど、KIXとの結合が強いことを表す。
社会的意義・今後の予定
今回開発されたRRRペプチドは今後、白血病の治療薬開発への応用が期待されます。
本研究から、ペプチドのヘリックス構造を安定化させるという手法は、標的タンパク質への結合親和性を向上させるうえで有効であることが示唆されました。また、ヘリックス構造を持つペプチドを安定化させる簡単な方法を見出しました。タンパク質間相互作用は新たな創薬のターゲットであり、しかも、その半分以上にヘリックス構造が関与していることが報告されています。本研究で用いられたペプチド阻害剤の設計手法は非常にシンプルなため、今後、さまざまなタンパク質間相互作用を標的とした医薬品開発において有用であると期待されます。
本研究は、科研費「基盤研究(A)(課題番号:JP16H02217)」、「基盤研究(B)(課題番号:JP19H02521)」、「挑戦的研究(萌芽)(課題番号:JP21K18841)」の支援により実施されました。
用語解説
(注1)ペプチド
数個から数十個程度のアミノ酸が鎖のようにつながってできた物質のこと。数十個以上のアミノ酸がつながったものはタンパク質と呼ばれる。
(注2)転写因子
DNAに結合して転写反応(RNAの合成反応)を制御するタンパク質のこと。DNAだけでなく、転写コアクチベーター(転写を助けるタンパク質)にも結合し、転写を促進したり抑制したりする機能をもつ。
(注3)KIX
転写コアクチベーターであるCREB結合タンパク質(CBP)の一部分であり、c-Mybなどの転写因子に結合する。87個のアミノ酸からなり、3本のヘリックスが束になった構造を持つ。c-MybがKIXに結合すると、未分化造血細胞の増殖に必要なタンパク質を作り出すための転写反応が促進される。
(注4)解離定数
物質同士の結合の強さを表す指標であり、この値が小さいほど強く結合できることを意味する。濃度の単位を持っており、解離定数と同程度の濃度で物質が存在していれば結合できるという目安になる。80 nMとは8×10-8 M(Mはモル濃度の意味)のことであり、このくらい少量のRRRペプチドがあればKIXに結合できることを示唆している。
論文情報
Shunji Suetaka, Yoshiki Oka, Tomoko Kunihara, Yuuki Hayashi, Munehito Arai*, “Rational design of a helical peptide inhibitor targeting c-Myb–KIX interaction,” Scientific Reports: 2022年1月20日, doi:10.1038/s41598-021-04497-w.
論文へのリンク (掲載誌)