2022-04-21 大阪大学,日本医療研究開発機構
研究成果のポイント
- 研究グループが独自に開発したヒトiPS細胞を用いた2次元の眼様オルガノイド※1誘導法により、涙腺様細胞が誘導できることを確認した。
- 誘導細胞の中から涙腺前駆細胞を単離し、3次元培養することで腺発生に特徴的な導管の出芽(budding)と分岐(branching)を伴う3次元涙腺オルガノイドを誘導することに成功した。
- 得られた3次元涙腺オルガノイドは動物(ラット)への移植により、成熟した涙腺組織へと分化した。
- ヒトiPS細胞から涙腺オルガノイドの作製は世界初の技術であり、シェーグレン症候群※2等により引き起こされる重症ドライアイに対する再生治療法や薬剤の開発が期待される。
概要
大阪大学大学院医学系研究科の林 竜平寄附講座教授(幹細胞応用医学)、西田幸二教授(眼科学)らの研究グループは日本医療研究開発機構(AMED)の支援を受け、ヒトiPS細胞から機能的な3次元涙腺オルガノイドを作製する方法を新たに確立しました。
角膜と結膜に覆われる眼の表面(眼表面)の恒常性維持には涙液層の存在が必須です。涙液層は主に涙腺からの涙液やムチン分泌により維持されていますが、シェーグレン症候群などの自己免疫疾患などにより涙腺に障害が起きると、眼表面が乾燥し、重篤なドライアイとなります。
研究グループではヒトiPS細胞から角膜や結膜を作製することに成功していました。一方、涙腺の作製はこれまでに報告がありませんでした。そこで研究グループは、角膜、結膜、涙腺は同じ発生起源であることに着目し、以前に角膜、結膜の誘導に用いた2次元眼オルガノイド(SEAMと命名)の誘導法を応用し、新たに涙腺原基の分化誘導を試みました。まず、SEAM法で誘導した2次元眼オルガノイド内に涙腺様細胞クラスターの出現を見出し、さらにセルソーターを用いてiPS細胞由来涙腺前駆細胞を単離し、基底膜細胞外基質を豊富に含むマトリゲル※3内で3次元培養を行うことで、導管の出芽(budding)と分岐(branching)を生じる、3次元涙腺組織(オルガノイド)の作製に成功しました(図1)。
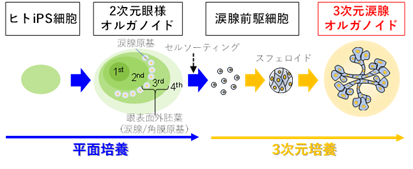
図1 本研究のまとめヒトiPS細胞から平面培養により誘導される眼様オルガノイドのzone-3には涙腺・角膜の共通原基と考えられる眼表面外胚葉が誘導される。さらなる誘導の後、セルソーティングにより涙腺前駆細胞を単離しマトリゲル内で3次元培養を行うことで立体構造を有した3次元涙腺オルガノイドを誘導することに成功した。
本研究成果により、これまで再生が不可能であった立体的な涙腺組織をヒトiPS細胞から作製することが可能となり、重症ドライアイに対する根治的再生治療法の開発が可能となりました。また、入手困難なヒト涙腺組織をiPS細胞から大量に作製できることで、ドライアイなどに対する創薬研究や病態解明研究において大きな進捗が期待されます。
本研究成果は、英国科学雑誌「Nature」に2022年4月21日(木)午前0時(日本時間)に公開されました。
研究の背景
眼の表面は涙液層により保護され、その光学的機能や防御機能を維持しています。この眼表面の恒常性は眼の外分泌腺である涙腺からの涙液分泌が重要な役割を担っています。シェーグレン症候群、移植片対宿主病※4、角膜上皮幹細胞疲弊症※5(スティーブンス・ジョンソン症候群など)などの疾患では涙腺機能障害により重症ドライアイが生じることで、眼表面の恒常性が破綻し、結果として視機能異常等が引き起こされます。また、難治性角結膜疾患の多くで重症ドライアイを併発し、眼表面環境が不良のため角膜再生医療が奏功しにくいといった問題もあります。しかしながら、眼表面環境維持に重要な涙腺は大人の体では再生しないため、人口涙液等の点眼による対症療法のみで、根治的治療法が存在しないのが現状でした。
これまでに研究グループは、ヒトiPS細胞を用いて様々な眼の細胞を含む眼オルガノイドである多帯状コロニー(Self-formed Ectoderm Autonomous Multi-zone; SEAM、図2)の誘導法を確立し、SEAMおよびその改変法により角膜上皮や結膜上皮組織の作製に成功しています(Hayashi R. et al. Nature 2016, Nat Protoc. 2017, Nomi K. et al. Cell Rep. 2021)。涙腺は結膜上皮や角膜上皮と同じ眼表面外胚葉に由来する組織であるものの、ヒト涙腺の発生機構は殆どわかっておらずまた、シート状に形成される角結膜上皮とは異なり、涙腺は複雑な3次元構造を有することなどから、ヒトiPS細胞など多能性幹細胞からの誘導はこれまで報告されていませんでした。
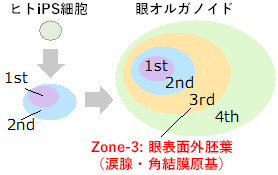
図2 SEAMの模式図SEAMは同心円状の4層構造を形成し、zone-3に涙腺・角結膜上皮原基である眼表面外胚葉が発生する。
そこで、本研究では、SEAM法に基づき涙腺のもととなる涙腺原基(前駆細胞)を同定し、さらに3次元培養を行うことで機能的な立体組織としての涙腺オルガノイドの作製を試みました。
本研究の成果
研究グループはまずヒトiPS細胞からSEAM法を用いて2次元の眼オルガノイドを作製しました。このオルガノイド内の眼表面外胚葉(涙腺・角膜の共通発生原基)の領域(zone-3)において、涙腺マーカーであるPAX6やSOX9を発現する腺様構造を有する細胞クラスターが広く点在していることを見出しました。この腺様細胞クラスターを顕微鏡下で単離し、マトリゲル中で3次元培養を行ったところ、数日後には複数の導管の出芽(budding)および伸長が認められ、十数日後にはさらに分岐(branching)が生じ、涙腺様の立体構造を呈しました(図3A)。この腺様細胞クラスターの単離は目視によるため不純物が多く含まれていたことから、次に眼表面外胚葉の細胞表面マーカー(CD200, ITGB4, SSEA-4)を用いてセルソーティングによる涙腺前駆細胞の単離を試みたところ、CD200陰性、ITGB4陽性、SSEA-4陽性画分でのみオルガノイドが形成されたことから、この画分が涙腺前駆細胞画分であると考えられました(図3B)。得られた3次元涙腺様オルガノイドは涙腺マーカーであるPAX6、AQP5、SOX9を発現していました(図3C)。また、以前に示したように本細胞画分は角膜上皮前駆細胞画分でもあることから、角膜上皮と涙腺は同一原基(眼表面外胚葉)に由来することが示されました。以上の結果より、ヒトiPS細胞からSEAMを介して3次元涙腺オルガノイドを作製することに成功しました。

図3 SEAM中の涙腺前駆細胞と3次元涙腺オルガノイドの作製A.ヒトiPS細胞由来SEAMのzone-3(涙腺・角膜原基領域)に出現する涙腺様細胞クラスターを単離し、マトリゲル内で培養したところbuddingおよびbranchingを生じ、3次元涙腺様オルガノイドが形成された。B.セルソーティングで単離した涙腺前駆細胞を3次元培養することで涙腺オルガノイドを作製した。C.3次元涙腺オルガノイドは涙腺マーカー(PAX6, AQP5, SOX9)を発現した。
続いて、得られた涙腺オルガノイドの生体内における生着と機能的な成熟を調べるために、免疫不全ラット(ヌードラット)への移植実験を行いました。移植用のオルガノイドを調製するために、5つの涙腺前駆細胞スフェロイド(細胞塊)を同一ウェル内で培養することでオルガノイドは融合し、一つの涙腺オルガノイドとして培養可能でした(図4A)。マトリゲル内に包埋したオルガノイドを、ヌードラットへ移植することにより、in vitroでは不十分であった導管形成や細胞の極性がより明確となり涙腺組織としての成熟化が認められました(図4B、C)。同様にin vitroでは殆ど発現が認められなかった涙液の防御タンパク質であるラクトフェリンやリゾチームの発現が移植後においては認められ、有意に増加しました(図4D)。またその産生量は、移植したオルガノイドの数が多く、涙腺環境が残存している場合でより高くなることが示されました。一方で、生着したオルガノイドの量がまだ十分でないことや、成熟化も実際の涙腺組織と比較すると低いことなど、涙腺再生医療の実用化に向けての課題も見出しました。以上の結果より、ヒトiPS細胞由来涙腺オルガノイドは移植後生体内に生着し、生体環境においてその機能がより成熟することが示されました。
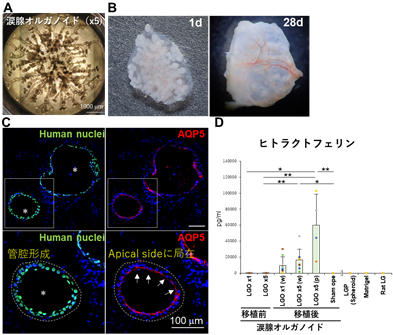
図4 涙腺オルガノイドの動物への移植A.5つの涙腺前駆細胞スフェロイドを同一ウェル内で培養し、移植用涙腺オルガノイド(x5)を作製した。B.移植後1日と28日の移植組織を摘出し、涙腺オルガノイドの残存を確認した。C.摘出組織(4週間)を抗ヒト細胞抗体等で染色したところ、移植細胞は涙腺マーカーのAQP5を発現し、さらにin vitroでは認められなかった管腔の形成やAQP5の細胞上部側への局在化など涙腺としての成熟化が認められた。D.ELISAにより移植涙腺オルガノイド(LGO x1、x5)はラクトフェリンを産生することを確認した。(w):涙腺全摘出、( p):半摘出モデル
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、これまで困難と考えられていた涙腺再生医療を実現するための基盤技術を確立することができました。本発見は涙腺再生医療の開発を進める上での大きなブレークスルーとなるだけでなく、ヒト涙腺オルガノイドを用いた薬剤スクリーニングや患者由来iPS細胞を用いた病態解明研究への応用が進むことで、これまで根治的治療法が存在しなかった重症ドライアイに対する新しい治療法を提供可能になると期待されます。
特記事項
本研究成果は、2022年4月21日(木)午前0時(日本時間)〔2022年4月20日(水)午後4時(英国時間)〕に英国科学雑誌「Nature」(オンライン)に掲載されました。
- タイトル
- “Generation of 3D lacrimal gland organoids from human pluripotent stem cells”
- 著者名
- Hayashi R1,2,3, Okubo T1,4, Kudo Y1,4, Ishikawa Y1,2, Imaizumi T1,4, Suzuki K1.2, Shibata S1,4,5, Katayama T2, Park S6, Young R7, Quantock A7, and Nishida K2,3.
- 所属
-
- 大阪大学大学院医学系研究科幹細胞応用医学
- 大阪大学大学院医学系研究科眼科学
- 大阪大学先導的学際研究機構生命医科学融合フロンティア研究部門
- ロート製薬株式会社
- 東北大学大学院医学系研究科情報遺伝学
- 東京大学医科学研究所ヒトゲノムセンター機能解析イン・シリコ分野
- Cardiff University, School of Optometry and Vision Sciences
なお、本研究は主に日本医療研究開発機構(AMED)・再生医療実現拠点ネットワークプログラム技術開発個別課題「協調的眼細胞誘導法による眼腺組織作製と再生治療法開発」(研究開発代表者:林 竜平)、日本学術振興会・科学研究費助成事業 基盤研究B「多能性幹細胞を用いた足場環境の調節による眼発生機構の解明と生理的眼発生の再現」(研究代表者:林 竜平)の助成を受けて行われました。
用語説明
- ※1 オルガノイド
- 培養皿の中で幹細胞から作製される生体の臓器に似た培養物で、再生医療や創薬への利用が期待されている。
- ※2 シェーグレン症候群
- 自身の免疫系が主に涙腺と唾液腺を攻撃する自己免疫疾患で、ドライアイやドライマウス(口腔乾燥)の症状を生じる。女性に多く発症する。
- ※3 マトリゲル
- ラミニンなどの基底膜細胞外基質を豊富に含んだゲルでマウスの肉腫より抽出される。オルガノイドの作製など3次元培養時に使用される。
- ※4 移植片対宿主病
- 造血幹細胞移植などでドナーのリンパ球が患者の組織を他人と認識し、攻撃する疾患。ドライアイは移植片対宿主病の合併症として生じることがある。
- ※5 角膜上皮幹細胞疲弊症
- スティーブンス・ジョンソン症候群、眼類天疱瘡、外傷などにより角膜上皮の幹細胞が完全に消失する疾患。角膜移植等の既存法での治療は困難であるが、近年、iPS細胞等を用いた再生治療法の開発が進められている。
本件に関するお問い合わせ先
研究に関すること
林 竜平(はやし りゅうへい)
大阪大学大学院医学系研究科 幹細胞応用医学寄附講座 教授
報道に関すること
大阪大学大学院医学系研究科 広報室
AMED事業に関すること
日本医療研究開発機構
再生・細胞医療・遺伝子治療事業部 再生医療研究開発課